硫化氢(Hydrogen sulfide,H2S)是一种无色、有臭鸡蛋气味的气体。由于它对含亚铁离子的蛋白质如细胞色素氧化酶、血红蛋白、肌红蛋白等具有很强的亲和能力,因此被认为是引起2.5亿年前物种大灭绝的元凶[1]。但后来H2S在生物体内有益的生理效应逐渐得到证实。自20世纪80年代末,人和大鼠等哺乳动物的大脑中均被检测出有低浓度的H2S存在以来,H2S的多种生理功能,如调节胰岛素的分泌、神经系统的活动及血管的舒张等方面的功能逐渐被揭开[2, 3]。20世纪90年代中期,H2S已被确认为是继一氧化碳(Carbon monoxide,CO)和一氧化氮(Nitric oxide,NO)后动物体内的第三种气体信号分子[4]。
在植物体内,H2S现已被证实是一种重要的细胞信号分子,参与种子的萌发、植物的生长发育,以及植物耐逆性包括耐旱性的形成[5-8]。作为信号分子的H2S,与其它信号分子Ca2+、活性氧(Reactive oxygen species,ROS)、NO一样,具有多条引发或合成途径,这为它行使信号分子的功能奠定了重要的基础。一般认为,H2S主要通过L-半胱氨酸脱硫基酶(L-cysteine desulfhydrase,LCD)、D-半胱氨酸脱硫基酶(D-cysteine desulfhydrase,DCD)、亚硫酸还原酶(Sulfite reductase,SiR)等分别催化L-半胱氨酸、D-半胱氨酸和亚硫酸盐等的合成。通过这些途径产生的H2S,在半胱氨酸合成酶(Cysteine synthetase,CS)的作用下,被迅速地转化为半胱氨酸[5-8]。也有报道,CS催化的逆反应也可合成H2S[8]。在这些代谢途径的共同作用下,生理条件下植物细胞中的H2S浓度维持在较低的稳态水平。在不良环境如干旱胁迫下,植物体内的H2S合成途径可迅速被激活(主要是LCD),继而诱发H2S的短暂积累,成为植物感受和响应逆境胁迫的第二信使,引发一系列生理生化、分子和基因表达的变化,最终触发植物耐逆性的形成[5-8]。类似地,外源提供H2S供体,主要是NaHS和GYY4137(Morpholin-4-ium 4-methoxyphenyl(morpholino)phosphinodithioate),其释放的H2S也可被植物体吸收,同样引发植物耐逆性的形成[5-8]。
由于全球气候变暖,干旱已经成为了限制作物产量最主要的一种环境胁迫因子,其对作物生长的危害相当于其他各环境胁迫造成的危害之和[9]。因此对植物耐旱性的研究具有十分重要的科学及农学意义。如上所述,H2S作为一种气体信号分子,越来越多的证据表明其参与植物耐旱性的形成[9-11]。本文结合最新的研究进展,在讨论H2S信号与其它信号如ROS、NO、脱落酸(Abscisic acid,ABA)、乙烯(Ethylene,ETH)、microRNAs等交互作用的基础上,从气孔运动、渗透调节物质、抗氧化系统、甲基乙二醛脱毒系统、热激蛋白等方面,综述了H2S诱导植物耐旱性形成的可能机理,并提出了未来的研究方向。此外,本文进一步拓展了H2S信号的生理功能和植物耐旱性形成的机理,对深入研究H2S与植物耐逆性包括耐旱性的关系,具有重要的指导意义。
1 干旱对植物的伤害干旱是限制作物产量最主要的胁迫因子之一,干旱胁迫常常表现出渗透胁迫、氧化胁迫、甲基乙二醛(Methylglyoxal,MG)胁迫、生物膜损伤和蛋白质变性等(图 1)[8, 9, 12]。渗透胁迫主要是指由于土壤缺水而降低其水势,导致植物吸水和保水困难的一种胁迫方式;氧化胁迫是指由于逆境胁迫下ROS的大量增加,导致蛋白质氧化、膜脂过氧化、核酸损伤,乃至细胞死亡的一种次级胁迫方式;MG胁迫与氧化胁迫相似,主要是逆境胁迫下细胞代谢(主要是光合作用、呼吸作用、氨基酸代谢、脂质代谢)的紊乱导致MG的增加,从而破坏蛋白质、核酸、膜脂等生物大分子的次级胁迫方式[8, 9, 12]。一般认为,ROS可引发MG的积累,产生MG胁迫。反过来,MG也可促进ROS的产生,诱发ROS胁迫[12]。这些次级胁迫,都可导致生物膜的损伤和蛋白质的变性。所以,植物耐旱性的获得,通常表现为通过引发与植物耐旱性相关的信号分子之间的交互作用,继而通过细胞渗透调节能力、抗氧化能力和MG清除能力的增强,生物膜的修复,以及逆境蛋白如热激蛋白(Heat shock proteins,HSPs)的合成来实现。以下进一步讨论H2S信号与其它信号分子如ROS、NO、ABA、ETH及microRNAs等的交互作用,引发植物耐旱性的可能机理。
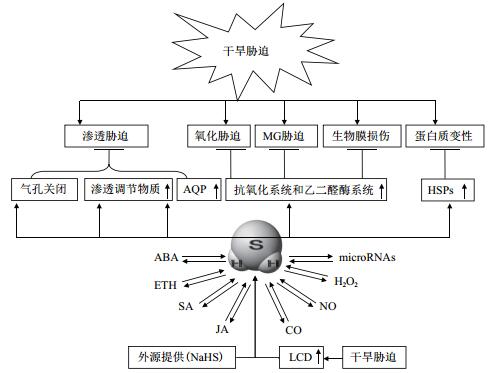
|
| 图 1 H2S引发植物耐旱性获得的机理 |
在植物耐旱性研究中,气孔运动已经成为植物信号转导的模式系统[13]。大量的研究表明,H2S在植物体内并不是独自的发挥作用,而是和其他信号分子如ROS、NO、ABA、ETH及microRNAs等交互作用,这些交互作用在植物体内形成了复杂的信号网络,调控植物耐逆性包括耐旱性的形成。H2S可诱导气孔的关闭,并且这种关闭是ABA依赖的。在ABA诱导气孔关闭过程中,其信号通路涉及许多第二信使,如Ca2+、蛋白激酶、蛋白磷酸酶、过氧化氢(Hydrogen peroxide,H2O2)和NO等,最终诱发植物耐旱性的获得[14]。Scuffi等[15]以半胱氨酸脱巯基酶(Desulfhydrase,DES1,H2S合成的关键酶)拟南芥突变体为材料,研究保卫细胞内ABA依赖性信号通路中H2S和NO之间的交互作用,结果表明内源性NO的减少可以阻碍H2S诱导的气孔闭合,而外源施加NaHS(H2S供体)则可逆转这一效应,这意味着气孔运动的过程中存在H2S和NO之间的交互作用,并且H2S可能在NO的上游发挥作用。类似地,在拟南芥中,刘菁等[16]则发现,ETH可诱导气孔的关闭,在此通路中NO可诱发H2S的积累,说明NO和H2S共同参了气孔的关闭,并且H2S是NO的下游信号分子。在蚕豆幼苗中,也发现H2S和H2O2共同参与茉莉酸(Jasmonic acid,JA)诱导的气孔关闭,并且H2S位于H2O2的下游[17]。类似地,在大豆耐旱性形成过程中,H2S可以通过诱导H2O2的积累来提升耐旱性[18]。我们以前的研究也发现,H2S可促进绿豆种子的萌发,此过程受H2O2介导,暗示H2S在H2O2的上游调控种子的萌发[19]。
植物除了在感受和响应干旱胁迫过程中存在H2S与其它信号分子的交互作用外,在其它耐逆性形成中也存在这种交互作用。在玉米幼苗中,水杨酸(Salicylic acid,SA)可激活LCD活性,诱导内源H2S的积累,从而提高玉米幼苗的耐热性。说明在植物耐热性形成中,SA可能在H2S的上游发挥作用[20, 21]。而在H2O2诱导的玉米幼苗耐热性形成中,H2O2首先引发内源NO的积累,继而诱导内源H2S的产生,暗示H2S是在H2O2和NO的下游触发耐热性的形成[22]。同样,在烟草悬浮培养细胞中,外源Ca2+、ABA和CO处理可分别提高细胞的耐热性,并且这种耐热性的获得可被H2S合成抑制剂炔丙基甘氨酸(DL-propargylglycine,PAG)和清除剂次牛磺酸(Hypotaurine,HT)所消除。此外,Ca2+、ABA和CO处理均可激活LCD活性,继而诱发内源H2S的积累[23-25]。这些结果说明,在植物耐热性形成中,H2S可能在Ca2+、ABA和CO的下游发挥生物学效应。在黄瓜中,Lin等[26]的研究也发现,通过外源施加NaHS和CO都可诱导不定根的形成,而外源NaHS和CO合成抑制剂锌原卟啉Ⅸ(Zinc protoporphyrin Ⅸ,ZnPPIX)共同处理,则抑制了不定根的形成,CO和H2S清除剂HT不能影响这一反应,暗示不定根形成过程中H2S和CO存在着交互作用,且H2S是CO的上游信号分子。
更有趣的是,在模式植物拟南芥中,H2S处理可引发microRNAs基因(MIR167、MIR393、MIR396、MIR398等)的大量表达,这种表达可能与植物耐旱性的形成密切相关[27]。
上述结果表明,在环境或化学方法引发(Environment priming or chemical priming)的植物耐逆性特别是耐旱性和耐热性形成过程中,存在以H2S信号为中心的信号交互作用,并且这种交互作用可能还进一步调控种子的萌发、植物的生长和发育过程,详细的机理有待于进一步研究。
3 H2S引发植物的耐旱性如上所述,植物耐旱性的获得涉及以H2S信号为中心的信号交互作用,这种交互作用通过进一步调控渗透调节、ROS和MG清除、生物膜修复和HSPs合成,诱导植物耐旱性的形成(图 1)。H2S诱发的植物耐旱性的形成分述如下。
3.1 H2S诱导渗透调节物质的积累与植物耐旱性植物耐旱性的获得常通过减少水分的散失、加强细胞的吸水和保水能力,以及动员水分的运输等策略来实现。关闭或减小气孔的开放程度是调节水分散失的重要手段。如上所述,信号分子H2S通过与ABA、ETH、NO和H2O2的交互作用调节气孔的运动[14-18],为植物耐旱性的形成奠定了重要的基础。加强细胞的吸水和保水能力,最重要的是降低细胞的水势。植物在干旱等胁迫条件下,可主动吸收矿质离子(如Ca2+、K+、Cl-)及合成有机小分子物质(如脯氨酸、甜菜碱、可溶性糖、海藻糖、多胺等)来降低植物细胞的渗透势和水势,从而增强细胞的吸水和保水能力,这种调节方式称为渗透调节(Osmotic adjustment)[9, 28, 29]。主动合成的有机小分子物质称为渗透调节物质(Osmotic adjustment substances)或兼容性物质(Compatible solutes)[9, 28, 29]。这些渗透调节物质不仅可降低细胞的水势,而且可作为小分子伴侣,维持生物大分子蛋白质、核酸的稳定和生物膜的完整性[9, 28, 29]。研究表明,渗透调节物质还具有清除ROS、维持胞内pH稳定,以及作为干旱胁迫期间C和N源的储存库,在胁迫解除后使植物能快速恢复生长[30],是一种多功能的活性物质。Zhang等[31]发现,随着聚乙二醇6000(Polyethylene glycol,PEG-6000)浓度的上升,小麦的发芽率逐渐下降,而NaHS处理可以促进小麦在渗透胁迫下的发芽率,并且同时施加Na+和其它含硫物质(S2-、SO42-、SO32-、HSO4-和HSO3-),发现均不能代替NaHS,从而证明诱导植物耐旱性的外源H2S或HS-来自NaHS,具有专一性。
脯氨酸是一种最常见的渗透调节物质,在其合成中,∆'-吡咯啉-5-羧酸合成酶(∆'-pyrroline-5-carboxylate synthetase,P5CS)是关键酶,其活性的大小在一定程度上反应植物的耐旱性[30, 32]。在PEG-6000模拟的干旱条件下,玉米叶片中P5CS活性较正常情况有所提高,脯氨酸含量也相对有所提升,而对玉米叶片施加低浓度的NaHS溶液,可以进一步提升叶片中P5CS活性,从而使叶片内脯氨酸大量积累,增加玉米对干旱胁迫的耐受性[33]。同样,通过施加外源性H2S,也可以增加狗牙根在干旱、低温和盐胁迫下的渗透调节物质脯氨酸、蔗糖、可溶性糖等的积累,从而促进狗牙根对干旱等非生物胁迫的耐受性[34]。Chen等[35]也发现,在面对干旱胁迫的过程中,通过外源施加NaHS可以使菠菜幼苗中海藻糖、甜菜碱、可溶性糖和多胺的含量上升,并且几种与多胺和可溶性糖合成有关的基因以及海藻糖-6-磷酸酶(Trehalose-6-phosphatase,T6P)、甜菜碱醛脱氢酶(Betaine aldehyde dehydrogenase,DABH)和胆碱单加氧酶(Choline monooxygenase,CMO)的活性都得到增强,从而证实H2S通过对多胺和可溶性糖的影响来调控菠菜的耐旱性,同时也发现甜菜碱和可溶性糖在提高菠菜的耐旱性中起重要作用。在玉米中,外源NaHS处理同样可以促进DABH活性,从而增加甜菜碱含量,提高玉米幼苗的抗逆性,而同时施加DABH抑制剂双硫仑则可以降低上述反应[36]。这些研究表明,H2S可以通过激活渗透调节物质合成途径,增加渗透调节物质的积累,从而提高植物的耐旱性。
水孔蛋白(Aquaporin,AQP)是一类具有选择性、可以高效跨膜转运水分的膜通道蛋白,可增强干旱条件下的植物体内的水分运输能力。Ruizlozano等[37]研究表明,通过外源喷施ABA可以诱导AQP活性的上升,而上述的研究又表明ABA与H2S存在交互作用。这侧面提出了一个问题,即是否存在H2S诱导ABA含量上升,从而增强AQP活性来提升植物耐旱性这一途径,间接说明H2S可以诱导植物产生耐旱性。Christou等[38]的研究证实了这一假设,他们发现在草莓幼苗中,NaHS灌根处理可促进AQP的基因表达,进而增强水分运输能力,为植物适应高温和干旱奠定了基础。
3.2 H2S激活抗氧化系统与植物耐旱性氧化胁迫和MG胁迫是造成干旱伤害的原因之一,植物耐旱性的获得通常与抗氧化系统和MG脱毒系统活力的增强有关。植物在正常的生命活动中,可通过酶促反应、光合与呼吸过程中的电子传递链泄漏而产生ROS。在正常条件下,细胞通过抗氧化系统使ROS的产生与清除保持平衡,维持在植物可忍受的生理水平,同时ROS在植物的生长发育中起着信号分子的重要作用。植物细胞内抗氧化系统主要由抗坏血酸(Ascorbate acid,AsA)、还原型谷胱甘肽(Glutathione,GSH)、维生素E、类胡萝卜素、花青素、脯氨酸、甜菜碱、多胺等非酶性的抗氧化剂和超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、过氧化物酶(Peroxidase,POD)、谷胱甘肽还原酶(Glutathione reductase,GR)、脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHR)、单脱氢抗坏血酸还原酶(Monodehydroascorbate reductase,MDHAR)等清除ROS的抗氧化酶组成,通过它们的协同作用来维持细胞中ROS的稳态[39, 40]。但是在干旱胁迫下,ROS的产生增加,抗氧化系统活性下降,ROS产生与清除的平衡被打破,植物细胞积累ROS,产生氧化胁迫,导致细胞的严重损伤甚至死亡[41]。所以,植物耐旱性的获得,常常通过增强抗氧化系统活力来实现。
在小麦中,通过外源NaHS处理,可以显著增加CAT、APX活性,减少干旱胁迫下脂氧合酶以及丙二醛(Malondialdehyde,MDA)和H2O2的积累[42]。而小麦幼苗在干旱条件下,通过施加外源NaHS,APX、GR、DHR等酶的活性以及总抗坏血酸与总谷胱甘肽含量均得到提高,进而缓解了MDA含量上升,削弱了氧化胁迫和渗透胁迫[43]。在玉米和大豆中,施加适宜浓度的NaHS也可显著提高幼苗的SOD、CAT和APX活性[44]。另外,单长卷等[44]的研究还发现,对玉米叶片喷施NaHS,可显著提高SOD、POD、CAT和APX活性,然而用NaHS灌根,则只能使POD和APX活性得到提高,对SOD和CAT活性并没有显著影响,这说明植物的不同器官之间对外源H2S的响应存在着差别。在草莓幼苗中,Christou等[38]发现NaHS灌根处理不仅可促进AQP的基因表达,也可促进抗氧化酶APX、CAT、GR和SOD,以及抗氧化剂合成酶半乳糖脱氢酶(L-galactose dehydrogenase,GDH,AsA合成关键酶)、谷氨酰半胱氨酸合成酶(Glutamyl-cysteine synthetase,GCS)和谷胱甘肽合成酶(Glutathione synthetase,GS)的基因表达,从而增强草莓的抗氧化能力。
研究表明,H2S可以通过对含活性半胱氨酸(Cysteine,Cys)残基(巯基)的蛋白质进行硫巯基化(S-sulfhydrylation)修饰来直接调控蛋白质的活性。如在拟南芥中,可以通过外源施加NaHS的方法促进APX硫巯基化,从而提高APX的活性[45]。
这些研究表明,H2S可通过直接(酶等蛋白的硫巯基化)或间接(作为信号分子)地增强植物体内抗氧化系统的活力,降低氧化胁迫,提高植物的耐旱性。
3.3 H2S激活MG脱毒系统与植物耐旱性在植物体内,MG是光合作用、呼吸作用(特别是糖酵解)、氨基酸代谢(特别是甘氨酸和苏氨酸代谢)和脂代谢中不可避免的活性产物。如上所述,MG过度积累可破坏蛋白质、核酸和生物膜的结构,产生MG胁迫(与氧化胁迫相似)。一般认为,植物可能通过酶促途径和非酶促途径产生MG。酶促途径主要是指3-磷酸甘油醛(Glyceraldehyde-3-phosphate,G3P)、磷酸二羟丙酮(Dihydroxyacetone phosphate,DHAP)、丙酮醇和氨基丙酮在对应的磷酸丙糖异构酶(Triosephosphate isomerase,TPI)、MG合酶(Methylglyoxal synthase,MGS)、丙酮醇单氧化酶(Acetol monooxygenase,AMO)和氨基脲敏感胺氧化酶(Semicarbazide-sensitive amine oxidase,SSAO)的作用下产生MG;而非酶促途径是指G3P、DHAP、葡萄糖等自发转变为MG[8, 9, 12]。为维持细胞中MG的动态平衡,植物进化出有效的MG脱毒系统,主要包括乙二醛酶Ⅰ(glyoxalase Ⅰ,Gly Ⅰ)、乙二醛酶Ⅱ(Glyoxalase Ⅱ,Gly Ⅱ)和乙二醛酶Ⅲ(Glyoxalase Ⅲ,Gly Ⅲ)[46-53]。一般认为,Gly Ⅰ和Gly Ⅱ在维持MG平衡中起着关键的作用。在正常的生理条件下,MG在植物体中的浓度因植物种类、器官、发育期、生长环境等而异,大约维持在30-75 μmol/L之间。在干旱、高温、低温、盐渍、重金属等非生物胁迫下,由于细胞代谢的紊乱,MG可迅速增加2-6倍,成为一种胁迫标志[46-53]。因此,逆境胁迫包括干旱胁迫下,MG脱毒系统Gly Ⅰ和Gly Ⅱ活力的增强,成为植物耐旱性获得的关键。
在绿豆幼苗中,GSH处理可提高幼苗的耐旱性,并且这种耐旱性的获得与MG脱毒系统Gly Ⅰ和Gly Ⅱ,以及抗氧化酶SOD、APX、GR、GPX和CAT活力和抗氧化剂AsA、GSH的增强密切相关[54]。硒是一种重要微量元素,在油菜幼苗中,硒处理可增加干旱胁迫下APX、DHAR、MDHAR、GR、谷胱甘肽硫转移酶(Glutathione-S-transferase,GST)、POD、CAT、Gly Ⅰ和Gly Ⅱ活性,缓解干旱胁迫下MDA、H2O2和MG的增加,减少了氧化胁迫和MG胁迫的伤害,最终提高油菜幼苗的耐旱性[55]。大豆幼苗在干旱胁迫下,Le等[56]通过转录组分析发现,Gly Ⅰ和Gly Ⅱ的基因表达被迅速上调,这种上调与大豆耐旱性的形成有关。在甜菜和烟草幼苗中,超表达Gly Ⅰ或Gly Ⅱ基因的植株,可增强干旱胁迫的抵抗能力[12, 46, 50]。
研究表明,MG可能是一种新的细胞信号,与其它信号如Ca2+、ROS、NO、H2S相类似,参与植物耐逆性的形成。在模式植物拟南芥中,MG可诱导气孔关闭,这种关闭与MG激活细胞壁POD的活性所产生的ROS有关,后者通过激活Ca2+通道,最终导致气孔的关闭[49]。此外,MG也可通过抑制保卫细胞的K+内流,抑制光诱导的气孔关闭[48]。在水稻幼苗中,Kaur等[57]通过转录组分析,发现外源MG处理16 h后,共计1 685个基因的表达发生了1.5倍以上的变化,这些基因大部分涉及响应MG和逆境的信号转导过程,并且MG响应元件(Methylglyoxal-response element,MGRE)发生10倍以上的转录变化,这些结果表明MG可能作为逆境信号分子,在信号转导中起着重要的作用。暗示MG可能与ROS、Ca2+等信号的交互作用,参与植物耐逆性的形成。我们最近的研究也发现,MG可作为信号分子,提高小麦幼苗对重金属胁迫的抵抗能力[58]。
3.4 H2S诱导热激蛋白合成与植物耐旱性许多研究表明,HSPs不仅参与植物耐热性的形成,在其它耐性包括耐旱性形成中也起着重要的作用[5, 59]。HSPs具有帮助蛋白重新折叠、防止蛋白凝集、促进错误折叠或变性蛋白的降解、促进蛋白的转运,以及参与细胞的信号转导等生理功能[5]。Christou等[38]以草莓幼苗为研究材料发现,热激可诱发幼苗中H2S、H2O2和NO的交互作用,以此作为第二信使,促进HSP70、HSP80和HSP90的基因表达。更有意思的是,NaHS可取代热激,通过增加内源H2S的积累,同样可诱导HSP70、HSP80和HSP90的基因表达,以此来提高植物对干旱胁迫的抵抗能力[38]。
所以,H2S可通过激活渗透调节物质积累的代谢途径而诱导渗透调节物质的积累,也可通过提高抗氧化系统和MG脱毒系统的活力,以及热激蛋白的合成来提高植物对干旱胁迫的抵抗能力(图 1)。
4 展望综上所述,H2S可以通过调节渗透调节物质、抗氧化系统和MG脱毒系统的活力,以及热激蛋白的合成调控植物耐旱性的形成,并且在耐旱性形成过程中,还存在以H2S为中心的信号交互网络。但是,H2S作为一种气体信号分子,在植物耐旱性形成中的相关机理还需要进一步研究。例如,气体信号分子H2S可以自由通过生物膜,但是目前仍未清楚H2S是否存在一种受体位于生物膜上。在之前的研究中已经有证据可以表明,H2S可以与蛋白上Cys的巯基反应,形成硫巯基蛋白,即蛋白质的硫巯基化来调控蛋白活性[21, 60],但是硫巯基蛋白是否就是它的受体,还需要进一步研究证实。另外,H2S和其他信号分子交互作用的具体机制尚不完全明了。例如,在拟南芥中,黑暗条件下NO可以参与ABA调控的气孔关闭,而施加外源NaHS则可以降低NO的含量,从而阻止黑暗条件下气孔的关闭[61]。此外,目前的研究虽然均倾向于将H2S看作为一种信号分子,但是仍存在另一种看法,认为H2S不是一种信号分子,而是调控ROS和活性氮(RNS)过度积累的“裁判”,以确保这些活性物质不至于过度积累而破坏细胞和组织[39]。这些矛盾和争议,还需进一步探讨。
| [1] | Yamasaki H, Cohen MF. Biological consilience of hydrogen sulfide and nitric oxide in plants:Gases of primordial earth linking plant, microbial and animal physiologies[J]. Nitric Oxide, 2016, 55-56 : 91–100. DOI:10.1016/j.niox.2016.04.002 |
| [2] | Goodwin LR, Francom D, Dieken FP, et al. Determination of sulfide in brain tissue by gas dialysis/ion chromatography:postmortem studies and two case reports[J]. J Anal Toxicol, 1989, 13 (2): 105–109. DOI:10.1093/jat/13.2.105 |
| [3] | Stipanuk MH, Beck PW. Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat[J]. Biochem J, 1982, 206 (2): 267–277. DOI:10.1042/bj2060267 |
| [4] | Hancock JT. Harnessing evolutionary toxins for signaling:reactive oxygen species, nitric oxide and hydrogen sulfide in plant cell regulation[J]. Front Plant Sci, 2017, 8 : 189. |
| [5] | 闵雄, 周志豪, 李忠光. 信号分子硫化氢的代谢及其在植物耐热性形成中的作用[J]. 植物生理学报, 2016, 52(1): 37–46. |
| [6] | Szabo C. Hydrogen sulphide and its therapeutic potential[J]. Nat Rev Drug Discov, 2007, 6 (11): 917–935. DOI:10.1038/nrd2425 |
| [7] | Li ZG, Gong M, Liu P. Hydrogen sulfide is a mediator in H2O2-induced seed germination in Jatropha Curcas[J]. Acta Physiol Plant, 2012, 34 (6): 2207–2213. DOI:10.1007/s11738-012-1021-z |
| [8] | Li ZG, Min X, Zhou ZH. Hydrogen sulfide:A signal molecule in plant cross-adaptation[J]. Front Plant Sci, 2016, 7 : 1621. |
| [9] | Hasan MR, Ghosh A, Kaur C et al. Glyoxalase pathway and drought stress tolerance in plants[M]//Hossain MA, Wani SH, Bhattacharjee S, et al. Drought stress tolerance in plants Volume 1, Switzerland:Springer International Publishing, 2016:379-399. |
| [10] | 车永梅, 侯丽霞, 孙艳君, 等. H2S参与植物气孔运动调节与逆境响应过程研究进展[J]. 生物技术通报, 2016, 32(10): 1–9. |
| [11] | Ma D, Ding H, Wang C, et al. Alleviation of drought stress by hydrogen sulfide is partially related to the abscisic acid signaling pathway in wheat[J]. PLoS One, 2016, 11 (9): e0163082. DOI:10.1371/journal.pone.0163082 |
| [12] | Li ZG. Methylglyoxal and glyoxalase system in plants:old players, new concepts[J]. Bot Rev, 2016, 82 : 183–203. DOI:10.1007/s12229-016-9167-9 |
| [13] | Guo H, Xiao T, Zhou H, et al. Hydrogen sulfide:a versatile regulator of environmental stress in plants[J]. Acta Physiol Plant, 2016, 38 (1): 1–13. DOI:10.1007/s11738-015-2023-4 |
| [14] | Hetherington AM, Woodward FI. The role of stomata in sensing and driving environmental change[J]. Nature, 2003, 424 (6951): 901–908. DOI:10.1038/nature01843 |
| [15] | Scuffi D, Alvarez C, Laspina N, et al. Hydrogen sulfide generated by L-cysteine desulfhydrase acts upstream of nitric oxide to modulate abscisic acid-dependent stomatal closure[J]. Plant Physiol, 2014, 166 (4): 2065–2076. DOI:10.1104/pp.114.245373 |
| [16] | 刘菁, 侯丽霞, 刘国华, 等. NO介导的H2S合成参与乙烯诱导的拟南芥气孔关闭[J]. 科学通报, 2011(30): 2515–2522. |
| [17] | 侯智慧, 刘菁, 侯丽霞, 等. H2S可能作为H2O2的下游信号介导茉莉酸诱导的蚕豆气孔关闭[J]. 植物学报, 2011, 46(4): 396–406. |
| [18] | Hua Z, Hao J, Jiang CX, et al. Hydrogen sulfide protects soybean seedlings against drought-induced oxidative stress[J]. Acta Physiol Plant, 2010, 32 (5): 849–857. DOI:10.1007/s11738-010-0469-y |
| [19] | Li ZG, He QQ. Hydrogen peroxide might be a downstream signal molecule of hydrogen sulfide in seed germination of mung bean(Vigna radiata)[J]. Biologia, 2015, 70 : 753–759. |
| [20] | Li ZG, Xie LR, Li XJ. Hydrogen sulfide acts as a downstream signal molecule in salicylic acid-induced heat tolerance in maize(Zea mays L.)seedlings[J]. J Plant Physiol, 2015, 177 : 121–127. DOI:10.1016/j.jplph.2014.12.018 |
| [21] | Li ZG. Synergistic effect of antioxidant system and osmolyte in hydrogen sulfide and salicylic acid crosstalk-induced heat tolerance in maize(Zea mays L.)seedlings[J]. Plant Signal Behav, 2015, 10 (9): e1051278. DOI:10.1080/15592324.2015.1051278 |
| [22] | Li ZG, Luo LJ, Sun YF. Signal crosstalk between nitric oxide and hydrogen sulfide may be involved in hydrogen peroxide-induced thermotolerance in maize seedlings[J]. Russ J Plant Physiol, 2015, 62 : 507–514. DOI:10.1134/S1021443715030127 |
| [23] | Li ZG, Gu SP. Hydrogen sulfide as a signal molecule in hematin-induced heat tolerance of tobacco cell suspension[J]. Biol Plant, 2016, 60 (3): 595–600. DOI:10.1007/s10535-016-0612-8 |
| [24] | Li ZG, Jin JZ. Hydrogen sulfide partly mediates abscisic acid-induced heat tolerance in tobacco(Nicotiana tabacum L.)suspension cultured cells[J]. Plant Cell Tiss Organ Cult, 2016, 125 : 207–214. DOI:10.1007/s11240-015-0939-4 |
| [25] | Li ZG, Long WB, Yang SZ, et al. Endogenous hydrogen sulfide regulated by calcium is involved in thermotolerance in tobacco Nicotiana tabacum L. suspension cell cultures[J]. Acta Physiol Plant, 2015, 27 : 219. |
| [26] | Lin YT, Li MY, Cui WT, et al. Haem oxygenase-1 is involved in hydrogen sulfide-induced cucumber adventitious root formation[J]. J Plant Growth Regul, 2012, 31 (4): 519–528. DOI:10.1007/s00344-012-9262-z |
| [27] | Shen J, Xing T, Yuan H, et al. Hydrogen sulfide improves drought tolerance in Arabidopsis thaliana by microRNA expressions[J]. PLoS One, 2016, 8 (10): e77047. |
| [28] | Hossain MA, Wani SH, Bhattacharjee S, et al. Drought stress tolerance in plants Vol 2[M]. Springer International Puhlishing, Switzerland, 2016. |
| [29] | Iqbal N, Nazar R, Khan NA. Osmolytes and plants acclimation to changing environment:Emerging omics technologies[M]. New York: Springer, 2016. |
| [30] | Hossain MA, Hoque MA, Burritt DJ, et al. Proline protects plants against abiotic oxidative stress:Biochem Mol Mechan[M]// Ahmad P. Oxidative damage to plants. Amsterdam:ELSEVIER, 2014:477-522. |
| [31] | Zhang H, Wang MJ, Hu LY, et al. Hydrogen sulfide promotes wheat seed germination under osmotic stress[J]. Russ J Plant Physiol, 2010, 57 (4): 532–539. DOI:10.1134/S1021443710040114 |
| [32] | 谢虹, 杨兰, 李忠光. 脯氨酸在植物非生物胁迫耐性形成中的作用[J]. 生物技术通报, 2011(2): 23–27. |
| [33] | 李永生, 方永丰, 李玥, 等. 外源硫化氢对PEG模拟干旱条件下玉米种子萌发及幼苗生长的影响[J]. 核农学报, 2016, 30(4): 813–821. DOI:10.11869/j.issn.100-8551.2016.04.0813 |
| [34] | Shi H, Ye T, Chan Z. Exogenous application of hydrogen sulfide donor sodium hydrosulfide enhanced multiple abiotic stress tolerance in bermudagrass(Cynodon dactylon, (L). Pers.)[J]. Plant Physiol Biochem, 2013, 71 (2): 226–234. |
| [35] | Chen J, Shang YT, Wang WH, et al. Hydrogen sulfide-mediated polyamines and sugar changes are involved in hydrogen sulfide-induced drought tolerance in Spinacia oleracea seedlings[J]. Front Plant Sci, 2016, 7 : 1173. |
| [36] | Li ZG, Zhu LP. Hydrogen sulfide donor sodium hydrosulfide-induced accumulation of betaine is involved in the acquisition of heat tolerance in maize seedlings[J]. Braz J Bot, 2015, 38 (1): 31–38. DOI:10.1007/s40415-014-0106-x |
| [37] | Ruizlozano JM, Alguacil MDM, Bárzana G, et al. Exogenous ABA accentuates the differences in root hydraulic properties between mycorrhizal and non mycorrhizal maize plants through regulation of PIP aquaporins[J]. Plant Mol Biol, 2009, 70 (5): 565–579. DOI:10.1007/s11103-009-9492-z |
| [38] | Christou A, Filippou P, Manganaris GA, et al. Sodium hydrosulfide induces systemic thermotolerance to strawberry plants through transcriptional regulation of heat shock proteins and aquaporin[J]. BMC Plant Biol, 2014, 14 : 42. DOI:10.1186/1471-2229-14-42 |
| [39] | Gill SS, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiol Biochem, 2010, 48 (12): 909–930. DOI:10.1016/j.plaphy.2010.08.016 |
| [40] | Asthir B. Mechanisms of heat tolerance in crop plants[J]. J Plant Inter, 2015, 10 (1): 1–21. |
| [41] | Breusegem FV, Vranová E, Dat JF, et al. The role of active oxygen species in plant signal transduction[J]. Plant Sci, 2001, 161 (3): 405–414. DOI:10.1016/S0168-9452(01)00452-6 |
| [42] | Zhang H, Wang MG, Hua LY, et al. Hydrogen sulfide promotes wheat seed germination under osmotic stress[J]. Russ J Plant Physiol, 2010, 57 : 532–539. DOI:10.1134/S1021443710040114 |
| [43] | Shan CJ, Zhang SL, Li DF, et al. Effects of exogenous hydrogen sulfide on the ascorbate and glutathione metabolism in wheat seedlings leaves under water stress[J]. Acta Physiol Plant, 2011, 33 (6): 2533–2540. DOI:10.1007/s11738-011-0746-4 |
| [44] | 单长卷, 周岩, 赵元增, 等. 外源硫化氢对干旱条件下玉米幼苗抗氧化特性的影响[J]. 干旱地区农业研究, 2015, 33(6): 161–166. DOI:10.7606/j.issn.1000-7601.2015.06.27 |
| [45] | Aroca á, Serna A, Gotor C, et al. S-sulfhydration:a cysteine posttranslational modification in plant systems[J]. Plant Physiol, 2015, 168 (1): 334–342. DOI:10.1104/pp.15.00009 |
| [46] | Hoque TS, Hossain MA, Mostofa MG, et al. Signalling roles of methylglyoxal and the involvement of the glyoxalase system in plant abiotic stress responses and tolerance[M]//Azooz MM, Ahmad P. Plant-environment interaction:Responses and approaches to mitigate stress. New Jersey:Wiley, 2016:311-326. |
| [47] | Hoque TS, Hossain MA, Mostofa MG, et al. Methylglyoxal:An emerging signaling mmolecule in plant abiotic stress responses and tolerance[J]. Front Plant Sci, 2016, 7 : 1341. |
| [48] | Hoque TS, Okuma E, Uraji M, et al. Inhibitory effects of methylglyoxal on light-induced stomatal opening and inward K+ channel activity in Arabidopsis[J]. Biosci Biotechnol Biochem, 2012, 76 : 617–619. DOI:10.1271/bbb.110885 |
| [49] | Hoque TS, Uraji M, Ye W, et al. Methylglyoxal-induced stomatal closure accompanied by peroxidase-mediated ROS production in Arabidopsis[J]. J Plant Physiol, 2012, 169 : 979–986. DOI:10.1016/j.jplph.2012.02.007 |
| [50] | Kaur C, Sharma S, Singla-Pareek SL, et al. Methylglyoxal, triose phosphate isomerase, and glyoxalase pathway:Implications in abiotic stress and signaling in plants[M]//Pandey GK. Elucidation of abiotic stress signaling in plants. Berlin:Springer, 2015:347-365. |
| [51] | Hossain MA, Silva JAT, Fujita M. Glyoxalase system and reactive oxygen species detoxification system in plant abiotic stress response and tolerance:An intimate relationship[M]//Shanker AK, Venkateswarlu B. Abiotic stress in plants-mechanisms and adaptations. Croatia:InTech, 2011:235-266. |
| [52] | Kaur C, Ghosh A, Pareek A, et al. Glyoxalases and stress tolerance in plants[J]. Biochem Soc Trans, 2014, 42 : 485–490. DOI:10.1042/BST20130242 |
| [53] | Kaur C, Singla-Pareek SL, Sopory SK. Glyoxalase and methylglyoxal as biomarkers for plant stress tolerance[J]. Crit Rev Plant Sci, 2014, 33 : 429–456. DOI:10.1080/07352689.2014.904147 |
| [54] | Nahar K, Hasanuzzaman M, Alam MM, et al. Glutathione-induced drought stress tolerance in mung bean:coordinated roles of the antioxidant defence and methylglyoxal detoxification systems[J]. AoB Plants, 7:plv069. doi:10.1093/aohpla/plv069. |
| [55] | Hasanuzzaman M, Fujita M. Selenium pretreatment upregulates the antioxidant defense and methylglyoxal detoxification system and confers enhanced tolerance to drought stress in rapeseed seedlings[J]. Biol Trace Element Res, 2011, 143 : 1758–1776. DOI:10.1007/s12011-011-8998-9 |
| [56] | Le DT, Nishiyama R, Watanabe Y, et al. Differential gene expression in soybean leaf tissues at late developmental stages under drought stress revealed by genome-wide transcriptome analysis[J]. PLoS One, 2012, 7 (11): e49522. DOI:10.1371/journal.pone.0049522 |
| [57] | Kaur C, Kushwaha HR, Mustafiz A, et al. Analysis of global gene expression profile of rice in response to methylglyoxal indicates its possible role as a stress signal molecule[J]. Front Plant Sci, 2016, 6 : 682. |
| [58] | Li ZG, Duan XQ, Xia YM, et al. Methylglyoxal alleviates cadmium toxicity in wheat(Triticum aestivum L.)[J]. Plant Cell Rep, 2017, 36 : 367–370. DOI:10.1007/s00299-016-2070-3 |
| [59] | Kaur H, Petla BP, Majee M. Small heat shock proteins:Roles in development, desiccation tolerance and seed longevity[M]//Asea AAA, Kaur P, Calderwood ST. Heat shock proteins and plants. New York:Springer, 2016:3-18. |
| [60] | Li L, Rose P, Moore PK. Hydrogen sulfide and cell signaling[J]. pharmacol and Toxicol, 2011, 51 (51): 169–187. |
| [61] | Bright J, Desikan R, Hancock JT, et al. ABA-induced NO generation and stomatal closure in Arabidopsis are dependent on H2O2 synthesis[J]. Plant J, 2006, 45 (1): 113–122. DOI:10.1111/j.1365-313X.2005.02615.x |




