转基因是一种非常重要的手段去研究植物的分子生物学,并且它可以被用来研究植物中基因的功能和遗传学上的进展[1]。然而,在转基因株系中稳定的基因的表达是相对昂贵和费时的,并且对大规模的植物基因的分析是有限制的。瞬时表达研究变得越来越便捷,简单,安全和有效,并且与长期稳定表达的系统相比瞬时表达有很高的表达水平[2]。如今瞬时基因表达已经被广泛的用于蛋白质功能的研究,如蛋白质的亚细胞定位和运输、蛋白与蛋白之间的相互作用、蛋白的稳定和降解以及蛋白的活力。普通的瞬时转染系统的方法包括基因枪轰击法,根癌农杆菌介导法(农杆菌渗入法),聚乙二醇(聚乙二醇)介导的原生质体转化。虽然,离子轰击的方法可以被用于大部分的植物物种中[3],但是它是具有挑战性的,使用这种方法会改变许多类型的叶绿体靶向蛋白[4]。农杆菌介导的瞬时表达具有操作简单、价格低,易操作的特点[5]。使用各种不同的转染技术将重组质粒的DNA分子转染到原生质体中有很多方法,如PEG介导法、电穿孔法和显微注射法。而PEG介导的原生质体的转染表达有很高的转染效率,可以直接作用于单个细胞,从而可以更直接地研究外源基因在细胞内的瞬时表达,所以它被很广泛的应用于植物分子生物学研究中[6, 7]。
前纤维蛋白(Profilin)是一个分子量为12-15 kD的肌动蛋白结合蛋白,它在动植物中广泛存在[8, 9]。1997年,Profilin主要在动物细胞的提取液中作为抑制微丝体外聚合的组分被提取出来,植物中Profilin是在1991年作为赤杨花粉中的致敏源而被发现的[10],经过多年的研究,人们已经发现了多种Profilin的异构体。如玉米中已确定的Profilin的异构体有6种[11],在模式生物拟南芥中至少有5种Profilin的异构体[12],在这些Profilin异构体中,其中Profilin-1在调控植物细胞的生长中扮演着重要的作用,如顶端生长的细胞-根毛和弥散生长的细胞-下胚轴表,当缺失Profilin-1时,就会导致根毛变短和下胚轴变短。相反的,当过表达Profilin-1时,就会导致根毛和下胚轴变长[13]。为了对Profilin-1的分布进行研究,我们利用了绿色荧光蛋白的方法,去观察Profilin-1的分布。荧光蛋白是在发光的水母(Aequorea victoria)中发现的小分子蛋白,当使用UV光去激发GFP蛋白是就表现出了荧光特性[14]。GFP的最大激发波长为395 nm,发射光波长为509 nm,采用带有滤波器的荧光显微镜可以很容易的被观察到[15]。GFP能够一直的维持荧光亮度。它是一种很好的荧光标签去检测蛋白与蛋白之间的相互作用,蛋白的跨膜和亚细胞定位。然而,直到现在还没有报道使用带有GFP报告基因的瞬时表达去研究Profilin-1的定位。在本实验中,我们构建了GFP: PRF1融合基因,利用瞬时表达的方法将融合基因分别导入到拟南芥原生质体和烟草的表皮细胞中,使用激光共聚焦显微镜观察PRF1在细胞中的定位,旨在为后期瞬时表达体系的建立和其它功能基因的导入奠定基础。
1 材料与方法 1.1 材料 1.1.1 植物材料拟南芥哥伦比亚生态型被用于本次实验的研究,使用1%的次氯酸钠消毒后用蒸馏水冲洗种子,然后用0.1%的琼脂粉悬浮种子点种在MS培养基上,4℃冰箱放置72 h后转移至生长室中,生长室的条件如下:温度,22±1℃;光照强度,50-55 mmol photons m-2s-1;光周期,16: 8 h(光:黑暗);相对湿度,70%。
本氏烟草用于此次研究中,并且所选用的植物是4-5周的植物,光周期为14: 10 h(光:黑暗)。
1.1.2 菌株、质粒及试剂农杆菌GV3101、大肠杆菌DH5α均为本实验室所有,质粒小提试剂盒,DNA回收试剂盒,T4 DNA连接酶和DNA marker均来购自TaKaRa(Japan)公司,限制性内切酶和Q5高保证酶均购自NEB(Beijing)有限公司,纤维素酶和果胶酶均购自日本Yakult公司。
1.1.3 仪器激光共聚焦扫描显微镜(OLYMPUS CONFOCAL FV1000)。
1.2 方法 1.2.1 RNA的提取选取叶片完全伸展的2周的拟南芥叶片作为实验材料,然后将幼苗转移到液氮中,用预冷的研磨棒将叶片研磨成粉状,使用Trizol试剂来提取RNA后,用1%的琼脂糖凝胶电泳检测,RNA质量合格后,使用PrimeScipt® RTReagent Kit(TaKaRa,Japan)将RNA反转录为cDNA,最后将cDNA储存在-80℃的冰箱中,以便用于后续的实验。
1.2.2 PRF1基因的克隆和表达载体的构建根据拟南芥微丝结合蛋白PRF1的全长进行引物设计,设计引物如下:上游引物:5′-CGCGGATCCATGTCTTGGCAATCATACG-3′;下游引物:5′-CGGGGTACCGAGTTCAGACTCGATAAGG-3′。以上引物的划线部分分别为BamH I和Kpn I两个内切酶的酶切识别位点,前面斜体为保护碱基。然后使用此引物扩增得到目的基因profilin-1,使用1.5%的琼脂糖凝胶进行检测并回收目的片段。将回收后的片段连接到表达载体上,然后转染到大肠杆菌感受态中,选择阳性单克隆菌株,摇菌,提质粒,酶切鉴定,送往北京华大公司测序。
1.2.3 原生质体的分离和转染选取3周龄的拟南芥叶片用于提取原生质体,原生质体的提取方法如下[16],略有改动。酶溶液的制备含有1%的纤维素酶R-10,0.25%的离析酶R-10,20 mmol/L MES、0.4 mol/L甘露醇和20 mmol/L KCl,酶溶液放置在水浴锅中55℃ 10 min。然后移到室温环境中放凉,然后添加0.1% BSA、10 mmol/LCaCl2和5 mmol/L β-ME(β-巯基乙醇),使用0.45 μm的过滤器过滤,储存,为后续的使用,使用双面刀片按与主茎面垂直的方向切成1 mm的细条状。这些细条被快速的放在酶解液中(0.4-0.5 g/10 mL),然后在25℃暗处酶溶液中孵育3 h。在消化后,用W5(20 mmol/L MES,154 mmol/L NaCl,125 mmol/L CaCl2,5 mmol/L KCl,pH5.8)把酶解液稀释成同等的体积。并且均匀的混合在一起,然后使用200目的尼龙网过滤。离心1 000 r/min 2 min,上清液去除,把原生质体重悬在W5溶液中,接下来取静置10 h后的原生质体以终浓度为25 mol/L的荧光素二乙酸酯(Fluoresceindiacetate,FDA)室温处理10 min,在荧光显微镜下镜检,鉴定原生质体的活力。
接下来,进行拟南芥原生质体的转化,向原生质体中加入MMg溶液[0.4 mol/L甘露醇、15 mmol/L MgCl2和4 mmol/L MES(pH5.7)],重悬原生质体,接下来在1.5 mL离心管中加入100 μL的重悬的原生质体和25 μL的重组载体,再加入125 μL的PEG溶液(40% PEG-4000,0.2 mol/L甘露醇和0.1 mol/L CaCl2),轻轻摇匀,在23℃培养箱中,避光静置30 min。接下来加入4倍体积的W5溶液混匀,室温100×g离心1 min,移除PEG,在加入100 μL的W5溶液重悬原生质体,将转化后的原生质体放在22℃培养箱中培养12-18 h,用荧光显微镜下观察鉴定。
1.2.4 PRF1在烟草细胞中的表达将GFP:PRF1载体转入农杆菌菌株GV3101的感受态细胞中,涂板,放在28℃的培养箱中培养,16 h后挑取单克隆菌株于YEB液体培养基中,于摇床中28℃ 200 r/min过夜摇培24-36 h,测OD600的值为0.8-1时,结束培养,5 000×g,离心5 min,倒掉上清液,使用重悬液(1 mol MgCl2,0.5 mol MES,100 mol/L AS(乙酰丁香酮)悬菌,使其终浓度达到0.4,室温静置3 h后,使用没有针头的1 mL的注射器吸取菌液,注射3-4周长势较好烟草。接种2 d后,使用激光共聚焦对烟草叶片表面接种部位进行观察拍照。
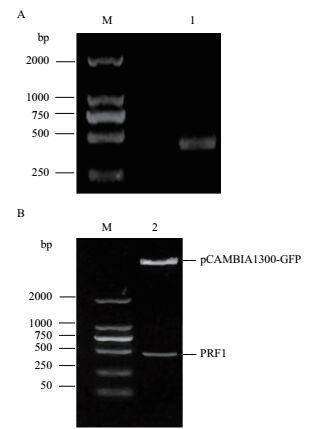
2 结果 2.1 PRF1的扩增和DNA的构建对拟南芥叶片进行总RNA的提取,通过1%的琼脂糖凝胶进行检测,然后以此RNA为模板,通过RT-PCR扩增得到一条长约396 bp的片段(图 1-A),可以进行到下一步的连接实验。然后,将目的基因片段PRF1与带GFP标签的表达载体连接,转化到大肠杆菌中,提质粒进行酶切验证,酶切3 h后,使用1%的琼脂糖进行验证,验证结果如图 1-B所示。接下来将质粒送往北京华大进行测序,测序正确,这个构建好质粒可以被用于接下来的瞬时表达实验。
|
| 图 1 PRF1的扩增(A)和重组质粒双酶切(B)结果 M:DNA Marker;1:目的基因PRF1的扩增;2:重组质粒酶切的电泳图 |
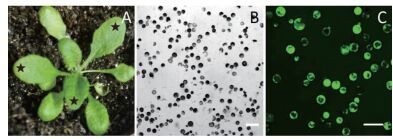
高质量的原生质体对于随后的研究和分析十分重要,尤其是原生质体的转化。首先,用3周龄的拟南芥幼苗叶片作为材料进行原生质体的提取,拟南芥叶肉原生质体为表面十分光滑的球状体(图 2-B)。其次,开花前的幼苗比整株幼苗更可以提取到比较好的原生质体(图 2-A)。对原生质体活力的鉴定采用荧光指示剂FDA标记法,研究结果发现,在488 nm激发下,大部分原生质体仍显示绿色荧光,表明原生质体始终保持很高的活性,可以用于接下来的原生质体的转染实验(图 2-C)。
|
| 图 2 原生质体的提取 A:一株健康的拟南芥植株,星号表示用于原生质体提取的叶片;B:10倍DIC通道下的原生质体图像;C:FDA染色后的原生质体图像(标尺为100 μm) |
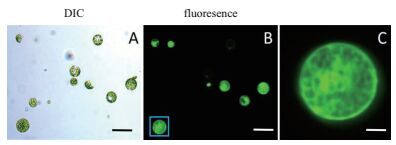
为了可以形象直观的看到PRF1蛋白的亚细胞定位,我们构建了带有GFP标签的融合表达载体,通过PEG转化法将融合表达载体转化到拟南芥原生质体中,融合蛋白在原生质体中的胞质和质体的定位,且较清晰(图 3A-C)。
|
| 图 3 为转化表达载体后的拟南芥原生质体 A:DIC通道下的原生质体图;B:GFP荧光通道下的原生质体图;C:图B中蓝色方框的放大图像(比例尺为50 μm) |
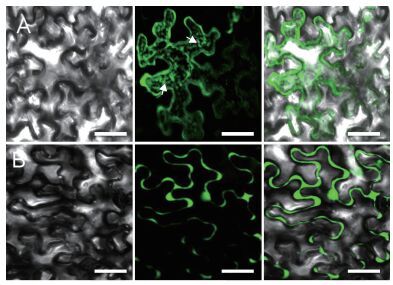
使用健康的至少有两个大叶的烟草植株作为实验材料,因为小叶子很难渗透并且明显的降低了转化效率。利用农杆菌GV3101,将pCAMBIA1300-GFP载体与PRF1基因的融合表达载体(pCAMBIA1300-GFP-PRF1)转入到烟草叶片中,获得了高效瞬时的表达,在475 nm蓝光的激发下绿色荧光蛋白产生了509 nm的绿色荧光。本实验结果表明,PRF1和GFP的融合蛋白在胞质中产生绿色荧光(图 4-A),并且也聚集在颗粒状细胞器外周,在对照组中,GFP则可进入核孔复合物中扩散进入细胞核,从而我们在细胞核中观察到了GFP的绿色荧光信号(图 4-B)。
|
| 图 4 PRF1在烟草叶片中的亚细胞定位 A:转化GFP: PRF1融合蛋白在烟草表皮细胞中的定位,显示出PRF1在细胞质中的分布,并且在外周细胞器上也聚集着,箭头表示为外周细胞器;B:只含有GFP标签的烟草表皮细胞,显示出绿色荧光主要定位在细胞核中(标尺为50 μm) |
前纤维蛋白(Profilin)是一种几乎存在于所有的真核细胞的一种蛋白,可以与细胞内其它大分子如磷脂酰肌醇二磷酸,富含脯氨酸的蛋白质等共同作用。经过多年的研究发现Profilin在生命活动过程有非常重要的作用,如参与了细胞内的信号转导、真核细胞中亚细胞结构的运动等过程。除此之外,在拟南芥中发现了profilin基因在细胞伸长、细胞形态的维持、根毛的极性生长、开花时间等方面起着重要的作用[18]。同时,在本实验室前期的研究中也发现,使用UV-B辐射小麦时,小麦根尖的体细胞中的染色体发生了异常的分裂[19],为了研究这种机制,我们使用Profilin抗体进行标记发现,在染色体异常分裂的同时还伴随着Profilin的异常的分布,从而推测Profilin可能参与了染色体的分裂过程。而不同的Profilin的异构体在细胞中分别执行着各自不同的功能,其中PRF1在调控植物细胞的生长中扮演着重要的角色,所以Profilin-1在细胞内的分布以及动态值得研究。在本实验中,运用拟南芥瞬时表达的实验证实PRF1定位在拟南芥原生质体的细胞质和细胞核中,这与Wang[20]使用稳定表达体系获得PRF1定位的结果相一致,说明这个瞬时表达系统适合于定位信号的研究。
近几年来,瞬时表达已经陆续地被运用到生物学研究中,如利用该系统进行基因功能的鉴定分析、蛋白质互作、亚细胞定位等。在本实验中,我们使用了PEG介导的原生质体的转染和农杆菌介导的方法来研究PRF1的亚细胞定位,从结果中可以看出PRF1在烟草表皮细胞中主要定位在细胞质中,在拟南芥原生质体中主要定位在细胞质和细胞核中。对两种体系所获得的不同结果表明,应用不同体系研究蛋白质的亚细胞定位可能出现不同的结果,这可能是异源的细胞产生偏差的结果。从两种体系操作过程中发现,烟草生长周期短,转基因技术成熟,易操作,不需要酶解细胞壁等优点,因此农杆菌注射烟草叶片的瞬时转化效率比较高,能够获得大片的阳性细胞,且能够比较清楚的看到PRF1在叶表皮的定位。但是由于受到物种和农杆菌亲和性的原因,农杆菌注射的方法更适用于细胞中生物分子相互作用的研究。而拟南芥原生质体瞬时表达体系周期短,易获得活力强的原生质体细胞,通过PEG转化原生质体的方法能够清晰的看到瞬时表达目标蛋白的亚细胞定位。
4 结论在本研究中,我们通过使用两种不同的瞬时表达的方法,研究了PRF1的定位,结果表明将PRF1基因导入拟南芥的原生质体和烟草表皮细胞后,融合蛋白绿色荧光均能被观察到,PRF1基因与GFP融合蛋白的产物在烟草表皮细胞中主要定位在细胞质和外周细胞器中,在拟南芥的原生质体中主要定位在细胞核和细胞质中。在本实验中所使用的两种瞬时表达体系,均得到了一定的结果,但是相对于烟草的瞬时表达体系,拟南芥原生质体瞬时表达能够很好的研究蛋白质的亚细胞定位。
| [1] | Huang H, Wang Z, Cheng J, et al. An efficient cucumber (Cucumis sativus L.) protoplast isolation and transient expression system. Scientia Horticulturae, 2013, 150 (2): 206–212. |
| [2] | Chen SB, Tao LZ, Zeng LR, et al. A highly efficient transient protoplast system for analyzing defence gene expression and protein-protein interactions in rice. Mol Plant Pathol, 2006, 7 (5): 417–427. DOI:10.1111/mpp.2006.7.issue-5 |
| [3] | Taylor NJ, Fauquet CM. Microparticle bombardment as a tool in plant science and agricultural biotechnology. Dna & Cell Biology, 2002, 21 (12): 963–977. |
| [4] | Jaedicke K, Rösler J, Gans T, et al. Bellis perennis:a useful tool for protein localization studies. Planta, 2011, 234 (4): 759–768. DOI:10.1007/s00425-011-1443-7 |
| [5] | Ueki S, Lacroix B, Krichevsky A, et al. Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment. Nature Protocols, 2008, 4 (1): 71–77. DOI:10.1038/nprot.2008.217 |
| [6] | Sheen J. Signal transduction in maize and Arabidopsis mesophyll protoplasts. Plant Physiology, 2001, 127 (4): 1466–1475. DOI:10.1104/pp.010820 |
| [7] | Walter M, Chaban C, Schütze K, et al. Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation. Plant Journal, 2004, 40 (3): 428–438. DOI:10.1111/tpj.2004.40.issue-3 |
| [8] | Carlsson L, Nyström LE, Sundkvist I, et al. Actin polymerizability is influenced by profilin, a low molecular weight protein in non-muscle cells. Journal of Molecular Biology, 1977, 115 (3): 465–483. DOI:10.1016/0022-2836(77)90166-8 |
| [9] | Machesky LM, Poland TD. Profilin as a potential mediator of membrane-cytoskeleton communication. Trends in Cell Biology, 1993, 3 (11): 381–385. DOI:10.1016/0962-8924(93)90087-H |
| [10] | Valenta R, Duchêne M, Pettenburger K, et al. Identification of profilin as a novel pollen allergen; IgE autoreactivity in sensitized individuals. Science, 1991, 253 (5019): 557–560. DOI:10.1126/science.1857985 |
| [11] | Staiger CJ, Goodbody KC, Hussey PJ, et al. The profilin multi gene family of maize:differential expression of three isoforms. The Plant Journal, 1993, 4 (4): 631–641. DOI:10.1046/j.1365-313X.1993.04040631.x |
| [12] | Huang S, Meagher RB. The Arabidopsis profilin gene family. Evidence for an ancient split between constitutive and pollen-specific profilin genes. Plant Physiology, 1996, 111 (1): 115–126. DOI:10.1104/pp.111.1.115 |
| [13] | Ramachandran S, Christensen HEM, Ishimaru Y, et al. Profilin plays a role in cell elongation, cell shape maintenance, and flowering in Arabidopsis. Plant Physiology, 2000, 124 (4): 1637–1647. DOI:10.1104/pp.124.4.1637 |
| [14] | Chalfie M, Tu Y, Euskirchen G, et al. Green fluorescent protein as a marker for gene expression. Science, 1994, 263 (5148): 151. |
| [15] | Zhang S, Zhao B, Liu X, et al. Construction of a new GFP vector and its use for Fusaruim oxysporum, transformation. Saudi Journal of Biological Sciences, 2013, 20 (1): 23–27. DOI:10.1016/j.sjbs.2012.11.001 |
| [16] | 廖嘉明, 王伯初, 王益川, 等. 拟南芥叶肉原生质体分离条件的优化研究. 西北植物学报, 2010, 30(6): 1271–1276. |
| [17] | Yoo SD, Cho YH, Sheen J. Arabidopsis mesophyll protoplasts:a versatile cell system for transient gene expression analysis. Nature Protocols, 2007, 2 (7): 1565–1572. DOI:10.1038/nprot.2007.199 |
| [18] | Ramachandran S. Profilin plays a role in cell elongation, cell shape maintenance, and flowering in Arabidopsis. Plant Physiologists, 2000, 124 (2000): 1637–1647. |
| [19] | 韩榕, 王勋陵, 岳明, 等. 增强UV-B辐射对小麦体细胞分裂的影响. 遗传学报, 2002, 29(6): 537–541. |
| [20] | 王凤. GFP: Actin结合蛋白融合基因的构建及其在拟南芥中的表达[D]. 北京: 中国农业大学, 2002. |




