2. 生物质废弃物资源化利用北京市重点实验室,北京 100023
2. Beijing Key Laboratory of Biomass Wastes Resource Utilization, Beijing 100023
生物分子的生物活性是通过分子之间的相互作用来实现的,因此研究生物分子之间的相互作用对于揭示生命现象发生发展的本质具有重要的意义。所有生物过程的一个基本原则是分子的组成和识别[1]。对蛋白质-其他分子相互作用的分子基础进行更深入理解的前提是复合物形成的热力学特征和能量的量化。量热技术是获取体系中分子间相互作用热力学信息的直接方法,能够揭示分子间相互作用的存在和相互作用的性质[2, 3]。在相互作用的过程中我们通常把一方称为受体,把另一方称为配体。而在等温滴定量热法(Isothermal titration calorimetry,ITC)实验中,注入注射器中的反应物通常被称为配体。ITC可以直接提供蛋白质-配体相互作用的完整热力学特性,是近10年间在蛋白质科学研究中发展最快的技术之一[3-6]。与其他方法不同的是,ITC不需要蛋白质的固定化和/或修饰,因为热量的吸收或释放是几乎所有的生物化学反应的固有性质[3-6]。
目前,等温滴定量热技术在蛋白质-配体相互作用研究领域日益普及的原因主要有以下4点:(1)实验操作简单易行,只需极少量蛋白就能获得大量的热力学数据;(2)在某些情况下,测量一系列蛋白质-配体相互作用的结合常数可能是相近的或不好区分的[7],但是,通过它们的焓变值和熵变值就可以进一步区分;(3)虽然ITC实验不能够直接提供蛋白质-配体相互作用时热力学信息与复合体结构之间的相互关系,但是可以通过比较蛋白质发生构象变化前后的数据从而得到合理的结论;(4)恒压热容与蛋白质界面内表面变化的关系已被证明是解释蛋白质-配体相互作用中结构和热力学两方面的有用工具[8, 9],ITC在不同的实验温度下均可直接测定恒压热容的精确值。随着高灵敏度仪器的发展。例如,MicroCal公司的VP-ITC和ITC-200滴定热量计,将有助于我们更好地解释蛋白质-配体相互作用在各种生命现象[3-6]中的重要作用。等温滴定量热技术可用于几乎所有类型的蛋白质-配体的相互作用,以往的研究大多数集中在蛋白质-DNA/RNA相互作用、蛋白质-脂质相互作用、抗原-抗体相互作用和酶动力学等[10-12]。本文参考国内外已发表的文献对ITC在蛋白质-配体相互作用中的应用及ITC技术在蛋白质科学领域的研究成果以及未来的发展进行总结,表明ITC数据结果的有效性及其在该领域的应用价值。
1 ITC方法概述 1.1 ITC的滴定原理生物大分子如蛋白质有序空间结构或复合物的形成都是可逆的热驱动过程,不论是分子内或分子间的生化反应,在反应前后都会有一定程度的热量改变。等温滴定量热法利用的是功率补偿原理,通过单次浓度扫描能够准确得到体系在较宽的浓度组成范围内发生的分子间相互作用的焓变,直接测量蛋白质-配体反应的热量变化,拟合计算结合热力学参数[13]。简单地说,就是指将一种反应物配制成澄清溶液放在一个温控样品池(Sample cell)中,通过一个热电偶回路与参比池(Reference cell)偶联,另一种反应物作为配体置于注射器(Syringe)中。其中,样品池和参比池通过绝热装置隔开,但保持环境条件相同。在恒定温度下,注射器以一定速度向样品池中不断滴加配体,注射器还具有搅拌功能,反应一定时间,仪器测量样品池的热量变化并使其与参比池平衡,显示为一个吸热或放热的峰[13-15]。放热反应触发恒温功率的负反馈,而吸热反应则触发恒温功率的正反馈来保持温度恒定[13]。实验原理如图 1所示。

|
| 图 1 等温滴定量热原理 |
用仪器自带的软件对两反应物相互作用模式进行拟合,可以直接计算溶液中两个或多个分子之间反应结合焓(ΔH)、定压热容(ΔCp)、结合位点数(n)、结合平衡常数(Ka)和动力学数据(如酶促反应的米氏常数Km和催化速度常数Kcat)[5],从而得出反应吉布斯自由能(ΔG)和熵变(ΔS)[5]。它们之间的关系式如下:
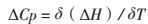 (1)
(1)
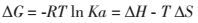 (2)
(2)
其中,R是摩尔气体常数,T是热力学温度。
ITC测量的Ka范围在102-109 L/mol,且反应的ΔG与体系中因复合形成而导致非极性表面的包埋呈一定的正相关关系,通过计算结合过程的希尔常数还可以确定蛋白质-小分子的反应类型。根据Ross和Subramanian的观点[16]可知体系中存在两类结合反应。第一类结合:ΔH0 > 0(吸热),ΔS0 > 0(熵增),TΔS0 > ΔH0熵增效应较大并决定该过程的ΔG0 < 0,故表现为熵驱动过程,疏水相互作用是熵驱动的主要推动力。第二类结合:ΔH0 < 0(放热),ΔS0 > 0(熵增),|ΔH0| > |TΔS0|,放热和熵增效应均导致该过程的ΔG0 < 0,故表现为以焓驱动为主的焓-熵补偿驱动过程,氢键、静电相互作用是焓-熵补偿驱动的主要推动力。在原则上,焓驱动的优化更有利于形成高特异性化合物,然而实际却极难实现。这是因为熵驱动主要由于疏水性相互作用推动,更容易实现。
1.2 ITC的特点生物分子之间的相互作用是生命现象发生的基础,因此研究生物分子之间的相互作用可以阐明生物反应发生的机制,揭示生命现象的本质。近年来,研究生物分子相互作用的技术不断出现,在表 1中比较了近年来常见的几种研究蛋白质-配体相互作用的方法。
随着蛋白质科学研究的不断深入,一些新的ITC技术随之发展,如ITC的反向滴定和置换滴定法。通常,小分子应当被注入注射器中,目标蛋白质应该在样品池中。但有时用反向滴定(Reverse titration),即互换高分子和配位体来测定二者的结合模式更为合适[13, 24]。另外,在药物开发设计对目标蛋白具有高结合亲和力的配位体和抑制剂时,一旦相互作用的结合亲和力接近或超过纳摩尔级水平,对其精确测定将变得十分困难。ITC可以通过置换滴定法(Displacement titration)确定皮摩尔范围的配体的完整结合热力学信息,这是ITC发展史上一个新的、重要的进展[13]。近年来,这种置换滴定方法已经被成功应用在超高/超低亲和系统的量热学上[13, 25]。这种方法的基本原理是当另一个竞争性配体存在时,结合反应的配体结合性质被改变。
2 ITC在蛋白质-配体相互作用中的应用 2.1 ITC在蛋白质-活性小分子相互作用中的应用金属离子在许多生命过程中发挥关键作用,研究金属离子与蛋白质的结合作用是生命科学的重要内容,是化学和生命科学研究的前沿领域。许多人类的疾病与金属离子-蛋白质的异常相互作用相关,通过ITC实验获得蛋白质-金属离子相互作用的热力学信息便于人们更好地理解二者的结合模式,并且有利于对相关疾病的发病机理作出合理的解释[26]。Makowska等[27]用等温滴定量热技术和荧光猝灭分析方法研究了Cu2+与FBP28蛋白(甲酸精结合蛋白)N′端WW结构域Tyr-Lys-Thr-Ala-Asp-Gly-Lys-Thr-Tyr-NH2(D9)及其突变体Tyr-Lys-Thr-Ala-Asn-Gly-Lys-Thr-Tyr-NH2(D9_M)的相互作用,ITC测得Cu2+-D9与Cu2+-D9_M复合体的化学计量比约为1: 1,用D9的突变体D9_M替换D9并不影响化学计量比但会降低对Cu2+的亲和力。这种热力学稳定性的改变是由于Asn(D9_M)替换了D9肽段的中间部分的Asp15残基,表明肽环中特殊结合位点的改变使之与Cu2+产生了特异性结合反应。由实验所测热力学参数可得该过程为吸热反应(ΔH > 0),熵增过程(ΔS > 0)且TΔS0 > ΔH0熵增效应较大并决定该过程的ΔG0 < 0,故表现为熵驱动过程,离子相互作用是该过程的主要推动力。此外,还研究了Cu2+与链球菌属G-蛋白B3结构域的两个突变体Asp-Val-Ala-Thr-Tyr-Thr-NH2(J1)和Glu-Val-Ala-Thr-Tyr-Thr-NH2(J2)之间的相互作用,ITC结果显示J1和J2对Cu2+的亲和力信号较弱,说明J1和J2不能与Cu2+相互作用,或者ITC技术不适合研究这种弱相互作用的结合。
金属离子-蛋白质相互作用的热力学特性对理解金属离子在生物系统中的作用十分关键[27]。蛋白质与金属离子结合有利于其催化活性、结构稳定性和功能调节,等温滴定量热法结合蛋白结构为二者结合的潜在的分子机制提供了大量的基础信息。根据Irving-Williams系列[28],二价金属离子配体的亲和力大小顺序为Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+,有时会因蛋白质金属结合位点不同而有所改变,但总体趋势大致相同[29]。此外,金属离子对于蛋白质的折叠十分重要,金属离子的动态平衡与蛋白质动力学、构象变化之间的相互关系可以通过许多神经退行性疾病表现出来,其中最明显的有卷发综合征、威尔逊氏病,阿茨海默症和帕金森氏病[30]。
近年来,对无机物和混合有机-无机化合物的生物活性研究和测定其功效的生物医学应用越来越多[31]。硼团簇作为硼中子俘获疗法(Boron neutron capture therapy,BNCT)[32, 33]的硼化合物药剂,这是一种针对恶性肿瘤的有效放疗方法。研究发现含有硼团簇的杂合分子为HIV-1蛋白酶(HIV-1 protease)、环氧合酶(Cyclooxygenase)、丝氨酸蛋白酶(Serine protease)和蛋白激酶C(Protein kinase C)的酶活性抑制剂。Losystkyy等[34]将稳态和时间分辨荧光蛋白猝灭技术与等温滴定量热法相结合研究了一系列闭合型硼酸盐及其官能团衍生物与人血清白蛋白(Human serum albumin,HSA)、牛血清白蛋白(Bovine serum albumin,BSA)、免疫球蛋白G(Im-munoglobulin G,IgG)、β-乳球蛋白(β-lactoglobulin,BLG)和溶菌酶(Lysozyme)的相互作用。研究结果表明化合物K2[B10H10]及其芳基胺衍生物都能与HSA相互作用,结合常数分别为1.4×103 M-1和1.2×103 M-1,吉布斯自由能分别为-17.9 kJ/mol和-17.5 kJ/mol。然而,芳基胺衍生物(4: 1)形成的复合体比K2[B10H10](2: 1)有更高的结合比,增强了分子间相互作用,降低了复合物形成时的疏水相互作用。该研究结果将有利于理解阴离子硼酸盐与作为血液中小分子载体的血清蛋白的相互作用方式,为未来开发硼化合物药剂提供实验依据。
2.2 ITC在蛋白质-单宁酸相互作用中的应用前花青素是植物体内的复杂多酚类次生代谢产物,它并非单一的化合物,而是由一系列的化合物所组成,包括了大分子量和小分子量的化合物,其中小分子量的有儿茶素(焦性儿茶酚和表儿茶素)、二聚体(原花青素B系列)、三聚体(原花青素C系列);大分子量为单宁及其聚合物[35]。其中单宁进入口腔后可结合蛋白质干扰消化酶的活性。高单宁食品入口感觉干涩,口腔黏膜会有褶皱感[36]。因此缓和单宁的涩味对酒类饮品十分关键,可以加入适当的蛋白澄清剂。Kilmister等[37]用等温滴定量热法研究从可可豆中分离纯化的前花青素与牛血清白蛋白(Bovine serum albumin,BSA)的相互作用。利用前花青素和蛋白质沉淀模型[38]对不同分子量的前花青素低聚物与蛋白的相互作用进行研究。研究表明分子量较大的前花青素比分子量小的分子表面积更大,蛋白质-单宁-蛋白质交联的机会也更大,当形成三元复合物时则生成了沉淀。文章还讨论了单宁与球蛋白相互作用可能涉及到多个结合位点,二者结合是随机的,发生在蛋白质表面疏水性区和亲水性区,并没有明确表现出特定的结合位点。这种非特异性结合结果把结合等温线分成了两个不同的部分,其中每个结合位点都有不同的结合常数和ΔH。滴定曲线上温度和NaCl的影响表明两者相互作用的吸热的疏水作用与放热的氢键作用同时发生,吸热和放热的结合反应计算出的ΔH是两个截然相反的ΔH值。另外,研究还发现,二者相互作用的ΔS值很容易受系统误差的影响。这些数据都指出等温滴定量热技术用于向前花青素这样成分不单一的混合物间相互作用的研究目前还存在一些问题需要解决。
2.3 ITC在蛋白质-糖类相互作用中的应用分子间的特异性识别是生命过程的核心。蛋白质与碳水化合物的相互作用是很多细胞识别过程的基础。细胞表面的糖基和蛋白质是细胞识别外来分子的主要途径,这种相互作用在很多生理和病理过程中扮演重要角色,如细胞黏附、病原体感染、植物与病原菌相互作用、豆科植物与根瘤菌共生过程、细胞凋亡、受精过程、癌细胞异常增生及转移和免疫反应等[39]。此外,糖类作为配体修饰药物载体,具有干扰糖-蛋白之间相互作用的能力,能够阻止细胞识别和吸附过程[40]。蛋白质-碳水化合物相互作用在食品科学及生物医学等领域有着广泛研究空间,近年来,越来越受到科研人员的关注。
赖氨酸结构域(LysM domain)是目前已知的细菌和真核生物中的一种碳水化合物结合蛋白区域。Patra等[41]用等温滴定量热法和荧光滴定方法研究壳寡糖与耻垢分枝杆菌结合蛋白(包含一个外源凝集素(MSL)和一个LysM结构域)的相互作用,证明每个二聚MSL-LysM分子均有两个亲和力不同的结合位点,且分子的亲和力与壳聚糖糖链的长度有关,且二者相互作用表现为负协同效应。显然,连接LysM和MSL结构域的长肽链的弹性对分子识别有促进作用。虽然植物和细菌的LysM结构域有差别,但是对肽聚糖片段和几丁质聚合物有同样的识别能力。并且,该研究表明只需要两个LysM结构域就足够与肽聚糖结合,这与先前文献报道的需要3个LysM结构域才足够与枯草芽孢杆菌和乳酸乳球菌蛋白结合不一致[42-45]。同时,MSL-LysM分子对壳寡糖的亲和力远高于LysM分子对壳寡糖的亲和力。
Hadian等[46]研究了β-乳球蛋白与水溶性波斯胶(Water-soluble fraction of Persian gum,WPG)在pH、蛋白多糖混合比、浓度、离子种类、离子强度和温度等条件下的相互作用。ITC结果表明温度对热力学参数的影响是显著的,通过对温度的影响分析说明静电相互作用、氢键和疏水作用是二者相互作用的主要推动力。
2.4 ITC在蛋白质-纳米粒子相互作用中的应用随着纳米技术的进步,开发出了不同性质的纳米材料(Nanomaterials,NMs),并拥有广泛的应用空间。常见的纳米材料主要有纳米金(Gold nanoparticles,AuNPs)[47]、金属氧化物(ZnO,CuO和Fe3O4)[48-51],聚合物(聚苯乙烯、壳聚糖和共聚物)[52-55]。生物分子通过纳米材料表面和界面张力驱动与之产生吸附作用,随后发生相互作用。研究生物分子和纳米材料的相互作用有利于纳米材料的应用和理解其毒理学机制[56],并确定不同种类纳米颗粒涂层的生物分子[57]。因此,测量和比较生理条件下不同生物分子与相同纳米材料的亲和性,或相同生物分子与不同纳米粒子的亲和性,了解纳米粒子覆盖在生物分子后的稳定性和功能就变得尤为重要[58, 59]。
近年来,ITC技术在构成纳米材料的双亲分子自组装性质和相互作用机理的研究中表现出独特的优势:该技术可以通过单次浓度扫描就能够准确测得反应体系一定浓度范围内分子间相互作用的焓变(如相变或假性相变焓),同时还能够通过能量突变所对应的混合表面活性剂的摩尔比确定反应体系的相界,使得等温量热滴定方法成为研究分子间弱相互作用最有效的实验手段之一[60]。ITC通过测定结合反应的热力学参数揭示了生物分子-纳米材料相互作用的机制(比如驱动力、亲和力和化学计量)、不同纳米粒子(如尺寸、形状和表面化学)对生物分子理化性质的影响,对于理解纳米材料在生物医学和环境科学中的应用以及纳米材料的毒理作用十分重要。同时,通过与其他技术联用有利于更好地理解纳米颗粒-生物分子相互作用。
2.5 ITC在膜蛋白-受体中的应用膜蛋白是指能够结合或整合到细胞或细胞器的膜上的蛋白质的总称。膜蛋白具有广泛的功能,是人体生长发育所必须的蛋白质,从离子转运到代谢调控过程均有膜蛋白的参与[61]。可以简单地把膜蛋白理解为细胞外和细胞内世界之间的“协调员和管理员”,当膜蛋白发生改变时会引发一系列的疾病。人类基因组30%的编码基因是膜蛋白,人们目前只了解很少一部分膜蛋白的分子机制和相互作用机制,直到2009年人们才得到完整的哺乳动物膜蛋白的实验热力学特性[61]。等温滴定量热法是测量可溶性蛋白与配体相互作用的常用工具,所以ITC可以用来探讨膜转运蛋白的底物结合,以及研究结合化学计量学和底物特异性。
许多膜蛋白的通道、转运体和受体都是高活性蛋白,拥有复杂的构象。等温滴定量热法可以为这种复杂的构象关系提供有用信息。Reyes等[62]研究ITC技术用于确定离子转运蛋白中的耦合离子数量,以及离子转运蛋白与底物的耦合机制,该方法可应用到不同的协同转运子和逆向转运蛋白的研究。Chavan等[63]用ITC技术研究ATP/ADP与ATP偶联转运蛋白之间的热力学关系。用ITC技术研究G-偶联受体蛋白(G-protein coupled receptors,GPCRs)与抑制剂、拮抗剂和其他效应物的偶联关系目前研究还比较少[64, 65]。此外,ITC还可研究脂类对膜蛋白的影响,包括磷脂双分子层和特殊脂类,这对于理解配基门控离子通道和受体结合导致跨膜结构域的改变有着特殊意义[66]。等温滴定量热技术用于膜蛋白的研究还有一个独特的优势是热容测定,而这些信息很难从其他途径获得[67]。迄今为止,ITC用于膜蛋白的研究潜力还未完全发掘出来,因此还有大量的生物学信息将会被更广泛的应用。
2.6 ITC在酶动力学中的应用大量文献表明,ITC是研究许多酶学反应的理想方法,因其不像其他酶测定方法需要显色、荧光或放射性同位素标记的配体[68, 69]。Sotoft等[68]通过ITC实验利用固定化脂肪酶催化甲醇/乙醇与菜籽油与的酯交换反应,比传统的高效液相色谱法分析更为快速准确。双环霉素(Bicyclomycin)是唯一的依赖ρ(Rho)因子终止的天然抑制剂,Rho因子是由6个亚基组成的解旋酶。Rho因子结合在新生的RNA链上,借助水解ATP获得能量推动其沿着RNA链移动,但移动速度比RNA聚合酶慢,当RNA聚合酶遇到终止子时便发生暂停,Rho因子得以赶上酶。Rho因子与RNA聚合酶相互作用,导致释放RNA,并使RNA聚合酶与该因子一起从DNA上释放下来。Brogan等[69]通过ITC实验确定双环霉素-rho类似物的相互作用。研究发现,合成的5a-(3-formylphenylsulfanyl)-dihydrobicyclomycin双环霉素配体比双环霉素更有效地抑制rho因子。
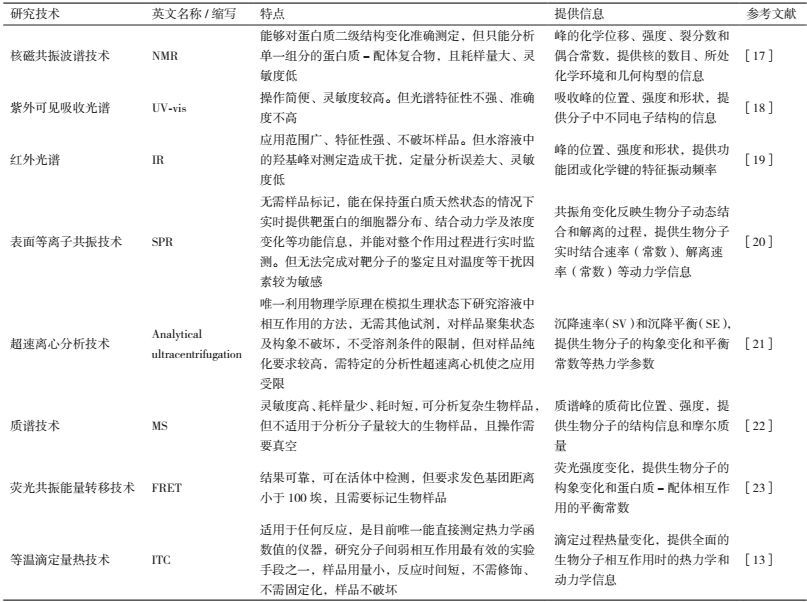
2.7 ITC在蛋白质-其他物质相互作用中的应用柯衣定(Chrysoidine)是工业上广泛使用的一种偶氮染料,具有潜在的毒性[70-72]。Sun等[73]用荧光猝灭技术和等温滴定量热等方法研究柯衣定与人血清白蛋白的相互作用。ITC结果(图 2)显示,柯衣定可以通过氢键自发地结合人血清白蛋白,二者相互作用的化学计量比约为1.5: 1,反应为放热过程。另外,∆H和∆S均为负值表明柯衣定与HSA相互作用的主要推动力是氢键和范德华力。荧光猝灭结果显示,柯衣定与HSA相互作用时Trp-214残基的微环境和HSA二级结构发生改变。分子对接结果表明,柯衣定分子与Gln-211残基形成氢键(1.80 Å)。此外,随着柯衣定的不断滴加导致HSA结构发生改变,对人体造成毒性伤害。该研究结果提供柯衣定在体内的运输机制和毒性机制,有利于更好地理解人类接触柯衣定的风险。
3 结语综上所述,任何结合反应只要能够产生足够的结合热均能通过量热法测量。但是由于不同生物系统的限制,目前蛋白质-配体相互作用的研究大多数为蛋白质-多肽、蛋白质-核酸、蛋白质-多糖、蛋白质-脂质、蛋白质-金属离子、蛋白质-抑制剂、蛋白质-底物、蛋白质-辅因子等,但这并不意味着其他配体不能与蛋白质相互作用或其相互作用无法测量。等温滴定量热法是测定溶液体系中分子间相互作用的有效技术手段,对分子结合反应提供有价值的热力学信息,ITC甚至可以用于固体材料如纳米颗粒,形成均匀的悬浮液。此外,ITC还可用于三元体系中,其中一个配体已结合到大分子上,用另一个配体滴定,如底物结合到酶-辅因子系统[74]。本综述主要介绍了近年来等温滴定量热技术在蛋白质-配体相互作用中的应用,通过科学分析实验数据可更好地理解ITC数据和结构之间的关系。
分子相互作用时,由于稀释、胶束形成/解离、构象变化、聚合、相变或结合现象都可能发生吸热/放热反应。因此正如其他分析仪器一样,ITC也更适合于研究相对简单明确的系统,因为复杂的多组分系统中的焓变很难解释。同时,当检测到任何焓变信号时它也很难精确地标识发生起点。此外,由于受到设备条件等因素限制较少与其他仪器联用而缺乏特异性。因此,ITC与其他分析方法联用,将有利于解决上述缺点。例如,光散射法可用于提供关于聚集体形成的信息,光谱法可用于提供构象变化的全面信息,离子选择性电极法可用于提供有关离子结合变化方面的信息。同时,ITC结合X射线晶体学和核磁共振光谱将有助于对复合体结构有更深了解。
等温滴定量热法目前已被作为测量分子相互作用的“黄金标准”[75]。大量研究证明该技术可对从简单到复杂相互作用的热力学参数进行测定。近年来,ITC越来越多的用来研究大分子复合物的形成,相互作用的化学计量学,结合界面面积构象变化的相关参数,同时也凭借其高灵敏度和非特异性的独特性质在药物研究过程中得到了长足发展。有理由相信,该分析技术的不断发展与完善,更好的应用其非特异性结合特性,确保其结果的有效性及其应有的应用价值,将有助于它在生命科学领域的应用将更加趋向多样化。
| [1] | Perozzo R, Folkers G, Scapozzaa L. Thermodynamics of protein-ligand interactions:history, presence, and future aspects. J Recept Signal Transduct Res, 2004, 24 (1-2): 1–52. DOI:10.1081/RRS-120037896 |
| [2] | Hansen LD, Fellingham GW, Russell DJ. Simultaneous determination of equilibrium constants and enthalpy changes by titration calorimetry:Methods, instruments, and uncertainties. Anal Biochem, 2011, 409 (2): 220–229. DOI:10.1016/j.ab.2010.11.002 |
| [3] | Ghai R, Falconer RJ, Collins BM. Applications of isothermal titration calorimetry in pure and applied research—survey of the literature from 2010. J Mol Recognit, 2012, 25 (1): 32–52. DOI:10.1002/jmr.1167 |
| [4] | Roselin LS, Lin MS, Lin PH, et al. Recent trends and some applications of isothermal titration calorimetry in biotechnology. Biotechnol J, 2010, 5 (1): 85–98. DOI:10.1002/biot.v5:1 |
| [5] | Liang Y. Applications of isothermal titration calorimetry in protein science. Acta Biochim Biophys Sin (Shanghai), 2008, 40 (7): 565–576. DOI:10.1111/abbs.2008.40.issue-7 |
| [6] | Myslinski JM, DeLorbe JE, Clements JH, et al. Protein-ligand interactions:thermodynamic effects associated with increasing nonpolar surface area. J Am Chem Soc, 2011, 133 (46): 18518–18521. DOI:10.1021/ja2068752 |
| [7] | Baker BM, Murphy KP. Evaluation of linked protonation effects in protein binding reactions using isothermal titration calorimetry. Biophys J, 1996, 71 (4): 2049–2055. DOI:10.1016/S0006-3495(96)79403-1 |
| [8] | Connelly PR, Varadarajan R, Sturtevant JM, et al. Thermodynamics of protein-peptide interactions in the ribonuclease S system studied by titration calorimetry. Biochemistry, 1990, 29 (25): 6108–6114. DOI:10.1021/bi00477a031 |
| [9] | Spolar RS, Record MT Jr. Coupling of local folding to site-specific binding of proteins to DNA. Science, 1994, 263 (5148): 777–784. DOI:10.1126/science.8303294 |
| [10] | Zhou YL, Liao JM, Chen J, et al. Macromolecular crowding enhances the binding of superoxide dismutase to xanthine oxidase:implications for protein-protein interactions in intracellular environments. Int J Biochem Cell Biol, 2006, 38 (11): 1986–1994. DOI:10.1016/j.biocel.2006.05.012 |
| [11] | Campagne S, Saurel O, Gervais V, et al. Structural determinants of specific DNA-recognition by the THAP zinc finger. Nucleic Acids Res, 2010, 38 (10): 3466–3476. DOI:10.1093/nar/gkq053 |
| [12] | Campagne S, Muller I, Milon A, et al. Towards the classification of DYT6 dystonia mutants in the DNA-binding domain of THAP1. Nucleic Acids Res, 2012, 40 (19): 9927–9940. DOI:10.1093/nar/gks703 |
| [13] | Velazquez-Campoy A, Freire E. Isothermal titration calorimetry to determine association constants for high-affinity ligands. Nat Protoc, 2006, 1 (1): 186–191. DOI:10.1038/nprot.2006.28 |
| [14] | Okhrimenko O, Jelesarov I. A survey of the year 2006 literature on applications of isothermal titration calorimetry. J Mol Recognit, 2008, 21 (1): 1–19. DOI:10.1002/(ISSN)1099-1352 |
| [15] | Falconer RJ, Penkova A, Jelesarovl I, et al. Survey of the year 2008:applications of isothermal titration calorimetry. J Mol Recognit, 2010, 23 (5): 395–413. DOI:10.1002/jmr.v23:5 |
| [16] | Ross PD, Subramanian S. Thermodynamics of protein association reactions:forces contributing to stability. Biochemistry, 1981, 20 (11): 3096–3102. DOI:10.1021/bi00514a017 |
| [17] | Furukawa A, Konuma T, Yanaka S, et al. Quantitative analysis of protein-ligand interactions by NMR. Prog Nucl Magn Reson Spectrosc, 2016, 96 (6): 47–57. |
| [18] | Veliká B, Tomečková V, Fodor K, et al. (E)-2-Benzylidenecycloa-lkanones Ⅻ. * Kinetic measurement of bovine and human serum albumine interaction with selected chalcones and their cyclic chal-cone analogues by UV spectrophotometry. Spectral Analysis Review, 2015, 3 (1): 1–8. DOI:10.4236/sar.2015.31001 |
| [19] | López-Lorente áI, Mizaikoff B. Mid-infrared spectroscopy for protein analysis:potential and challenges. Anal Bioanal Chem, 2016, 408 (11): 2875–2889. DOI:10.1007/s00216-016-9375-5 |
| [20] | Vachali PP, Li B, Bartschi A, et al. Surface plasmon resonance (SPR)-based biosensor technology for the quantitative characterization of protein-carotenoid interactions. Arch Biochem Biophys, 2015, 572 (15): 66–72. |
| [21] | Schuck P. Analytical ultracentrifugation as a tool for studying protein interactions. Biophys Rev, 2013, 5 (2): 159–171. DOI:10.1007/s12551-013-0106-2 |
| [22] | Smits AH, Vermeulen M. Characterizing protein-protein interactions using mass spectrometry:Challenges and opportunities. Trends Biotechnol, 2016, 34 (10): 825–834. DOI:10.1016/j.tibtech.2016.02.014 |
| [23] | Fernandes F, Coutinho A, Prieto M, et al. Electrostatically driven lipid-protein interaction:Answers from FRET. Biochim Biophys Acta, 2015, 1848 (9): 1837–1848. DOI:10.1016/j.bbamem.2015.02.023 |
| [24] | Vander Meulen KA, Saecker RM, Record MT Jr. Formation of a wrapped DNA-protein interface:experimental characterization and analysis of the large contributions of ions and water to the thermodynamics of binding IHF to H' DNA. J Mol Biol, 2008, 377 (1): 9–27. DOI:10.1016/j.jmb.2007.11.104 |
| [25] | Velázquez Campoy A, Freire E. ITC in the post-genomic era…? Priceless. Biophys Chem, 2005, 115 (2-3): 115–124. DOI:10.1016/j.bpc.2004.12.015 |
| [26] | Bou-Abdallah F, Giffune TR. The thermodynamics of protein interactions with essential first row transition metals. Biochim Biophys Acta, 2016, 1860 (5): 879–891. DOI:10.1016/j.bbagen.2015.11.005 |
| [27] | Makowska J, Żamojć K, Wyrzykowski D, et al. Binding of Cu (Ⅱ) ions to peptides studied by fluorescence spectroscopy and isothermal titration calorimetry. Spectrochim Acta A Mol Biomol Spectrosc, 2016, 153 : 451–456. DOI:10.1016/j.saa.2015.08.016 |
| [28] | Irving H, Williams R. Order of stability of metal complexes. Nature, 1948, 162 (4123): 746–747. DOI:10.1038/162746a0 |
| [29] | McCall KA, Fierke CA. Probing determinants of the metal ion selectivity in carbonic anhydrase using mutagenesis. Biochemistry, 2004, 43 (13): 3979–3986. DOI:10.1021/bi0498914 |
| [30] | Valko M, Jomova K, Rhodes CJ, et al. Redox-and non-redox-metal-induced formation of free radicals and their role in human disease. Arch Toxicol, 2016, 90 (1): 1–37. DOI:10.1007/s00204-015-1579-5 |
| [31] | Rak J, Dejlová B, Lampová H, et al. On the solubility and lipophilicity of metallacarborane pharmacophores. Mol Pharm, 2013, 10 (5): 1751–1759. DOI:10.1021/mp300565z |
| [32] | Barth RF, Coderre JA, Vicente MG, et al. Boron neutron capture therapy of cancer:current status and future prospects. Clin Cancer Res, 2005, 11 (11): 3987–4002. DOI:10.1158/1078-0432.CCR-05-0035 |
| [33] | Hawthorne MF, Lee MW. A critical assessment of boron target compounds for boron neutron capture therapy. J Neurooncol, 2003, 62 (1-2): 33–45. DOI:10.1007/BF02699932 |
| [34] | Losytskyy MY, Kovalska VB, Varzatskii OA, et al. An interaction of the functionalized closo-borates with albumins:The protein fluorescence quenching and calorimetry study. J Lumin, 2016, 169 : 51–60. DOI:10.1016/j.jlumin.2015.08.042 |
| [35] | Zhang L, Wang Y, Li D, et al. The absorption, distribution, metabolism and excretion of procyanidins. Food Funct, 2016, 7 (3): 1273–1281. DOI:10.1039/C5FO01244A |
| [36] | Barbehenn RV, Peter Constabel C. Tannins in plant-herbivore interactions. Phytochemistry, 2011, 72 (13): 1551–1565. DOI:10.1016/j.phytochem.2011.01.040 |
| [37] | Kilmister RL, Faulkner P, owney MO, et al. The complexity of condensed tannin binding to bovine serum albumin--An isothermal titration calorimetry study. Food Chem, 2016, 190 : 173–178. DOI:10.1016/j.foodchem.2015.04.144 |
| [38] | Harbertson JF, Kilmister RL, Kelm MA, et al. Impact of condensed tannin size as individual and mixed polymers on bovine serum albumin precipitation. Food Chem, 2014, 160 : 16–21. DOI:10.1016/j.foodchem.2014.03.026 |
| [39] | 黄毅, 黄金花, 谢青季, 等. 糖-蛋白质相互作用. 化学进展, 2008, 98(6): 942–950. |
| [40] | Disney MD, Seeberger PH. The use of carbohydrate microarrays to study carbohydrate-cell interactions and to detect pathogens. Chem Biol, 2004, 11 (12): 1701–1707. DOI:10.1016/j.chembiol.2004.10.011 |
| [41] | Patra D, Mishra P, Vijayan M, et al. Negative cooperativity and high affinity in chitooligosaccharide binding by a mycobacterium smegmatis protein containing LysM and lectin domains. Biochemistry, 2016, 55 (1): 49–61. DOI:10.1021/acs.biochem.5b00841 |
| [42] | Koharudin LM, Viscomi AR, Montanini B, et al. Structure-function analysis of a CVNH-LysM lectin expressed during plant infection by the rice blast fungus Magnaporthe oryzae. Structure, 2011, 19 (5): 662–674. DOI:10.1016/j.str.2011.03.004 |
| [43] | Lecoq L, Bougault C, Hugonnet JE, et al. Dynamics induced by β-lactam antibiotics in the active site of Bacillus subtilis L, D-transpeptidase. Structure, 2012, 20 (5): 850–861. DOI:10.1016/j.str.2012.03.015 |
| [44] | Liu T, Liu Z, Song C, et al. Chitin-induced dimerization activates a plant immune receptor. Science, 2012, 336 (6085): 1160–1164. DOI:10.1126/science.1218867 |
| [45] | Sánchez-Vallet A, Saleem-Batcha R, Kombrink A, et al. Fungal effector Ecp6 outcompetes host immune receptor for chitin binding through intrachain LysM dimerization. Elife, 2013, 2 : e00790. |
| [46] | Hadian M, Hashemhosseini SM, Farahnaky A, et al. Isothermal titration calorimetric and spectroscopic studies of β-lactoglobulin-water-soluble fraction of Persian gum interaction in aqueous solution. Food Hydrocoll, 2016, 55 : 108–118. DOI:10.1016/j.foodhyd.2015.11.006 |
| [47] | Zhou J, Ralston J, Sedev R, et al. Functionalized gold nanoparticles:synthesis, structure and colloid stability. J Colloid Interface Sci, 2009, 331 (2): 251–262. DOI:10.1016/j.jcis.2008.12.002 |
| [48] | Chatterjee T, Chakraborti S, Joshi P, et al. The effect of zinc oxide nanoparticles on the structure of the periplasmic domain of the Vibrio cholerae ToxR protein. FEBS J, 2010, 277 (20): 4184–4194. DOI:10.1111/j.1742-4658.2010.07807.x |
| [49] | Liu S, Han Y, Qiao R, et al. Investigations on the interactions between plasma proteins and magnetic iron oxide nanoparticles with different surface modifications. J Phys Chem C, 2010, 114 (49): 21270–21276. DOI:10.1021/jp1086653 |
| [50] | Chakraborti S, Joshi P, Chakravarty D, et al. Interaction of polyethyleneimine-functionalized ZnO nanoparticles with bovine serum albumin. Langmuir, 2012, 28 (30): 11142–11152. DOI:10.1021/la3007603 |
| [51] | Rabbani G, Khan MJ, Ahmad A, et al. Effect of copper oxide nanoparticles on the conformation and activity of β-galactosidase. Colloids Surf B Biointerfaces, 2014, 123 : 96–105. DOI:10.1016/j.colsurfb.2014.08.035 |
| [52] | Lindman S, Lynch I, Thulin E, et al. Systematic investigation of the thermodynamics of HSA adsorption to N-iso-propylacrylamide/N-tert-butylacrylamide copolymer nanoparticles. Effects of particle size and hydrophobicity. Nano Lett, 2007, 7 (4): 914–920. DOI:10.1021/nl062743+ |
| [53] | Baier G, Costa C, Zeller A, et al. BSA adsorption on differently charged polystyrene nanoparticles using isothermal titration calorimetry and the influence on cellular uptake. Macromol Biosci, 2011, 11 (5): 628–638. DOI:10.1002/mabi.v11.5 |
| [54] | Koppolu BP, Smith SG, Ravindranathan S, et al. Controlling chitosan-based encapsulation for protein and vaccine delivery. Biomaterials, 2014, 35 (14): 4382–4389. DOI:10.1016/j.biomaterials.2014.01.078 |
| [55] | Winzen S, Schoettler S, Baier G, et al. Complementary analysis of the hard and soft protein corona:sample preparation critically effects corona composition. Nanoscale, 2015, 7 (7): 2992–3001. DOI:10.1039/C4NR05982D |
| [56] | Gagner JE, Shrivastava S, Qian X, et al. Engineering nanomaterials for biomedical applications requires understanding the nano-bio interface:a perspective. J Phys Chem Lett, 2012, 3 (21): 3149–3158. DOI:10.1021/jz301253s |
| [57] | Monopoli MP, Aberg C, Salvati A, et al. Biomolecular coronas provide the biological identity of nanosized materials. Nat Nanotechnol, 2012, 7 (12): 779–786. DOI:10.1038/nnano.2012.207 |
| [58] | Nel AE, Mädler L, Velegol D, et al. Understanding biophysicochemical interactions at the nano-bio interface. Nat Mater, 2009, 8 (7): 543–557. DOI:10.1038/nmat2442 |
| [59] | Shemetov AA, Nabiev I, Sukhanova A. Molecular Interaction of proteins and peptides with nanoparticles. ACS Nano, 2012, 6 (6): 4585–4602. DOI:10.1021/nn300415x |
| [60] | De M, You CC, Srivastava S, et al. Biomimetic interactions of proteins with functionalized nanoparticles:a thermodynamic study. J Am Chem Soc, 2007, 129 (35): 10747–10753. DOI:10.1021/ja071642q |
| [61] | Rajarathnam K, Rösgen J. Isothermal titration calorimetry of membrane proteins-progress and challenges. Biochim Biophys Acta, 2014, 1838 (1): 69–77. DOI:10.1016/j.bbamem.2013.05.023 |
| [62] | Reyes N, Oh S, Boudker O. Binding thermodynamics of a glutamate transporter homolog. Nat Struct Mol Biol, 2013, 20 (5): 634–640. DOI:10.1038/nsmb.2548 |
| [63] | Chavan H, Li F, Tessman R, et al. Functional coupling of ATP-binding cassette transporter Abcb6 to cytochrome P450 expression and activity in liver. J Biol Chem, 2015, 290 (12): 7871–7886. DOI:10.1074/jbc.M114.605386 |
| [64] | Boudker O, Oh S. Isothermal titration calorimetry of ion-coupled membrane transporters. Methods, 2015, 76 : 171–182. DOI:10.1016/j.ymeth.2015.01.012 |
| [65] | Langelaan DN, Ngweniform P, Rainey JK. Biophysical characterization of G-protein coupled receptor-peptide ligand binding. Biochem Cell Biol, 2011, 89 (2): 98–105. DOI:10.1139/O10-142 |
| [66] | Finger S, Kerth A, Dathe M, et al. The efficacy of trivalent cyclic hexapeptides to induce lipid clustering in PG/PE membranes correlates with their antimicrobial activity. Biochim Biophys Acta, 2015, 1848 (11): 2998–3006. DOI:10.1016/j.bbamem.2015.09.012 |
| [67] | Pozzi N, Chen R, Chen Z, et al. Rigidification of the autolysis loop enhances Na+ binding to thrombin. Biophys Chem, 2011, 159 (1): 6–13. DOI:10.1016/j.bpc.2011.04.003 |
| [68] | Sotoft LF, Westh P, Christensen KV, et al. Novel investigation of enzymatic biodiesel reaction by isothermal calorimetry. Thermochim Acta, 2010, 501 (1-2): 84–90. DOI:10.1016/j.tca.2010.01.014 |
| [69] | Brogan AP, Widger WR, Bensadek D, et al. Development of a technique to determine bicyclomycinrho binding and stoichiometry by isothermal titration calorimetry and mass spectrometry. J Am Chem Soc, 2005, 127 (8): 2741–2751. DOI:10.1021/ja046441q |
| [70] | Lei H, Liu J, Song L, et al. Development of a highly sensitive and specific immunoassay for determining chrysoidine, a banned dye, in soybean milk film. Molecules, 2011, 16 (12): 7043–7057. DOI:10.3390/molecules16087043 |
| [71] | Gui WJ, Xu Y, Shou LF, et al. Liquid chromatography-tandem mass spectrometry for the determination of chrysoidine in yellow-fin tuna. Food Chem, 2010, 122 (4): 1230–1234. DOI:10.1016/j.foodchem.2010.02.054 |
| [72] | Yang BJ, Hao F, Li JR, et al. Characterization of the binding of chrysoidine, an illegal food additive to bovine serum albumin. Food Chem Toxicol, 2014, 65 : 227–232. DOI:10.1016/j.fct.2013.12.047 |
| [73] | Sun H, Liu Y, Li M, et al. Toxic effects of chrysoidine on human serum albumin:isothermal titration calorimetry and spectroscopic investigations. Luminescence, 2016, 31 (2): 335–340. DOI:10.1002/bio.v31.2 |
| [74] | Bradrick TD, Beechem JM, Howell EE. Unusual binding stoichiometries and cooperativity are observed during binary and ternary complex formation in the single active pore of R67 dihydrofolate reductase, a D2 symmetric protein. Biochemistry, 1996, 35 (35): 11414–11424. DOI:10.1021/bi960205d |
| [75] | Rehman AA, Ahsan H, Khan FH. Identification of a new alpha-2-macroglobulin:Multi-spectroscopic and isothermal titration calorimetry study. Int J Biol Macromol, 2016, 83 : 366–375. DOI:10.1016/j.ijbiomac.2015.11.043 |