2. 白云鄂博多金属资源综合利用省部共建国家重点实验室,包头 014010
2. Key Laboratory of Integrated Exploitation of Bayan Obo Multi-Metal Resources, Inner Mongolia University of Science and Technology, Baotou 014010
半胱氨酸(Cysteine,Cys)是生物体硫酸盐同化途径中的终产物,是无机硫元素最终转变为有机硫并参与生物体代谢的中间载体。Cys是一种含有巯基(-SH)的水溶性氨基酸,近年来备受关注,尤其是在生物体重金属抗性方面。Cys能与许多重金属离子发生特异性结合,从而直接或间接地参与生物体的金属离子解毒作用。许多研究发现[1, 2, 23],在重金属离子的作用下,生物体细胞内的Cys水平会产生相应的变化。Cys能够与多种重金属离子形成稳定的络合物[4-7]。在分子水平上,研究Cys-M(M表示金属离子)配合物的结构特征,对于研究Cys与金属离子的生理行为有重要的参考价值,对于探索生物体重金属抗性机制具有重要的意义。近年来,随着科技的不断进步,新技术(如原子力显微镜)在生物科学方面的应用使得这一研究成为可能。本文对半胱氨酸的基本特性、生物合成途径及其参与生物体重金属抗性的研究进展进行了综述,为研究Cys在生物体重金属抗性过程中的解毒机制提供一定的科学理论依据。
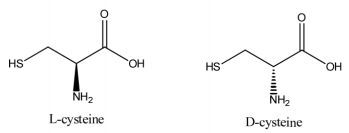
1 半胱氨酸的基本特性半胱氨酸学名为2-氨基-3-巯基丙酸,分子式为C3H7NO2S,相对分子质量为121.15,熔点220℃,在25℃水中的溶解度为277.433 g/L,有刺激性,易溶于稀无机酸和碱性溶液,不易溶于水,难溶于乙醇,不溶于氯仿和醚。根据半胱氨酸分子空间构型的不同分为3种构型:L型,D型和DL型,在生物体内只存在L-半胱氨酸[8],化学结构式如图 1所示。半胱氨酸是一种含巯基(-SH)的极性α-氨基酸,可以与硝普盐发生反应呈现紫色。Cys存在于许多蛋白质、谷胱甘肽中,能与许多金属离子作用形成不溶性的硫醇盐。Cys在酸性溶液中稳定,在中性或碱性溶液中不稳定,容易被氧化成胱氨酸,二者可以相互转换。Cys是一种还原剂,它可以促进面筋的形成,减少混合所需的时间和所需要用的能量。Cys能够通过改变蛋白质分子内部活分子之间的二硫键,从而改变蛋白质的结构并使其延伸开来。厌氧条件下,Cys在脱硫氢酶的作用下易被分解成硫化氢、氨和丙酮酸,或是在转氨酶作用下被分解成为丙酮酸和亚硫酸,或是被脱羧酶分解成为亚牛磺酸、牛磺酸等。Cys还可与有毒的芳香族化合物缩合成硫醚氨酸(Mercapturic acid)而起解毒作用。除此之外,Cys还具有抗衰老、美白、消炎、止痛、抑制细菌和癌细胞生长等生理功能,广泛应用于医学领域。
|
| 图 1 L-半胱氨酸和D-半胱氨酸的化学结构式 |
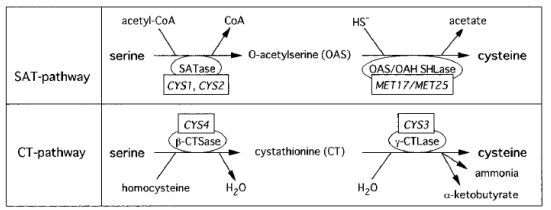
Cys在生物体内发挥的作用十分重要[9-12],首先它是甲硫氨酸合成的起始物质,同时又参与生物素、硫胺素、硫辛酸、辅酶M及辅酶A的形成;生物体内铁硫簇是许多酶的作用位点,Cys在铁硫簇生物合成的过程中起到了重要的作用,通过形成二硫键来实现蛋白质的加工修饰。在生物体中,Cys参与硫氧还蛋白及谷胱甘肽(Glutathione,GSH)的合成,其中,Cys还是合成GSH的前体物质,二者是生物体抗氧化的重要物质。Cys是许多生物体硫酸盐同化途径中的终产物。硫酸盐从体外被膜转运蛋白运输到体内后,首先被ATP硫酸化酶活化为5′-腺苷酰硫酸(APS)或3′-磷酸腺苷-5′磷酰硫酸(PAPS),然后其被相应的还原酶还原为亚硫酸盐,亚硫酸盐又被亚硫酸盐还原酶还原为硫化物,最后硫化物与O-乙酰-L-丝氨酸在O-乙酰还原酶的作用下生成Cys[10]。无机硫元素最后被固定到半胱氨酸骨架中,从而实现向有机硫元素的转变。然后Cys再进一步参与生物体细胞内其他的代谢途径。在细菌、真菌、植物等硫的新陈代谢调控途径中,Cys是主要的低分子量调节器[11]。在合成半胱氨酸过程中,硫化物能通过两种不同的方式被整合入半胱氨酸骨架:一种路径是SAT路径;另一种是CT路径[11-13]。
2.1 SAT合成路径在生物体硫酸盐同化途径中,硫化物能通过两种不同的方式被整合入半胱氨酸骨架:第一种合成途径称为SAT路径,首先丝氨酸与乙酰辅酶A被丝氨酸乙酰转移酶(SATase)催化生成O-乙酰丝氨酸(OAS),而后由O-乙酰丝氨酸裂解酶(OAS-TL,又称为半胱氨酸合成酶)催化OAS与硫化物反应生成Cys,此路径被称为SAT路径[13, 14]。许多植物和细菌就是利用该路径合成Cys的,如大肠杆菌等。结合我们近几年的实验[15-20],通过对嗜酸氧化亚铁硫杆菌硫酸盐同化途径中的几个相关基因进行表达、鉴定与分析表明,嗜酸氧化亚铁硫杆菌也是采用SAT路径合成半胱氨酸的。
2.2 CT合成路径另外,OAS-TL还参与半胱氨酸合成的第二条途径。O-乙酰高丝氨酸与硫化物在OAS-TL催化作用下生成高丝氨酸,高丝氨酸随后在胱硫醚-β-合酶(β-CTSase)催化作用下合成胱硫醚(CT),胱硫醚最后在胱硫醚-γ-裂解酶的催化作用下被分解为半胱氨酸和α-酮丁酸,此合成路径被称为CT路径[11-13, 21]。一些真菌如亚罗酵母菌、脉孢菌和一些原生生物可采用上述两种方式合成半胱氨酸[5]。两种合成途径如图 2。
3 半胱氨酸与重金属抗性生物体为了适应外界的不利环境,自身产生了一系列的抗性与解毒机制。其中,半胱氨酸直接与多种重金属离子发生特异性结合,或是通过其代谢衍生物间接参与生物体重金属抗性。半胱氨酸参与生物体重金属离子的解毒作用越来越受到关注。
3.1 半胱氨酸与重金属离子的直接作用半胱氨酸的巯基与Hg2+、Cu2+和Ag+等重金属离子之间有着不同的结合能力,这种结合力的强弱顺序为:Hg2+ > Cu2+~Ag+,结合后以R-S-M′或R-S-M′′-S-R(M′、M′′各为1价、2价金属)的形式形成不溶性的硫醇盐[22]。还有文献报道,半胱氨酸能与弱氧化性的Cu2+发生氧化还原反应,半胱氨酸被氧化成胱氨酸(形成二硫键),而铜离子则被还原成亚铜离子[23, 24]。张贵珠等[4]探究了在碱性、中性、酸性等介质中半胱氨酸与金属离子的相互作用,发现半胱氨酸与Co2+仅在强碱性介质中能够反应,并且生成稳定性较好的高灵敏度络合物,最终形成了以钴离子为探针对半胱氨酸进行测定的方法。Yang等[5]在研究Zn2+在L-cysteine金电极上的电化学行为发现,L-cysteine能够与Zn2+相互作用形成一种复杂的络合物。刘文涵等[6]利用原子吸收硫化锌法间接测定半胱氨酸络合反应的机理研究发现,在碱性条件下,半胱氨酸以半胱氨酸基(Cys-)的形态和ZnS解离出的Zn2+反应生成的更加稳定可溶性络合物[HS-CH2CH(NH2)-COO]2Zn(OH)2,该络合物的结构式如图 3。
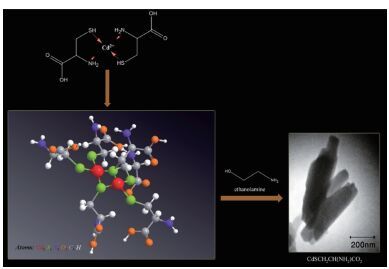
本实验近期研究发现,使用不同浓度Cd2+的胁迫野生型BL21(E. coli DH5α)和pCmtR-BL21(细胞中含有重组质粒pCmtR)和pCysE-BL21(细胞中含有重组质粒pCysE),与对照组相比,实验组菌体的生物量变化不明显,但是其细胞内Cys和GSH的水平却是上升的。这一现象与Ilyas等发现假丝酵母在重金属胁迫下细胞内的Cys和GSH水平是上升的现象基本一致[3];同时测得菌体细胞内的Cd2+含量也明显增加。推测菌体内的金属离子可能是与Cys和GSH形成了络合物[25-29],尤其是GSH影响了细胞对于Cd2+吸收[30],进而增加了其对Cd2+的抗性[3, 6, 25-29]。Ghiamati等[7]在室温下成功合成了稳定的、有选择性的、反应灵敏的Cd-Cysteine复合纳米棒(Cd-Cysteine Nanorods,Cd-Cys NRs),并将其作为纳米荧光传感器应用于测定含有微摩尔每升的Fe(Ⅲ)样品。Cd-Cys NRs的形成过程如图 4。Domínguez-Solís等[31]在研究拟南芥对Cd2+的抗性时发现,在叶子毛状体中,增加Cys的有效的生物合成量可以增强拟南芥对Cd2+的耐受性和积累。在植物修复过程中,半胱氨酸生物合成途径的分子工程研究和增加叶子毛状体数量将在增强植物对重金属离子的抗性方面重要作用[31-34]。
3.2 半胱氨酸与重金属离子的间接作用半胱氨酸与重金属离子的间接作用研究较多的主要集中体现在金属硫蛋白(MT)与重金属离子相互作用和谷胱甘肽与金属离子相互作用。
3.2.1 金属硫蛋白与重金属离子相互作用金属硫蛋白(Metallothionein,MT)是一类无芳香氨基酸、无组氨酸、低分子量、高金属含量、富含半胱氨酸的具有高诱导特性和结合金属能力的蛋白质,广泛存在于生物体内[35-51]。Cys以比较保守的序列形式CysXCys、CysXyCys和CysCys(X代表其他氨基酸)存在于MT中[37],因此MT能够通过巯基与金属离子结合形成具有特殊光谱学特征的金属-巯基簇(如Cd-MT,Cu-MT等),这些金属-巯基簇具有特征吸收峰:Cu-MT为250 nm,Cd-MT为275 nm,Zn-MT为220 nm,Hg-MT为300 nm。Haq等[38]利用2D-NMR及X-射线晶体衍射法测定发现,金属硫蛋白的三级结构呈亚铃状,不含α螺旋和β折叠,有两个大小相当的结构域(直径1.5-2 nm)构成,即α结构域和β结构域。这两个结构域结合金属元素的能力不同,C端的α结构域中含11个Cys,N端的β结构域中含9个Cys,这20个Cys能够结合7个Zn2+或Cd2+,或多达12个Cu2+[39]。Li等[40]研究大枣(Ziziphus jujuba)的1型金属硫蛋白(ZjMT)发现,在该金属硫蛋白的氮末端含有6个Cys,其结构为CXCXXXCXCXXXCXC(C=Cys),碳末端也含有六个Cys,其结构为CXCXXXCXCXXCXC(C=Cys)。ZjMT对金属离子的吸附能力强弱顺序为:Cu2+ > Cr3+ > Mn2+ > Cd2+ > Zn2+ > Ni2+。推测ZjMT中的半胱氨酸残基可能对金属离子具有束缚和隔离能力[41-43]。Kassim等[44]通过量子理论分析Zn2+与金属硫蛋白(MT)相互作用,并预测了[(Zn)3(MeS)9]3-(Me表示甲硫醇)氧化模型系统。[(Zn)3(MeS)9]3-的结构模型如图 5。有许多研究表明,水生植物在受金属离子污染的环境中,MT会被诱导表达[45-48],编码MTs的基因在植物细胞中广泛存在[42, 49-51],哺乳类的MTs有高度保守的结构区域[52],而植物MTs则含有特殊排列的半胱氨酸残基区域,但是它们的结构和功能变化多样[42]。
3.2.2 谷胱甘肽与金属离子相互作用谷胱甘肽(Glutathione,GSH)是一种具有特殊生物学功能的由谷氨酸、半胱氨酸及甘氨酸组成的三肽,含有氨基、巯基、羧基和酰胺基等多种配位基团。因为其分子中包含3个可解离的质子和10个可参与配位的原子,所以谷胱甘肽是研究金属离子与生物分子相互作用的理想模型。GSH是细胞内可以直接作用金属离子的螯合剂,具有强烈亲S特征的金属元素可以和GSH分子中的巯基结合,从而达到解毒的作用。卢永科等[53]研究发现,GSH对顺铂肝细胞毒性具有重要的保护作用。Magda等[54]在研究金属离子对离体鱼细胞的毒性时发现,几种金属离子对细胞的毒性强弱顺序为Hg > Cd > Zn > Cu > Pb > Ni。阮湘元等[55]用原子力显微镜探究谷胱甘肽在汞表面的吸附与自组装行为发现,GSH在汞表面的吸附不经历单分子层吸附过程,而是GSH游离的巯基首先在汞表面形成少量巯基汞化物吸附核后,在远离吸附表面的GSH末端的羧基、氨基及游离巯基等基团之间通过氢键作用相互集聚组成孤立的多分子层GSH簇。彭敏等[56]利用原子力显微镜(AFM)研究还原型谷胱甘肽与铬离子的相互作用时发现,GSH能与Cd2+迅速络合,并且该络合物具有多个活性基,能够高效的络合Cd2+,络合物间再通过氢键作用相互聚集,形成一定的聚集体(图 6)。刘建华等[57]采用密度泛函DFT/B3LY P方法研究Cd2+,Hg2+,Pb2+与GSH的相互作用位点时发现,Cd2+,Hg2+,Pb2+都能与GSH电负性原子(N,O,S)形成稳定的络合物,且与GSH巯基S原子具有很强的结合能力。Vicky等[58]在研究汞与GSH配合物的形成和结构时发现,汞与GSH反应形成的配合物主要是[Hg(Gs)2]4-和[Hg(Gs)3]7-(Gs=GSH)。Levina等[59]的研究表明Cr(Ⅵ)能与GSH作用形成一种中间态配合物[CrvO(LH2)2]3-(LH=GSH),同时发现该配合物致癌。Cheng等[60]在GSH与金属离子的电化学行为研究过程中发现,电极上的谷胱甘肽膜具有离子门效应,La3+、Pb2+、Ba2+等金属离子有明显的打开膜上离子门的行为,而Zn2+却起到关闭离子门的作用。GSH-金属离子单分子膜结构随着反应体系条件的变化而变化[61]。植物在重金属离子污染的环境中生长时,其细胞内会产生形成一种以GSH为底物的螯合肽(phytochelatins,PCs),其基本结构为(γ-Glu-Cys)n-Gly(n = 2-11),PCs在植物重金属修复过程中发挥了重要的作用[62, 63]。
4 展望综上所述,Cys是许多生物体的硫酸盐同化途径中关键代谢产物,硫是生物体重要的营养元素,生物体将氧化态硫吸收并还原后,最终固定到半胱氨酸分子中使其能够顺利进入其他代谢途径,并通过直接或间接作用参与到微生物的重金属抗性过程中。在我们的前期研究中也发现,硫醇化合物Cys在生物体重金属抗性中可能具有封存重金属离子的作用[19]。但是Cys在参与生物体重金属抗性过程中,重金属离子是如何被转运的,如何被封存的,这种机制尚不明确,相关方面的研究也很少有报道。另外,原子力显微镜(AFM)在生物科学方面的应用,使得在分子水平上研究Cys与金属离子的作用成为可能。由于生物细胞是在异相条件下进行的系列有序的生理生化过程,进一步研究Cys及其金属离子配合物在分子水平上的结构特征,对于研究Cys及其与金属离子的生理行为研究有参考价值。
| [1] | 孙雪梅. 植物的硫同化及其相关酶活性在镉胁迫下的调节. 植物生理与分子生物学学报, 2006, 32(1): 9–16. |
| [2] | Harada E, Yamaguchi Y, Koizumi N, et al. Cadmium stress induces production of thiol compounds and transcripts for enzymes involved in sulfur assimilation pathways in Arabidopsis. Journal of Plant Physiology, 2002, 159 (159): 445–448. |
| [3] | Ilyas S, Rehman A. Oxidative stress, glutathione level and antioxidant response to heavy metals in multi-resistant pathogen, Candida tropicalis. Environmental Monitoring & Assessment, 2015, 187 (1): 4115–4122. |
| [4] | 张贵珠, 王月梅, 赵鹏, 等. 以钴离子为探针测定半胱氨酸的研究. 稀有金属, 1998, 22(1): 55–59. |
| [5] | Yang NJ, Wang XX, Wan QJ. Electrochemical reduction of Zn (Ⅱ) ions on L-cysteine coated gold electrodes. Electrochimica Acta, 2006, 51 (10): 2050–2056. DOI:10.1016/j.electacta.2005.07.011 |
| [6] | 刘文涵, 单胜艳, 张丹, 等. 原子吸收硫化锌法间接测定半胱氨酸络合反应的机理研究. 光谱学与光谱分析, 2005, 25(10): 1717–1719. DOI:10.3321/j.issn:1000-0593.2005.10.048 |
| [7] | Ghiamati E, Boroujerdi R. Cd-Cysteine nanorods as a fluorescence sensor for determination of Fe (Ⅲ) in real samples. Journal of Fluorescence, 2015, 26 (1): 1–13. |
| [8] | 段静静. Pseudomonas sp. QR-101生物合成L-半胱氨酸的系统生物学及相关转化途径研究[D]. 天津: 南开大学, 2012. |
| [9] | Guédon E, Martin-Verstraete I. Cysteine metabolism and its regulation in bacteria. Microbiol Monographs, 2007, 5 : 195–218. DOI:10.1007/978-3-540-48596-4 |
| [10] | Bick JA, Dennis JJ, Zylstra GJ, et al. Identification of a new class of 5'-adenylysulfate (APS) reductasefrom sulfate-assimilating bacteria. Journal of Bactertiology, 2000, 182 (1): 135–142. DOI:10.1128/JB.182.1.135-142.2000 |
| [11] | Brzywczy J, Sienko M, Kucharska A, et al. Sulphur amino acid synthesis in Schizosaccharomyces pombe represents a specific variant of sulphur metabolism in fungi. Yeast, 2002, 19 : 29–35. DOI:10.1002/(ISSN)1097-0061 |
| [12] | 宋超, 郑春丽, 王建英. 微生物硫酸盐的同化途径及其与重金属抗性的关系. 安徽农业科学, 2012, 40(11): 6368–6370. DOI:10.3969/j.issn.0517-6611.2012.11.004 |
| [13] | Ono B, Hazu T, Yoshida S, et al. Cysteine biosynthesis in Saccharomyces cerevisiae:a new outlook on pathway andregulation. Yeast, 1999, 15 : 1365–1375. DOI:10.1002/(ISSN)1097-0061 |
| [14] | Koprivova A, Meyer AJ, Schween G, et al. Functional knockout of theadenosine 5' -phosphosulfate reductase gene in Physcomitrella patens revives an old route of sulfate assimilation. Journal of Biological Chemistry, 2002, 277 (35): 32195–32201. DOI:10.1074/jbc.M204971200 |
| [15] | 钱林, 郑春丽, 柳建设. 嗜酸氧化亚铁硫杆菌ATP硫酸化酶的表达、纯化及性质鉴定. 生物技术通报, 2012(6): 136–140. |
| [16] | Zheng CL, Zhang YY, Liu YD, et al. Characterization and reconstitute of a. Current Microbiology, 2009, 58 (6): 586–592. DOI:10.1007/s00284-009-9375-1 |
| [17] | Zheng CL, Nie L, Qian L, et al. K30, H150, and H168 are essential residues for coordinating pyridoxal 5'-phosphate of O-Acetylserine sulfhydrylase from Acidithiobacillus ferrooxidans. Current Microbiology, 2010, 60 : 461–465. DOI:10.1007/s00284-009-9565-x |
| [18] | 郑春丽, 李艳君, 钱林, 等. 嗜酸氧化亚铁硫杆菌半胱氨酸合成酶的表达、纯化及其性质鉴定. 生物技术通报, 2011(3): 180–184. |
| [19] | Zheng CL, Chen MJ, Tao ZL, et al. Differential expression of sulfur assimilation pathway genes in Acidithiobacillus ferrooxidans under Cd2+ stress:evidence from transcriptional, enzymatic, and metabolic profiles. Extremophiles, 2015, 19 : 429–436. DOI:10.1007/s00792-014-0728-8 |
| [20] | 郑春丽, 王丹, 张礼, 等. 嗜酸氧化亚铁硫杆菌硫酸盐同化相关基因的鉴定与分析. 生物技术通报, 2016, 32(2): 131–139. |
| [21] | Thomas D, Surdin-Kerjan Y. Metabolism of sulphur amino acids in Saccharomyces cerevisiae. Microbiology & Molecular Biology Reviews Mmbr, 1997, 61 : 503–532. |
| [22] | 唐杰. 基于半耽氨酸与重金属离子相互作用的分析应用研究[D]. 重庆: 西南大学, 2011. |
| [23] | Yang W, Gooding JJ, Hibbert DB. Characterisation of gold eleetrodes modified with self-assembled monolayers of L-cysteine for the adsorptive stripping analysis of Copper. Journal of Electroanalytical Chemistry, 2001, 516 (1-2): 10–16. DOI:10.1016/S0022-0728(01)00649-0 |
| [24] | Prudent M, Girault HH. The role of Copper in cysteine oxidation:study of intra-and inter-molecular reactions in mass spectrometry. Metallomics Integrated Biometal Science, 2009, 1 (2): 157–165. DOI:10.1039/B817061D |
| [25] | 赵楠, 林璨瑜, 王淑芳, 等. 过表达B基因的转基因微型番茄的获得. 南开大学学报, 2006, 39(4): 103–107. |
| [26] | 梁智万, 林秋红, 肖启华, 等. 口服谷胱甘肽 (GSH) 治疗慢性铅中毒临床疗效观察. 中国工业医学杂志, 1997, 10(6): 352–353. |
| [27] | Prashant M, Nisha KR, Sudesh KY. Cadmium induced oxidative stress influence on glutathione metabolic genes of Camellia sinensis(L.) O. Kuntze. Environmental Toxicology, 2007, 22 (4): 368–374. DOI:10.1002/(ISSN)1522-7278 |
| [28] | 刘慧, 王晓蓉, 王为本, 等. 不同形态锌离子对鲫鱼谷胱甘肽系统的影响. 中国环境学报, 2005, 25(2): 169–173. |
| [29] | 孙琴, 王超. 土壤外源Cd和Pb复合污染对小麦 (Tritioum asetivum L.) 根系植物络合素和谷胱甘肽的影响. 生态环境, 2008, 17(5): 1833–1838. |
| [30] | Rehman A, Anjum MS. Multiple metal tolerance and biosorption of cadmium by Candida tropicalis isolated from industrial effluents:glutathione as detoxifying agent. Environmental Monitoring & Assessment, 2011, 174 (1-4): 585–595. |
| [31] | Domínguez-Solís JR, López-Martín MC, Ager FJ, et al. Increased cysteine availability is essential for cadmium tolerance and accumulation in Arabidopsis thaliana. Plant Biotechnology Journal, 2004, 2 (6): 469–476. DOI:10.1111/pbi.2004.2.issue-6 |
| [32] | Noji M, Saito M, Nakamura M, et al. Cysteine synthase overexpression in tobacco confers tolerance to sulfur-containing environment pollutants. Plant Physiol, 2001, 126 (3): 973–980. DOI:10.1104/pp.126.3.973 |
| [33] | Dominguez-Solis JR, Gutierrez-Alcala G, Romero LC, et al. The cytosolic O-acetylserine (thiol) lyase gene is regulated by heavy metals and can function in cadmium tolerance. Journal of Biological Chemistry, 2001, 276 (12): 9297–9302. DOI:10.1074/jbc.M009574200 |
| [34] | Kawashima CG, Noji M, Nakamura M, et al. Heavy metal tolerance of transgenic tobacco plants over-expressing cysteine synthase. Biotechnology Letters, 2004, 26 (2): 153–157. DOI:10.1023/B:BILE.0000012895.60773.ff |
| [35] | Romeroy-Isart N, Vasak M. Advances in the structure and chemistry of metallothioneins. Journal of Inorganic Biochemistry, 2002, 88 (3-4): 388–396. DOI:10.1016/S0162-0134(01)00347-6 |
| [36] | 赵之伟, 曹冠华, 李涛. 金属硫蛋白的研究进展. 云南大学学报:自然科学版, 2013, 35(3): 390–398. |
| [37] | 张艳, 杨传平. 金属硫蛋白的研究进展. 分子植物育种, 2006, 4(3): 73–78. |
| [38] | Haq F, Mahoney M, Koropatnick J. Signaling events for metallothionein induction. Mutation Research/fundamental & Molecular Mechanisms of Mutagenesis, 2003, 533 (1-2): 211–226. |
| [39] | 田晓丽, 郭军华. 金属硫蛋白的研究进展. 国外医学药学分册, 2005, 32(2): 119–124. |
| [40] | Li LS, Meng YP, Cao QF, et al. Type 1 metallothionein (ZjMT) is responsible for heavy metal tolerance in Ziziphus jujube. Biochemistry, 2016, 81 (6): 565–573. |
| [41] | Vallee BL. Introduction to metallothionein. Methods Enzymol, 1991, 205 (1): 3–7. |
| [42] | Cobbett CP. Goldsbrough. Phytochelatins and metallothioneins:roles in heavy metal detoxification and homeostasis. Plant Biology, 2002, 53 (53): 159–182. |
| [43] | Coyle P, Philcox JC, Carey LC, et al. Metallothionein:the multipurpose protein. Cellular & Molecular Life Sciences Cmls, 2002, 59 (4): 627–647. |
| [44] | Kassim R, Ramseyer C, Enescu M. Oxidation reactivity of zinc-cysteine clusters in metallothionein. Journal of Biological Inorganic Chemistry, 2013, 18 (3): 333–342. DOI:10.1007/s00775-013-0977-5 |
| [45] | Lavradas RT, Hauser-Davis RA, Lavandier RC, et al. Metal, metallothionein and glutathione levels in blue crab (Callinectes sp.) specimens from southeastern Brazil. Ecotoxicology & Environmental Safety, 2014, 107 (9): 55–60. |
| [46] | Wang C, Zhang F, Cao W, et al. The identification of metallothionein in rare minnow (Gobiocypris rarus) and its expression following heavy metal exposure. Environmental Toxicology & Pharmacology, 2014, 37 (3): 1283–1291. |
| [47] | Han YL, Zhang S, Liu GD, et al. Cloning, characterization and cadmium inducibility of metallothionein in the testes of the mudskipper Boleophthalmus pectinirostris. Ecotoxicology & Environmental Safety, 2015, 119 : 1–8. |
| [48] | Santovito G, Boldrin F, Irato, P. Metal and metallothionein distribution in different tissues of the mediterranean clam Venerupis philippinarum during copper treatment and detoxification. Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 2015, 174-175 : 46–53. |
| [49] | Murphy A, Taiz L. Comparison of metallothionein gene expression and nonprotein thiols in ten Arabidopsis ecotypes. Plant Physiology, 1995, 109 (3): 945–954. DOI:10.1104/pp.109.3.945 |
| [50] | Dundar E, Sonmez GD, Unver T. Isolation, molecular characterization and functional analysis of OeMT2, an olive metallothionein with a bioremediation potential. Molecular Genetics and Genomics, 2015, 290 (1): 187–199. DOI:10.1007/s00438-014-0908-3 |
| [51] | Tomas M, Pagani MA, Andreo CS, et al. Sunflower metallothionein family characterization. Study of the Zn (Ⅱ)-and Cd (Ⅱ)-binding abilities of the HaMT1 and HaMT2 isoforms. Journal of Inorganic Biochemistry, 2015, 148 : 35–48. DOI:10.1016/j.jinorgbio.2015.02.016 |
| [52] | Klaassen CD, Liu J, Choudhuri S. Metallothionein:an intracellular protein to protect against cadmium toxicity. Pharmacology and Toxicology, 1999, 39 (39): 267–294. |
| [53] | 卢永科, 川岛明, 堀井郁夫, 等. 顺铂对大鼠肝细胞毒性及谷胱甘肽的保护作用. 中国公共卫生, 2004, 20(4): 440–441. DOI:10.11847/zgggws2004-20-04-34 |
| [54] | Magda M, Helmut S. Cytotoxicity of metals in isolated fish cells:Importance of the cellular glutathione status. Comparative Biochemistry and Physiology PartA, 1998, 120 (1): 83–88. DOI:10.1016/S1095-6433(98)10013-2 |
| [55] | 阮湘元, 彭敏, 徐经伟, 等. 谷胱甘肽在汞表面吸附与自组装行为的原子力显微镜研究. 分析化学研究简报, 2005, 32(11): 1587–1589. |
| [56] | 彭敏. 谷胱甘肽对Cd的解毒机理研究. 东莞理工学院学报, 2014, 21(5): 69–73. |
| [57] | 刘建华, 李燕, 王海军. 量子化学研究Cd2+、Hg2+、Pb2+与谷肤甘肤相互作用. 计算机与应用化学, 2013, 30(2): 141–146. |
| [58] | Vicky M, Farideh J. Mercury (Ⅱ) complex formation with glutathione in alkaline aqueous solution. Journal of Biological Inorganic Chemistry, 2008, 13 (4): 541–553. DOI:10.1007/s00775-008-0342-2 |
| [59] | Aviva L, Zhang LB, Peter LA. Structure and reactivity of a chromium (V) glutathione complex. Inorganic Chemistry, 2003, 42 (3): 767–784. DOI:10.1021/ic020621o |
| [60] | Cheng F, Zhou XY. Electrochemical studies of glutathione monolayer assembled on a polycrystalline gold electrode. Wuhan University Journal of Natural Sciences, 2002, 7 (1): 102–106. DOI:10.1007/BF02830026 |
| [61] | Cheng F, Zhou XY. Voltammetry and EQCM investigation of glutathione monolayer and its complex ation with Cu2+. Electroanalysis, 2003, 15 (20): 1632–1638. DOI:10.1002/(ISSN)1521-4109 |
| [62] | Cobbett CS. Phytochelatin biosynthesis and function in heavy-metal detoxification. Current Opinion in Plant Biology, 2000, 3 (3): 211–216. DOI:10.1016/S1369-5266(00)00066-2 |
| [63] | Cobbet CS. Phytochelatin and their roles in heavy metal detoxification. Plant Physiology, 2000, 123 (3): 825–832. DOI:10.1104/pp.123.3.825 |