当今,农业面源污染已成为重要的环境问题。农业源总氮(TN)、总磷(TP)分别占全国排放总量的57.2%和67.4%,已超过工业污染[1]。肥料和农药是农业面源污染重要来源,一方面直接污染水源,另一方面通过促进藻类过度增殖而污染水源。藻类的过度繁殖会使水体产生显著的臭气物,且“藻毒素”含量超标。流行病学调查发现,饮水中的微囊藻毒素(MC-LR)与肝癌的地区高发性及原发性肝细胞癌的病人数有关[2]。残留的农药进入水体后,会通过食物链在水产品中富集,引发质量安全问题。2006年浙江省嘉兴市由于晚稻田害虫防治,使用大量农药,污染了环境,引发家蚕大面积中毒事件[3]。
针对农业面源污染,杨林章等[4]提出了“4R”防治理论,即:源头减量,过程截断,末端修复,循环利用。而环境微生物技术在“4R”阶段中的应用,将进一步提升防治效果[5]。研究表明,微生物对受污染的土壤、水体具有良好的修复效果[6-10]。此外,一些微生物进入环境中,对作物的生长有促进作用,段秀梅等[11]研究发现,用两株解磷菌,黏质沙雷氏菌(Serratia marcescens)和产气肠杆菌(Enterobacter aerogenes)处理玉米,结果株高、根干重、植株干重分别比未处理组高29.9%、16.7%、24.2%,类似的微生物肥料在耕地质量提升中具有重要作用[12]。这类微生物菌肥可以增加土壤中养分的综合利用,减少化肥的施用和流失,在源头阶段减少污染量。
本研究结合了农业面源污染与作物促生问题,以双功能菌种的分离作为切入点,从环境中获得能降解有机磷农药,并能溶解无机磷的菌种,并建立以该类菌株为核心的复合微生物菌剂,探索该菌剂应用于分解有机磷农药、溶解无机难溶磷的综合方法和效果,为其在农业面源污染及作物促生中的应用提供依据。
1 材料与方法 1.1 材料 1.1.1 试剂和培养基敌百虫标准品(100 μg/mL u=3%)购自阿拉丁公司,毒死蜱标准品(99.0%)购自上海将来实业有限公司,海博细菌生化鉴定试剂盒购自青岛海博生物技术有限公司,其他试剂为分析纯。
改良蒙金娜液体培养基:葡萄糖10 g、(NH4)2SO4 0.5 g、MgSO4·7H2O 0.3 g、NaCl 0.3 g、KCl 0.3 g、FeSO4·7H2O 0.03 g、MnSO4·H2O 0.03 g、CaCO3 5 g、酵母提取物1 g,纯水定容至1 000 mL,pH 7.0。
改良蒙金娜无机磷培养基:1 000 mL蒙金娜液体培养基中加入5 g Ca3(PO4)2。
改良蒙金娜固体培养基:1 000 mL蒙金娜液体培养基中加入20 g琼脂。
1.1.2 菌种有效微生物(Effective microorganisms,EM)液体,购自山西天意生物有限公司。
1.2 方法 1.2.1 菌种的分离取样:土样取自浙江省嘉兴市农科院露天菜地土壤。接种:土样用无菌水1:100(W/V)稀释后,以2%体积比接种于蒙金娜液体培养基(同时含0.02%有机磷农药、0.01%毒死蜱、0.01%敌百虫)。培养:30℃、150 r/min的摇床上振荡培养5 d后取培养后菌液以2%体积比接种,重复培养2次。涂布:取培养后的菌液,按10-3-10-7梯度稀释,取200 mL涂布于蒙金娜无机磷固体培养基,30℃培养5 d。划线:筛选具有明显解磷圈的菌落划线分离纯化3次,斜面培养基4℃保存,液体培养基-80℃保存。
1.2.2 有机磷农药降解测定将分离菌株W、Y、B稀释至OD600=1.0,以2%体积比分别接种到含0.01%毒死蜱的蒙金娜液体培养基和含0.01%敌百虫的蒙金娜液体培养基,30℃、150 r /min的摇床上振荡培养72 h,用分光光度法快速测定敌百虫[13]、毒死蜱[14]含量,实验重复3次,分别计算敌百虫、毒死蜱降解率,农药降解率(%)=(培养前浓度-培养后浓度)/培养前浓度×100%。
1.2.3 固态难溶磷溶解测定分离菌株W、Y、B分别以2%体积比接种到蒙金娜无机磷液体培养基,30℃、150 r/min的摇床上振荡培养72 h,用钼锑抗比色法测定可溶无机磷含量,试验重复3次,计算解磷量,解磷量=培养后浓度-培养前浓度,磷净增加量为前后磷浓度差。
1.2.4 分离菌的生化特征分离菌株W、Y、B的主要生化特征用海博细菌生化鉴定试剂盒检测21个典型生化指标。
1.2.5 分子鉴定用分离菌株W、Y、B培养液对16S rDNA序列PCR扩增。培养的菌液用无菌水洗涤、重悬,悬液用沸水浴处理5 min,再冰浴冷却1 min,经10 000 r/min离心后取上清为模板。菌液PCR引物:27F:5'-AGAGTTTGATCMTGGCTCAG-3'和1 492R:5'-GHTACCTTGTTACGACTT-3'。PCR反应体系(50 mL)为:2×PCR mix 25 mL,无菌水22 mL,引物27F(10 mmol/L)和1492R(10 mmol/L)各1 mL,模板1 mL。PCR扩增条件为:94℃预变性4 min;94℃变性30 s,50℃退火30 s,72℃延伸1.5 min,30个循环;72℃最后延伸5 min。反应产物用1%琼脂糖凝胶电泳检测,测序由上海赛默飞世尔科技有限公司完成。
1.2.6 温度、初始pH值对分离菌株增殖的影响将-80℃保存的分离菌株W、Y、B分别接种于LB液体培养基中,30℃、150 r/min复苏培养24 h,至OD600=1.5,再以1%体积比接种于新鲜LB液体培养基中,分别在20、25、30、35、40和45℃下150 r/min培养48 h,试验重复3次,测定菌液OD600值。
将复苏的菌液以1%体积比接种于新鲜LB液体培养基中,培养基的初始pH值分别为3、4、5、6、7、8、9、10、11和30℃、150 r/min培养48 h,实验重复3次,测定菌液OD600值。
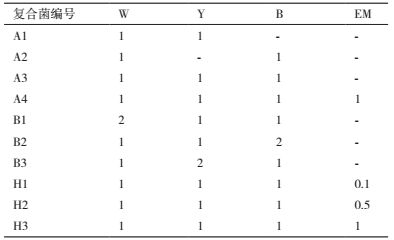
1.2.7 复合菌的解磷效果将W、Y、B 3个分离菌株稀释至OD600=1.0,EM菌(液体)稀释至OD680=1.0。将W、Y、B单一菌株、EM菌及复合菌剂(表 1)分别以2%体积比接种到蒙金娜无机磷培养基,30℃、150 r/min的摇床上振荡培养24 h,用钼锑抗比色法测定无机P含量,实验重复3次,分析解磷量。
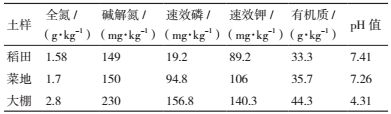
采集浙江省嘉兴市农科院内稻田、露天菜地、大棚耕层土样,参照陈贵等[15]的方法测定土样全氮、碱解氮、速效磷、速效钾、有机质及pH值,样品理化性状见表 2。土样用无菌水按1:100(W/V)稀释,土壤悬液以2%体积比接种于蒙金娜无机磷培养基。试验组将复合菌H2以1%体积比添加到土壤悬液中,30℃、150 r/min的摇床上振荡培养72 h,用钼锑抗比色法测定无机P含量。对照各组土壤悬液中未添加复合菌H2,培养、测定条件与实验组相同。实验重复3次,解磷增量=H2组培养后浓度-相应对照组培养后浓度。
菜地土壤经有机磷农药、无机磷培养基双重筛选后,分离纯化得到白色、黄色及蓝色3个菌株,分别命名为W、Y、B。培养5 d后,10-5稀释的3个菌株均能在蒙金娜无机磷培养基上形成清晰解磷圈(图 1)。

|
| 图 1 W、Y、B分离菌株的形态特征及解磷圈 |
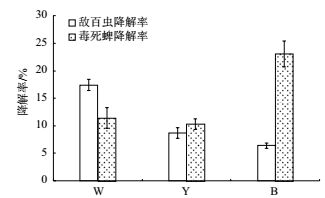
进一步测定了3个分离菌株对有机磷农药的降解能力。敌百虫和毒死蜱降解测定结果(图 2)表明,3个菌株对有机磷农药都有一定的降解能力。其中W菌株对敌百虫的降解能力最强,经过72 h培养,敌百虫浓度由102.05 mg/L降到84.30 mg/L,降解率为17.39%。B菌株对毒死蜱的降解率最强,经过72 h培养,毒死蜱浓度由103.42 mg/L降到79.58 mg/L,降解率为23.06%。
|
| 图 2 分离菌株W、Y、B对敌百虫和毒死蜱的降解 |
解磷测定结果(图 3)表明,3个分离菌株解磷能力稳定,效果显著。可溶无机磷初始浓度由3.05 mg/L先下降,再逐步上升。培养24 h与培养4 h相比,W菌株解磷净增加量较低,为5.28 mg/L,B菌株为6.06 mg/L,Y菌株解磷量较高,为6.75 mg/L。培养72 h与培养24 h相比,W、Y菌株解磷净增加量为87.51 mg/L、86.92 mg/L,B菌株较高,为92.89 mg/L,与初始相比,提高了96.31 mg/L。

|
| 图 3 W、Y、B菌株对无机磷的溶解能力测定 |
利用海博细菌生化鉴定试剂盒对W、Y、B三个分离菌株的21个典型生化指标进行测定,结果(表 3)表明,3个株菌非肠道微生物,偏好氨基酸、有机酸。
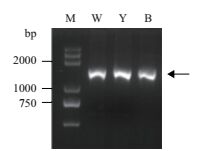
经菌液PCR扩增后,分离菌株W、Y、B均扩增得到1 500 bp左右的条带(图 4)。测序后,经NCBI数据库比对表明,W为皮氏罗尔斯顿菌(Ralstonia pickettii),相似度99%,Y为栖稻假单胞菌(Pseudomonas oryzihabitans),相似度100%,B为油菜假单胞菌(Pseudomonas brassicacearum),相似度100%。
|
| 图 4 分离菌株W、Y、B的16S rRNA PCR扩增 M:DL2000 DNA分子标记;W:W菌株PCR产物;Y:Y菌株PCR产物;B:B菌株PCR产物 |
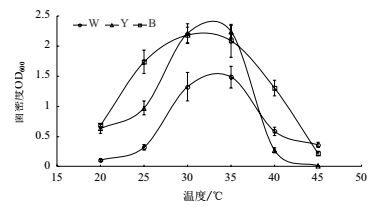
不同温度下W、Y、B菌体增殖变化情况如图 5。W及Y菌株的最适培养温度为35℃,培养24 h后,OD600分别达到1.49及2.24;B菌株的最适培养温度为30℃,培养24 h后,OD600达到2.18。
|
| 图 5 温度对分离菌株W、Y、B生长的影响 |
初始pH是影响菌株生长的化学因子,不同初始pH下菌株W、Y、B生长变化如图 6。结果表明,3个菌株培养的最适初始pH值均为7-8,培养24 h后,W、Y、B 3个菌株的OD600分别达到1.83、2.33及2.50。初始pH低于5或高于10,3个菌株生长明显减弱。

|
| 图 6 初始pH值对菌种增殖的影响 |
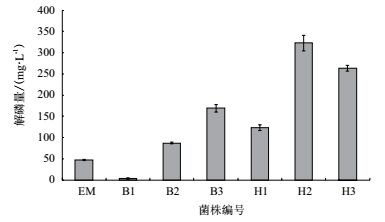
单一菌株(图 3)与复合菌株(表 1)解磷试验结果(图 7)表明,24 h解磷效果复合菌株优于单一菌株。培养24 h后,单一菌株中Y菌株解磷量较高,为6.75 mg/L;双菌株复合以W、Y菌株混合解磷效果最好,解磷量为5.67 mg/L;单菌与双菌解磷量差异较小,但W、Y、B 3菌株复合菌解磷量高于单、双菌株,达到17.40 mg/L;W、Y、B3菌株与EM混合后,解磷量达到119.46 mg/L。复合菌较单菌株解磷能力强,可能与复合菌内菌种间互利作用有关。
多菌株不同比例(表 1)解磷实验(图 8)表明,适当增加W、Y、B复合菌中B菌株的比例,解磷量由3.54 mg/L上升到169.13 mg/L。以适当比例加入EM,解磷量由123.18 mg/L上升到322.64 mg/L。EM、W+Y+B复合菌、W+Y+B+EM复合菌之间相比较,解磷量分别能达到46.91 mg/L、169.13 mg/L、322.64 mg/L,菌种越丰富、解磷量越高。
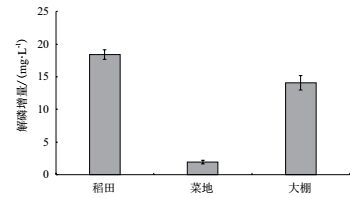
2.8 复合菌的土壤解磷效果分析稻田土、露天菜地、大棚土壤悬液经H2处理后,可溶无机磷浓度比未添加复合菌的对照组均有一定提升(图 9)。培养液初始磷浓度为3.61 mg/L,处理组中露天菜地组解磷量比对照提升了1.96 mg/L,效果较弱,可能该土壤已具有类似解磷菌系;水稻田、大棚组比对照解磷量的提升分别为18.38 mg/L、14.08 mg/L,效果显著,可能受单一施肥及封闭条件影响,水稻田、大棚土壤中解磷类菌系结构简单,解磷能力弱。
|
| 图 9 复合菌对稻田、露天菜地、大棚土壤解磷效果 |
本研究从土壤中分离到3个有机磷降解菌株,鉴定结果表明,它们分别为皮氏罗尔斯顿菌、栖稻假单胞菌、油菜假单胞菌。3个菌株都是葡萄糖非发酵革兰氏阴性杆菌,条件致病,人的感染较少见[16]。皮氏罗尔斯顿菌属于罗尔斯顿菌属,耐贫营养环境,能修复受污染的环境。冷守琴等[17]发现1株降解氯苯的皮氏罗尔斯顿菌,在适宜条件下,3 d内对220 mg/L的氯苯去除率可达99%。Ryan等[18]综述了该菌对多种工业污染物如甲苯和三氯乙烯等的修复能力。栖稻假单胞菌属于恶臭假单胞菌属,道能增强纤维素水解酶的活性[19]。油菜假单胞菌属于假单胞菌属,是植物防病和促生菌,它被报道能拮抗棉花黄萎病菌、恶疫霉菌、番茄细菌性溃疡病菌亚种、果胶杆菌等植物病菌[20-22]。3个菌种对环境修复和植物促生都有各自独特的功能,以此为核心构建的复合微生物将继承这些优势。
有机磷农药毒死蜱、敌百虫的降解实验表明,本研究获得的3个菌株都有耐受性,并具有一定的有机磷农药降解能力。其中,W菌株对敌百虫的降解能力最强,B菌株对毒死蜱的降解率最强,降解能力在20%左右,比报道的专一降解有机磷农药的菌种较低。一方面降解有机磷农药可能需要多种菌种参与,而菌株的纯化过程破坏了菌种之间的互作关系;另一方面本研究分离的菌种兼具修复污染和植物促生两方面功能,单一降解能力较其他菌种弱。这种不足可以通过转基因的方式定向改良。张扬等[9]发现皮氏罗尔斯顿菌能降解三氯吡啶醇(毒死蜱降解的中间产物),但不能有效地降解毒死蜱,他通过转基因构建了能完全矿化毒死蜱的工程菌。有机磷农药的降解需要一系列降解酶的参与,这些酶在自然环境下可能分布在不同的微生物体内,可以通过转基因技术把这系列基因聚合在一起,令菌株具有完全的矿化多种农药的能力,提高环境微生物技术的适用性与稳定性
纯化后的菌株W、Y、B解磷实验表明,3个菌株可以单独溶解固态难溶磷,而且解磷效果稳定,其中4 h可溶无机磷浓度较初始值降低,解磷量 < 0,可能培养初期菌种的增殖消耗了培养液中少量可溶磷。溶解Ca3(PO4)2实验中,W、Y、B处理组的可溶无机磷浓度上升后,其培养液pH值为3-4(初始pH7),推测其分泌的有机酸起到了溶解固态无效磷的作用。但在中性LB中培养后,其pH仍为中性,推测产酸酶为诱导酶,低浓度磷是其诱导因子。多个研究显示解磷菌溶磷能力与pH之间相关性仍存在争议[23-27],本研究发现两者之间存在一定相关性。自然环境中解磷细菌可能存在多种溶磷机制,可以通过产酸溶解固态磷,也可能通过其他途径。
EM菌是由多种微生物组成的复合菌剂,包含酵母菌、乳酸菌、光合细菌、放线菌等,具有修复土壤、净化水质、促进植物生长等功能[7, 28]。本研究发现,EM也有一定的解磷能力,与W、Y、B菌株复配后,溶磷效果显著提升,当EM在复合菌中的比例适宜时,能进一步提升整体解磷效果。侯佳奇等[29]通过复配菌株,各个菌株间通过相互促进,协同共生效果最佳,显著提高了解磷量。适当提高复合菌中微生物种类,可促进菌间互作,有利于核心菌群发挥功能。
由W、Y、B、EM组成的复合菌剂与水稻田、露天菜地、大棚的土壤悬液混合后,对土壤中磷的溶解促进效果不同。菌剂与水稻田、大棚土壤混合后促进效果最好,可能这类土壤中缺乏溶磷微生物,添加复合菌剂后,促进效果显著。而露天菜地中溶磷微生物可能较丰富,添加复合菌剂后促进效果不明显。这表明复合菌剂对不同土壤的溶磷促进作用与土壤自带的微生物有关。添加的菌肥与环境土著微生物互作良好,将促进土壤肥力;互作较弱甚至拮抗,将无法提升肥力,甚至降低土壤活性。微生物菌肥的施用,在测土配方的基础上,再根据土壤自身菌群情况下选择,能获得更好的预期效果。
4 结论本研究从土壤中分离到3个有机磷降解菌株,并证实其具有一定的有机磷农药降解能力,对无机磷溶解效果较强,构建的复合菌剂对土壤解磷的促进效果显著。
| [1] | 董秀金. 区域农业环境与蔬菜质量安全风险评价[D]. 杭州: 浙江大学, 2011. |
| [2] | 孙元设. 微囊藻毒素与原发性肝癌的关系研究[D]. 福州: 福建医科大学, 2011. |
| [3] | 熊彩珍, 顾立明. 中秋蚕发生大面积农药中毒的思考. 中国蚕业, 2007, 28(2): 54–55. |
| [4] | 杨林章, 施卫明, 薛利红, 等. 农村面源污染治理的"4R"理论与工程实践——总体思路与"4R"治理技术. 农业环境科学学报, 2013(1): 1–8. DOI:10.11654/jaes.2013.01.001 |
| [5] | 李白, 李军. 微生物技术在防治农业面源水污染中的研究. 生物技术通报, 2015(10): 99–104. |
| [6] | 于涛, 叶鑫, 张海楼. 保护地蔬菜重金属污染微生物修复的研究. 安徽农业科学, 2013, 41(3): 1065–1066. |
| [7] | 刘春法, 丁学峰, 丁哲利, 等. EM菌联合陆生植物对尾水的净化效应. 中国给水排水, 2013, 29(18): 130–133. |
| [8] | 万田英, 尹亚琳, 华玉妹, 等. 光合细菌投加量对湖泊污染修复的作用效应. 环境工程, 2014(8): 29–32. |
| [9] | 张扬, 王飞, 黄彦, 等. 罗尔斯顿菌(Ralstonia sp.)T6对三氯吡啶醇污染土壤的修复及能完全矿化毒死蜱工程菌株的构建. 生态与农村环境学报, 2014(6): 761–767. |
| [10] | 张闻, 陈贯虹, 高永超, 等. 石油和重金属污染土壤的微生物修复研究进展. 环境科学与技术, 2012(S2): 174–181. |
| [11] | 段秀梅, 高晓蓉, 吕军, 等. 两株土壤分离菌的解磷能力及对玉米的促生作用. 中国土壤与肥料, 2010(2): 79–85. |
| [12] | 张瑞福, 颜春荣, 张楠, 等. 微生物肥料研究及其在耕地质量提升中的应用前景. 中国农业科技导报, 2013, 15(5): 8–16. |
| [13] | 周正义, 印天寿, 唐玉华. 催化光度法测定痕量敌百虫. 分析化学, 1996(10): 1190–1192. |
| [14] | 段海明, 王开运, 王冕, 等. 蜡状芽孢杆菌HY-1降解甲基对硫磷和毒死蜱的影响因素研究. 农业环境科学学报, 2010(3): 437–443. |
| [15] | 陈贵, 张红梅, 沈亚强, 等. 绿肥和小麦秸秆与化肥配施对水稻生长和青紫泥土壤肥力的影响. 浙江农业学报, 2015, 27(10): 1797–1801. DOI:10.3969/j.issn.1004-1524.2015.10.20 |
| [16] | 李金钟, 李中华, 刘利平. 罗尔斯顿菌属和亲铜菌属的研究进展. 国际检验医学杂志, 2008(5): 437–439. |
| [17] | 冷守琴, 魏芳, 张丽丽, 等. 一株氯苯降解新菌株的分离鉴定及其降解特性研究. 环境科学与技术, 2011(2): 6–11. |
| [18] | Ryan MP, Pembroke JT, Adley CC. Ralstonia pickettii in environmental biotechnology:potential and applications. J Appl Microbiol, 2007, 103 (4): 754–764. DOI:10.1111/jam.2007.103.issue-4 |
| [19] | Qin YM, Tao H, Liu YY, et al. A novel non-hydrolytic protein from Pseudomonas oryzihabitans enhances the enzymatic hydrolysis of cellulose. J Biotechnol, 2013, 168 (1): 24–31. DOI:10.1016/j.jbiotec.2013.07.028 |
| [20] | Khayi S, Raoul DEY, Mondy S, et al. Draft Genome Sequences of the Three Pectobacterium-Antagonistic Bacteria Pseudomonas brassicacearum PP1-210F and PA1G7 and Bacillus simplex BA2H3. Genome Announc, 2015, 3 (1): e01497–14. |
| [21] | Novinscak A, Gadkar VJ, Joly DL, et al. Complete Genome Sequence of Pseudomonas brassicacearum LBUM300, a Disease-Suppressive Bacterium with Antagonistic Activity toward Fungal, Oomycete, and Bacterial Plant Pathogens. Genome Announc, 2016, 4 (1): e01623–15. |
| [22] | Zhou T, Chen D, Li C, et al. Isolation and characterization of Pseudomonas brassicacearum J12 as an antagonist against Ralstonia solanacearum and identification of its antimicrobial components. Microbiol Res, 2012, 167 (7): 388–394. DOI:10.1016/j.micres.2012.01.003 |
| [23] | 李振东, 陈秀蓉, 杨成德, 等. 乳白香青内生解磷菌的筛选鉴定及解磷特性研究. 草业学报, 2013, 22(6): 150–158. DOI:10.11686/cyxb20130619 |
| [24] | Thomas GV, Shantaram MV, Saraswathy N. Occurrence and activity of phosphate-solubilizing fungi from coconut plantation soils. Plant and Soil, 1985, 87 (3): 357–364. DOI:10.1007/BF02181903 |
| [25] | Asea PEA, Kucey RMN, Stewart JWB. Inorganic phosphate solubilization by two Penicillium species in solution culture and soil. Soil Biology & Biochemistry, 1988, 20 (4): 459–464. |
| [26] | Paul NB, Rao WVBS. Phosphate-dissolving bacteria in the rhizosphere of some cultivated legumes. Plant and Soil, 1971, 35 (1-3): 127–132. DOI:10.1007/BF01372637 |
| [27] | 王继雯, 谢宝恩, 甄静, 等. 一株无机磷细菌的分离、鉴定及其溶磷能力分析. 河南科学, 2011(3): 293–296. |
| [28] | 荆世杰. 微波、臭氧和EM菌处理对温室土壤健康和甜瓜生产的影响[D]. 兰州: 甘肃农业大学, 2007. |
| [29] | 侯佳奇, 李鸣晓, 贾璇, 等. 复合菌剂解无机磷条件优化研究. 农业环境科学学报, 2013(2): 385–392. |