2. 山东佐田氏生物科技有限公司,济南 250000
2. Shandong Zuotianshi Biotechnology Company Limited, Jinan 250000
水稻是我国重要的谷物之一,目前我国播种面积约为0.28×108 hm2,在粮食作物中居第一位,主要在亚洲和非洲的热带和亚热带地区广泛种植。然而,各种水稻病害的不断发生,造成水稻质量下降、产量降低。其中,最常见且危害最严重的真菌性病害为水稻恶苗病、水稻稻瘟病、水稻纹枯病。水稻恶苗病又称徒长病,是串珠镰刀菌(Fusarium moniliforme)侵染引起的世界性水稻病害,中国各稻区均有发生。病谷粒播后常不发芽或不能出土,致使水稻大面积减产、质量大幅度下降,造成了巨大的经济损失[1, 2]。
目前控制水稻恶苗病的主要方法仍以化学杀菌剂为主,但由于化学杀菌剂容易出现抗药性和药物残留,不仅污染环境,还严重地威胁人体健康[3]。随着人们对无公害食品需求的日益增加以及对环境保护的日益关注,生物防治成为了人们控制植物病害的理想途径[4, 5],筛选出生物活性高、抗菌谱广的菌株具有重要的意义。目前国内外对番茄疫霉根腐病[6]、番茄灰霉病[7]、黄瓜枯萎病[8]等植物病害的生物防治研究已经取得了较大的进展,对水稻纹枯病生物防治的报道较多[9-12],但对水稻恶苗病的生物防治较少[13-15]。本研究从水稻的根际土壤中筛选出一株对水稻恶苗病菌有较强拮抗作用的菌株SH15,对其进行生理生化、16S rDNA序列鉴定,并对其抗菌谱及对水稻恶苗病的防治效果进行研究,以期为抗病性生物肥料的生产提供新的菌种资源。
1 材料与方法 1.1 材料 1.1.1 供试土样及水稻供试土样采自山东省临沂河东区水稻种植区发病严重的地块,选择健康植株根系部的土壤。供试水稻为松粳12号。
1.1.2 供试菌株和培养基供试病原菌为水稻恶苗病菌(Fusarium moniliforme)、层出镰孢菌(Fusarium proliferatum)、棉花枯萎病菌(Fusarium oxysporum)、辣椒疫病菌(Phytophthora capsici)、棉花黄萎病(Verticillium alboatrum)黄瓜黑斑病菌(Alternaria cucumerina),均为本实验保存。
NA培养基:牛肉膏3.0 g、蛋白胨10.0 g、NaCl 5.0 g、琼脂20 g,蒸馏水1 000 mL,pH 7.2,121℃高压灭菌20 min。
LB培养基:蛋白胨10.0 g、酵母浸粉5.0 g、NaCl 10.0 g,蒸馏水1 000 mL,pH7.0,121℃高压灭菌20 min。
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g,蒸馏水1 000 mL,pH值自然,121℃高压灭菌20 min。
1.2 方法 1.2.1 土样采集和处理从临沂河东区水稻种植区发病严重的地块,选择健康植株将其挖出,用力抖落附着的土壤,最后以无菌刮刀刮下的土壤为样品,用保鲜袋保存。称取土样1 g加入到99 mL无菌水中(装有若干玻璃珠),30℃、180 r/min振荡30 min,静置后获得土壤悬液。
1.2.2 拮抗菌株SH15的筛选将土壤悬液稀释成10-5、10-6、10-7浓度,吸取不同稀释度的土壤悬液100 μL涂布于NA培养基上,置于28℃培养48 h,挑取颜色、形态等不同的细菌单菌落并纯化、保存。采用平板对峙法测定分离到的细菌对水稻恶苗病菌的抑菌活性。将水稻恶苗病菌在PDA平板上活化,用打孔器在菌落边缘打取菌块(直径5 mm),接种到PDA平板中央。培养3 d后,在距离水稻恶苗病菌块2 cm处的4个对接点接种待测细菌,28℃培养,10 d后观察抑菌结果,测定抑菌圈直径,其中:抑菌圈直径= 2×(对照菌落半径-处理菌落直径)。每个处理设3次重复。
1.2.3 拮抗菌株SH15的鉴定(1)形态学和生理生化鉴定:将筛选到的SH15菌株,参照《常见细菌系统鉴定手册》进行菌落形态观察、显微镜形态观察、革兰氏染色、芽孢染色以及厌氧生长试验、接触酶试验、氧化酶实验、硝酸还原试验、淀粉水解试验、硝酸盐还原试验、V-P试验、吲哚试验等生理生化指标测定。
(2)分子生物学鉴定:提取拮抗菌株SH15的基因组DNA,所用试剂盒为上海生工生物工程股份有限公司生产,按照说明书进行。PCR扩增16S rDNA基因采用通用引物,正向引物为:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物为:5'-ACGGCTACCTTGTTACGACT-3'PCR。反应体系为:TaKaRa Taq(5 U/μL)0.25 μL,10×PCR Buffer(Mg2+ Free)5 μL,MgCl2(25 mmol/L)3 μL,dNTP Mixture(各2.5 mmol/L)4 μL,模板DNA 1 μL,两种引物各1 μL,双蒸水34.75 μL。PCR反应条件为:96℃ 5 min,94℃ 1 min,56℃ 1 min,72℃ 1 min,30个循环;72℃ 5 min,-20℃保存。所得到的样品序列送由上海生工生物工程股份有限公司进行测序,利用NCBI进行blast分析,同现有细菌序列作比对。所用测序仪器为ABI-PRISM3730,测序试剂为BigDyeterminator v3.1。利用Mega5.2软件绘制系统进化树,根据菌株间的亲缘关系确定所选菌株SH15的种属。
1.2.4 拮抗菌株SH15的抑菌谱实验拮抗菌株SH15对各供试病菌的拮抗作用均采用平板对峙法。各实验重复3次。按1.2.2中方法进行抑菌试验,拮抗效果以抑菌圈直径为指标。抑菌圈直径= 2×(对照菌落半径-处理菌落直径)。
1.2.5 拮抗菌株SH15发酵液对水稻恶苗病菌菌丝形态的影响将水稻恶苗病菌在PDA培养基上接种培养10 d后,用打孔器打取直径5 mm的菌块置于PDA培养基的无菌培养皿中,28℃培养5 d。将培养好的水稻恶苗病菌菌块用无菌发酵液处理24 h后,以无菌水处理为对照,挑取菌丝在光学显微镜下观察其形态,每个处理重复3次。
1.2.6 水稻盆栽实验将拮抗细菌SH15接种于LB培养基中,于30℃、200 r/min震荡培养48 h,然后采用平板培养法测定有效活菌浓度,并将其调整至1×107 cfu/mL,即为SH15菌剂,4℃保存备用。将水稻恶苗病菌接种于PDA平板中,28℃培养10 d,长满菌丝后制成孢子悬浮液,孢子浓度为1×107 cfu/mL,即为水稻恶苗病菌菌剂,取健康土壤按表 1进行盆栽实验,水稻恶苗病菌菌剂、SH15菌剂及50%多菌灵可湿性粉剂(施用量750-900 g/hm2兑水500-600 kg后喷施)在水稻疏苗后喷施,先喷水稻恶苗病菌菌剂,2 d后,喷施SH15菌剂或50%多菌灵可湿性粉剂。水稻苗株高至5 cm时进行疏苗,每盆(200 g土)保留5株,每个处理10盆,重复3次。按常规方式进行管理,观察记录发病株数和相对病斑高度,并计算病级、病情指数和防治效果。病害分级标准采用文献[9]的方法,病级、发病率、病情指数及相对防效按下述公式计算。


实验数据分析采用统计软件SPSS 22.0,处理间的差异显著性分析采用Duncan氏新复极差法。
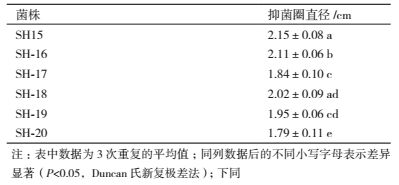
2 结果 2.1 拮抗菌株的筛选结果从健康水稻根际土壤中共分离纯化75株细菌,采用平板对峙发筛选出6株对水稻恶苗病菌有抑菌活性的拮抗菌(表 2),其中菌株SH15抑菌活性最强,菌株SH21无抑菌活性,结果见图 1。

|
| 图 1 不同菌株对水稻恶苗病菌的拮抗作用 |
拮抗菌株SH15在NA固体培养基上培养48 h,菌落呈乳白色,圆形、凸起、有光泽、表面光滑、边缘整齐,具粘性不易挑取,如图 2。镜检菌体呈杆状、革兰氏染色为阳性,芽孢中生、椭圆形。其他生理生化实验结果见表 3。

|
| 图 2 菌株SH15在NA培养基上的菌落 |
以菌株SH15基因组DNA为模板,利用16S rDNA细菌通用引物进行PCR扩增,经琼脂糖凝胶电泳检测到约1 500 bp的条带(图 3),测序结果为1 503 bp,将序列通过NCBI的Blast程序与数据库中的16S rDNA序列进行比对,发现其与多粘类芽孢杆菌16S rDNA序列的相似性高达99%,初步确定拮抗菌株SH15为多粘类芽孢杆菌(Paenibacillus polymyxa)。将菌株SH15的16S rDNA序列利用MEGA5.0软件进行聚类分析,构建进化树。
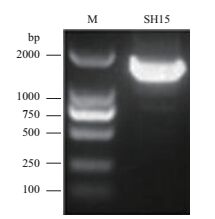
|
| 图 3 菌株SH15 16S rDNA PCR扩增产物电泳图 |
由图 4可知,综合菌体形态、生理生化实验结果以及16S rDNA序列分析鉴定菌株SH15为多粘类芽孢杆菌。

|
| 图 4 菌株SH15的16S rDNA系统进化树 |
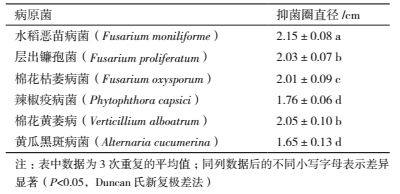
为了研究拮抗菌株SH15的生防潜力,采用平板对峙法对其抑菌谱进行了测定。由表 4可知,拮抗菌株SH15对水稻恶苗病菌抑制效果较好,对层出镰孢菌、棉花枯萎病菌、棉花黄萎病菌抑制次之,对辣椒疫病菌、黄瓜黑斑病菌拮抗效果较差。
由图 5可知,无菌水处理的水稻恶苗病菌菌丝形态饱满,细胞壁光滑,菌丝能正常生长并扩展。经拮抗菌株SH15无菌发酵液处理后,水稻恶苗病菌菌丝形态发生明显变化,菌丝分支增多,菌丝出现打结点,生长缓慢。
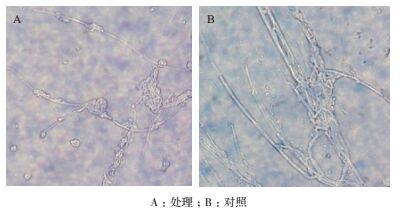
|
| 图 5 菌株发酵液对水稻恶苗病菌菌丝的影响 |
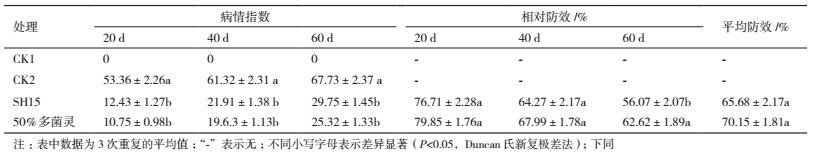
水稻盆栽实验结果如表 5和图 6所示。实验调查期间,CK1发病指数为零,而CK2发病指数高达53.36%-67.73%,说明实验所采用水稻恶苗病原菌对受试水稻具有较强的致病性。与CK2相比,接种SH15菌剂的处理发病指数仅为12.43%-29.75%,平均相对防效高达65.68%,与50%多菌灵可湿性粉剂相比,防效差异不明显,表明菌株SH15对水稻恶苗病具有较好的防治效果。盆栽实验还表明,不同栽培时期,菌株SH15对水稻恶苗病的相对防效差异显著,栽培前期防效较高,随着栽培期的延长,防效有所下降。

|
| 图 6 不同处理对水稻恶苗病的防治效果 |
多粘类芽孢杆菌作为芽孢杆菌属的重要成员,其在生物防控方面的潜能也逐渐被发掘。赵德立等[16]研究发现多粘类芽孢杆菌JW-725对柑橘青霉的防治取得了良好的效果;马桂珍等[17]研究表明多粘类芽孢杆菌L1-9拮抗番茄早疫病菌,抑菌率高达79.28%;范磊[18]研究发现多粘类芽孢杆菌HY96-2对西瓜枯萎病防治效果显著;马桂珍等[19]研究表明海洋多粘类芽孢杆菌L1-9对小麦赤霉病的防治有明显的效果;郭芳芳等[20]分离得到的多粘类芽孢杆菌CF05对番茄猝倒病的防治效果显著;而本文研究表明多粘类芽孢杆菌SH15对水稻恶苗病防治效果良好。因此,不同的多粘类芽孢杆菌对不同的病菌防治效果不同。为此,开发多粘类芽孢杆菌菌剂时,应着重说明该菌剂针对病害的种类。
多粘类芽孢杆菌在生长过程中,可以产生肽类、蛋白质类、酚类等多种抗菌物质。其中,Kavitha等[21]发现多粘类芽孢杆菌VLB16产生的蛋白能抑制稻瘟病菌和稻纹枯病的生长,其分子量为37 kD,并且耐高温;陈海英等[22]从多粘类芽孢杆菌CP7代谢产物中分离到3种抗革兰氏阴性菌的小分子多肽,其中组分C1为多粘菌素E1;范磊等[23]从多粘类芽孢杆菌HY96-2发酵液中分离出一个抗真菌活性化合物-Fusaricidin A,该物质对西瓜枯萎病菌、水稻纹枯病菌、灰霉病菌等多种病菌均有较好的抑制作用。本文中多粘类芽孢杆菌SH15发酵液对水稻恶苗病菌菌丝抑制明显,表明SH15发酵液中也含有抗菌物质,为此,抗菌物质的明确有待进一步研究。
水稻恶苗病是水稻常见的病害,目前,主要以化学药剂进行防治,李鹏等[24]利用25%氰烯菌酯悬浮剂进行水稻恶苗病的田间防治,黄贤夫等[25]采用甲霜·种菌唑拌(浸)种预防水稻恶苗病,都取得良好的效果,但长期施用化学药剂,造成了严重的土壤污染、环境污染。而本研究筛选到的多粘类芽孢杆菌SH15对水稻恶苗病盆栽平均防效高达65.68%,且多粘类芽孢杆菌对人或动植物无致病性,对土地和环境无污染,符合水稻可持续发展的需要。
4 结论本实验采用平板稀释法从从水稻根际土壤中,分离得到75株细菌,经平板对峙法筛选到6株对水稻恶苗病菌有拮抗作用的菌株,尤其有一株对水稻恶苗病菌具有较强拮抗作用的菌株SH15,经鉴定为多粘类芽孢杆菌;菌株SH15无菌发酵液对水稻恶苗病菌菌丝处理后,发现有显著抑制作用;菌株SH15对水稻恶苗病菌、层出镰孢菌、棉花枯萎病菌、辣椒疫病菌、棉花黄萎病、黄瓜黑斑病菌均有一定的抑菌活性,表明SH15抗菌谱广。水稻盆栽实验表明,接种多粘类芽孢杆菌SH15可显著降水稻恶苗病的发病指数,平均防效高达65.68%,进而表明,多粘类芽孢杆菌SH15在水稻恶苗病的生物防治方面具有一定的应用价值。
| [1] | 方兴洲, 陈莉, 产祝龙, 等. 水稻恶苗病与浸种、催芽和播种等因子的关系研究. 热带作物学报, 2012, 33(6): 1107–1110. |
| [2] | 张淑梅, 沙长青, 赵晓宇, 等. 一株抗真菌内生多粘芽孢杆菌的分离鉴定及对水稻恶苗病菌的抑制作用. 中国生物工程杂志, 2010, 30(2): 84–88. |
| [3] | 吴辉, 潘梦武, 高易宏, 等. 辣椒疫病生防菌的筛选、鉴定及其抑菌机理初探. 湖北农业科学, 2015, 54(7): 1596–1599. |
| [4] | Hojin R, Hoon P, Dong SS, et al. Biological control of Colletotrichum panacicola on Panax ginseng by Bacillus subtilis HK-CSM-1. Journal of Ginseng Research, 2009 (10): 112–114. |
| [5] | Jiang CM, Shi JL, Liu YL, et al. Inhibition of Aspergillus carbonarius and fungal contamination in table grapes using Baillus subtilis. Food Control, 2014, 35 (1): 41–48. DOI:10.1016/j.foodcont.2013.06.054 |
| [6] | 冯志珍, 李金玲, 陈太春, 等. 番茄疫霉根腐病拮抗细菌FC12-05的筛选鉴定及其抑菌活性初探. 西北农林科技大学学报:自然科学版, 2012, 40(4): 107–114. |
| [7] | 邓振山, 马娜娜, 徐文梅, 等. 大蒜鳞茎中抗番茄灰霉病内生菌的筛选及其防治效果. 西北农林科技大学学报:自然科学版, 2012, 40(5): 50–56. |
| [8] | 韦巧婕, 郑新艳, 邓开英, 等. 黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效. 南京农业大学学报, 2013, 36(1): 40–46. DOI:10.7685/j.issn.1000-2030.2013.01.008 |
| [9] | 张德涛, 彭正凯, 曹琦琦, 等. 3株拮抗菌在水稻植株上的定殖能力及对纹枯病的防效. 西北农林科技大学学报:自然科学版, 2012(2): 97–102. |
| [10] | 陈思宇, 陈志谊, 张荣胜. 水稻纹枯病菌拮抗细菌的筛选及鉴定. 植物保护学报, 2013(3): 211–218. |
| [11] | 黄河, 鄢凯舟, 林元山, 等. 水稻纹枯病拮抗细菌的筛选·鉴定及其活性成分的发酵制备. 安徽农业科学, 2014, 25: 8584–8586. DOI:10.3969/j.issn.0517-6611.2014.25.041 |
| [12] | 陈丹, 叶波, 刘燕娟, 等. 水稻纹枯病菌拮抗菌CZB40的筛选、鉴定及其发酵条件优化. 植物保护, 2015, 05: 46–53. DOI:10.3969/j.issn.0529-1542.2015.04.008 |
| [13] | 田洁萍, 王玉霞, 张淑梅. 解淀粉芽孢杆菌防治水稻恶苗病效果初报. 黑龙江科学, 2010(4): 10–11. |
| [14] | 张淑梅, 沙长青, 赵晓宇, 等. 一株抗真菌内生多粘芽孢杆菌的分离鉴定及对水稻恶苗病菌的抑制作用. 中国生物工程杂志, 2010(2): 84–88. |
| [15] | 赵贞丽, 贾斌, 沈国娟, 等. 水稻恶苗病生防用拮抗细菌分离鉴定及抑菌活性研究. 延边大学农学学报, 2014(1): 22–27. |
| [16] | 赵德立, 曾林子, 李晖, 等. 多粘芽孢杆菌JW-725抗菌活性物质及其发酵条件的初步研究. 植物保护, 2006, 32(1): 47–50. |
| [17] | 马桂珍, 王淑芳, 暴增海, 等. 多粘类芽孢杆菌L1-9菌株对番茄早疫病的抑菌防病作用. 中国蔬菜, 2010(12): 55–59. |
| [18] | 范磊. 多粘类芽孢杆菌HY96-2产Fusaricidins抗真菌物质的分离及抑菌活性的研究[D]. 上海: 华东理工大学, 2012. |
| [19] | 马桂珍, 付泓润, 王淑芳, 等. 海洋多黏类芽孢杆菌L1-9菌株生产抑菌物质发酵条件及其抑菌谱的研究. 食品科学, 2012(19): 231–235. |
| [20] | 郭芳芳, 谢镇, 卢鹏, 等. 一株多粘类芽孢杆菌的鉴定及其生防促生效果初步测定. 中国生物防治学报, 2014(4): 489–496. |
| [21] | Kavitha S, Senthikumar S, Gnanamaickam S, et al. Isolation and partial characterization of antifugal protein from Bacillus polymyxa strain VLB16. Process Biochemistry, 2005, 40 : 3236–3243. DOI:10.1016/j.procbio.2005.03.060 |
| [22] | 陈海英, 廖富蘋, 林健荣. Paenibacillus polymyxa CP7菌抗革兰氏阴性菌活性组分的分离和结构分析. 中国农业科学, 2009, 42(6): 2105–2110. |
| [23] | 范磊, 张道敬, 刘振华, 等. 多粘类芽孢杆菌HY96-2产脂肽类抗真菌物质的研究. 天然产物研究与开发, 2012(6): 729–735. |
| [24] | 李鹏, 穆娟微. 25%氰烯菌酯悬浮剂防治水稻恶苗病的田间药效. 安徽农业科学, 2015, 43(15): 130–131. DOI:10.3969/j.issn.0517-6611.2015.15.047 |
| [25] | 黄贤夫, 陈海波, 李程巧, 等. 甲霜·种菌唑拌(浸)种预防水稻恶苗病的效果. 浙江农业科学, 2016(7): 1009–1010. |