2. 中国科学院微生物研究所微生物生理与代谢工程重点实验室,北京 100101
2. CAS Key Laboratory of Microbial Physiological and Metabolic Engineering, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100010
传统的制革工艺会产生大量污染,制革排放的特色四废分别是:废水、污泥、废气和固体废弃物[1]。其中各类污染的排放以水场部分的传统灰碱法脱毛环节为甚,灰碱毁毛脱毛法脱毛效果好,但被溶解的毛被、表皮与灰碱等污染物占制革废水总污染物的40%。近年来研究的清洁脱毛工艺主要有酶法脱毛[2]、灰碱法基础上的保毛脱毛、有机胺脱毛、过氧化氢氧化脱毛和其他脱毛方法[3]。
中性蛋白酶(Neutral protease)是在中性pH条件下作用于蛋白质肽键的酶类,能将蛋白质水解成氨基酸、多肽以及游离氨基酸,可广泛用于动植物蛋白水解,皮革脱毛、软化,羊毛丝绸脱胶等[4, 5]。蛋白酶法脱毛制革因脱毛条件温和,对真皮中角蛋白水解少,且毛从表皮分离回收,是目前为止最有可能代替灰碱法实现清洁脱毛工业化的方法[6]。1398、2709蛋白酶制剂在20世纪初期曾作为脱毛酶应用在制革工艺中[7],但因其酶系中含有水解皮胶原的胶原蛋白酶,在大规模应用中如工艺控制不严会造成松面、烂皮现象[8];而纯化去除胶原蛋白酶所增加的工艺成本超出了制革厂的负荷,进而限制了蛋白酶制剂在皮革工业中的应用。有研究表明[9-11]枯草芽孢杆菌(Bacillus subtilis S14、Bacillus subtilis P13)及沙福芽孢杆菌(Bacillus safensis LAU13)等菌株发酵生产的角蛋白酶对胶原蛋白水解能力相对较差,但在脱毛工艺中仍需要严格控制酶用量及脱毛时间,否则依旧会损伤成革质量。因此,亟需研制一种理想的脱毛用酶产品。
针对以上蛋白酶制剂在脱毛工艺中应用的局限性,本实验室前期将枯草芽孢杆菌(Bacillus subtilis AS1.398)的中性蛋白酶基因npr重组到宿主菌WB800N中,构建一株脱毛用基因工程菌WB800N/pHT43-npr,该菌株经验证发酵产物中不含有胶原蛋白酶,并初步明确其发酵生产的JW-3蛋白酶脱毛效果优于1398蛋白酶[12],但JW-3蛋白酶能否达到灰碱法对皮块的脱毛效果及其脱毛工艺条件等还未明确。对JW-3蛋白酶的酶学性质进行研究,明确该酶在脱毛环节的各项工艺指标,同时与传统灰碱法对黄牛皮的脱毛效果进行比较评价,为清洁化脱毛制革工艺提供技术支撑。
1 材料与方法 1.1 材料 1.1.1 菌株枯草芽孢杆菌工程菌Bacillus subtilis(WB800N/pHT43-npr),由本研究室与中国科学院微生物研究所共同构建,保藏于中国普通微生物菌种保藏管理中心,CGMCC No.11625。工程菌WB800N/pHT43-npr的发酵液经固液分离获得上清液后,用截流分子量为10 kD的超滤柱除去小分子杂质后即为JW-3蛋白酶,酶活力单位为3 000 U/mL。
1.1.2 试剂胶原蛋白酶Ⅱ(Collagenase Type Ⅱ)购自Gibco公司;1398蛋白酶、Ⅰ-胶原蛋白(Collagen Type Ⅰ)来源于牛腱,购自TSolarbio试剂公司;盐腌黄牛皮购自蠡县留史毛皮市场;其它试剂为国产分析纯。
1.2 方法 1.2.1 蛋白酶的温度稳定性用0.2 mol/L pH7.5磷酸盐缓冲液稀释JW-3蛋白酶液至终浓度为500 U/mL,按照GB/T 23527—2009《蛋白酶制剂》标准,采用Folin-酚法(下同)分别在20、30、40、50、60、70和80℃下孵育0.5、1、2、4和24 h后,检测其残余酶活,得到其他相对酶活,以未保温的酶活性作为100%。
1.2.2 蛋白酶的pH耐受性分别用pH5、6、7、8、9、10的缓冲液稀释JW-3蛋白酶液至终浓度为500 U/mL,在相应的pH缓冲液内孵育0.5、1、2、4和24 h后,检测其残余酶活,得到其他相对酶活,以pH7.5缓冲液孵育处理的酶活性作为100%。
1.2.3 不同金属离子对蛋白酶活力的影响在酶活力为500 U/mL的JW-3蛋白酶液中分别加入终浓度为5 mmol/L的不同金属离子(Mg2+、Ca2+、Zn2+、Mn2+和Fe2+),保持1、3、6和24 h后测定残余酶活性,以无任何添加物下的酶活性作为100%[13]。
1.2.4 螯合剂、不可逆抑制剂、表面活性剂、还原剂、漂白剂对蛋白酶活力的影响在酶活力为500 U/mL的JW-3蛋白酶液中分别加入终浓度为5 mmol/L的螯合剂EDTA(Ethylenediam-inetetraacetic acid)、不可逆抑制剂PMSF(Phenylmethylsulfonyl fluoride)和1%的还原剂β-Me(β-巯基乙醇),表面活性剂SDS(5 mmol/L)、Triton X-100(1%)、Tween20(1%)、Tween80(1%)、洗涤灵(1%)和30%的漂白剂H2O2(1%),保持1、3、6和24 h后测定残余酶活性,以无任何添加物下的酶活性作为100%。
1.2.5 对不同底物的水解特性在2%浓度的I-胶原蛋白溶液中分别加入终浓度为50 U/mL的JW-3蛋白酶、1398蛋白酶、胶原蛋白酶,在30℃条件下酶解过夜后加入0.4 mol/L的三氯乙酸终止反应;离心、取上清在200-400 nm波长区间内测定酶解产物紫外扫描曲线,以底物I-胶原蛋白最后加入的样品作为对照[14]。底物酪蛋白的酶解反应过程同上。
1.2.6 与传统灰碱法原皮脱毛效果对比取冷冻保藏的盐腌黄牛皮加入浸水剂恢复鲜皮状态后用表面活性剂除脂,沿脊背线左右对称取样,将牛皮裁剪约为4 cm×4 cm的正方形小块备用。
酶法脱毛:将酶活力为50 U/mL的JW-3蛋白酶在30℃、液比为1:6、pH范围6-7.5的条件下对上述皮块进行脱毛处理。灰碱法脱毛:取2%的硫化钠和8%的石灰在25℃、液比为1:2.5的条件下对上述皮块进行脱毛处理。待两种方案脱毛结束后,对比脱毛后皮块粒面的显微形态及脱毛后牛毛的质量,最后通过比较脱毛工艺中总氮(TNb)、总固形物(TS)、悬浮固体物(SS)、浴液pH、粒面感官等指标对两种方法脱毛效果进行对比评价。
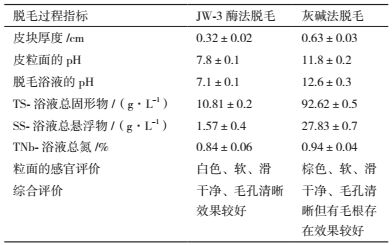
2 结果 2.1 蛋白酶的温度稳定性及pH耐受性制革的脱毛环节采用的是有温有浴脱毛法。灰碱法脱毛只需满足浴液中化学试剂的浓度适宜即可,而酶法脱毛需要控制浴液的温度及酸碱度才能保证酶分子有效的进行催化作用。研究表明酶脱毛全程约3-6 h,为保证在脱毛全程有较高的残余酶活力,本文对酶性质的研究采取定时取样测定至24 h结束,综合时间因素分析各项条件对酶保存活性的影响。
前期实验表明JW-3蛋白酶在50℃时具有最佳的催化活性,但该酶的耐热性能较差。图 1显示,JW-3蛋白酶在30℃及以下温度放置24 h后,酶活保存率在95%以上;但在40℃放置1 h以上时酶活迅速衰减;在70℃放置30 min后酶活性完全丧失。因酶法脱毛工艺受脱毛时间的限制,为保证此酶在全程发挥催化作用,应将酶脱毛的体系温度从传统的38-40℃的范围降低到30-32℃,同时能在一定程度上降低企业的能耗。
|
| 图 1 JW-3蛋白酶在不同温度下的保存稳定性 |
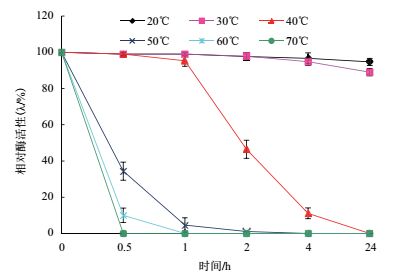
图 2显示,JW-3蛋白酶在pH 6和pH 7的缓冲液孵育下酶活有10%幅度的提升,其中在pH6时酶稳定性表现最佳。在pH5、8和9的条件下保存24 h仍有40%以上残余酶活,且后期衰减趋势不明显;但在pH10及以上缓冲液中保存30 min后,酶活力完全丧失。故在有温有浴酶法脱毛工艺中,脱毛浴液的pH应在中性条件下才能保证在脱毛过程中有较高的残余酶活力。
|
| 图 2 JW-3脱毛酶在不同pH缓冲液中的保存稳定性 |
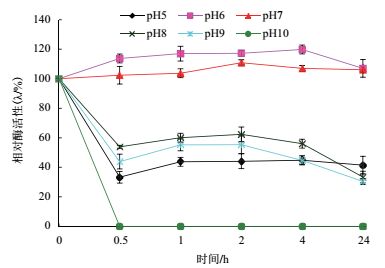
金属离子可作为酶的激活剂、可逆性抑制剂及不可逆性抑制剂,筛选对酶活性有促进作用或是稳定酶分子构象的金属离子具有重要意义。图 3显示,随着保存时间的延长,酶活力因金属离子的加入呈现曲线变化趋势,其中升降趋势均在3 h左右到达高峰,此时Ca2+、Mn2+能显著增加酶活力分别为27%和9%,而Fe2+和Zn2+明显抑制酶活性,Mg2+对酶活性影响不大。Ca2+和Mn2+可作为稳定助剂添加到液体酶制剂中。

|
| 图 3 金属离子对JW-3蛋白酶活性的影响 |
表面活性剂在制革工艺中可以用来乳化和分散脂肪,进而促使酶分子渗透到皮层毛囊完成脱毛过程。图 4显示,JW-3蛋白酶在不同试剂中保存后酶活差异明显,其中在Triton X-100、Tween20、Tween80中保存24 h酶活力有小幅度的上升;SDS几乎完全抑制酶活性;而在洗涤灵中保存3 h内相对稳定。该酶在强氧化剂H2O2中保存6 h,剩余酶活力可达到90%以上;表明JW-3脱毛酶可以协同H2O2应用在氧化脱毛工艺中完成脱毛过程;而还原剂β-巯基乙醇可抑制约30%的酶活性。EDTA为金属蛋白酶抑制剂、PMSF是丝氨酸蛋白酶抑制剂,该酶在EDTA作用下酶活力仅剩5%,而PMSF可抑制约80%的酶活性;说明该酶的活性中心可能有金属离子,且属于丝氨酸蛋白酶家族。

|
| 图 4 化学试剂对JW-3蛋白酶活性的影响 |
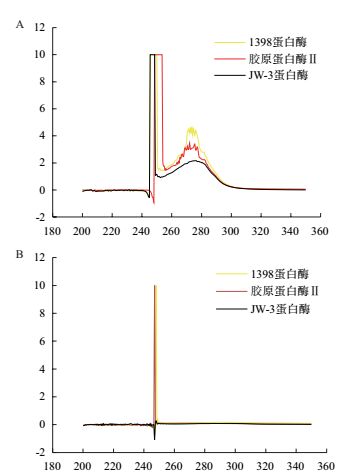
前期研究中明确工程菌株WB800N/pHT43-npr发酵产物中不含有胶原蛋白酶,但其发酵生产的酶液对皮胶原蛋白的水解能力未明确。选取适量同等活力的胶原蛋白酶Ⅱ、1398中性蛋白酶、JW-3蛋白酶,分别酶解底物Ⅰ-胶原蛋白和酪蛋白,酶解产物在200-400 nm波长范围的紫外扫描曲线结果如图 5所示。图 5-A表明,3种蛋白酶可不同程度酶解酪蛋白生成酪氨酸,在275 nm处有最大吸收峰,而在250 nm处酶解产物暂不明确。图 5-B表明,胶原蛋白酶和1398蛋白酶可酶解胶原蛋白,酶解产物在250 nm左右有较高的吸收峰,而JW-3蛋白酶在该波长仅有微弱的吸收峰,表明该酶非特异性水解Ⅰ-胶原蛋白的能力较差。实验所用胶原蛋白来源于牛腱组织,与动物皮的胶原蛋白成分接近,该酶不损伤皮胶原蛋白与1398蛋白酶脱毛相比具有显著的优势。
|
| 图 5 不同底物酶解后的紫外扫描曲线 A:以酪蛋白为底物的酶解曲线;B:以Ⅰ -胶原蛋白为底物的水解曲线 |
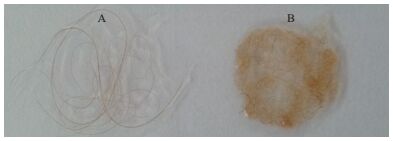
酶法脱毛的机理是蛋白酶水解毛根鞘与毛袋之间的粘蛋白和类粘蛋白,从而使毛从毛孔脱落,如图 6-A所示,JW-3酶法黄牛皮脱毛后,牛毛的外观状态完整;且从显微状态来看,酶法脱毛后黄牛毛根部完整,未见明显损伤(图 7-A)。而灰碱法脱毛的机理是化学试剂溶解毛被和表皮,由图 6-B所示,灰碱法黄牛皮脱毛后,牛毛被分解成弯曲的片段;从显微状态来看,牛毛被分解成不同长度的片段且能明显看出断裂的横断面(图 7-B)。酶法脱毛属于保毛脱毛法,毛发完整脱离皮层,在脱毛工艺中可经滤布过滤回收利用,为JW-3蛋白酶回收制革废弃动物毛发应用在纺织行业开辟了新方向。
|
| 图 6 不同工艺脱毛后的黄牛毛状态观察 A:JW-3酶法脱毛后的黄牛毛;B:灰碱法脱毛后的黄牛毛 |

|
| 图 7 不同工艺脱毛后黄牛毛显微状态观察 A:JW-3酶法脱毛后的黄牛毛;B:灰碱法脱毛后的黄牛毛 |
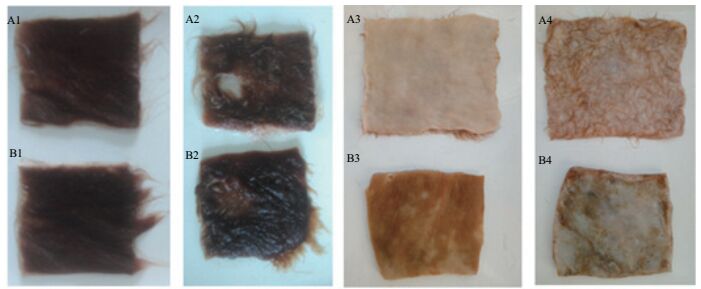
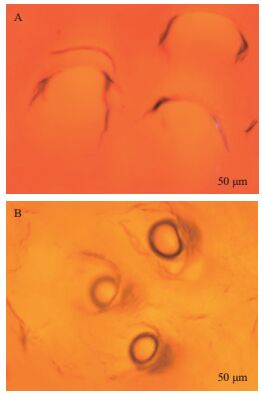
研究表明,1398、2709、166等因酶制剂中胶原蛋白酶的存在,易造成皮粒面损伤及成革松面的现象。经脱毛实验表明JW-3蛋白酶对黄牛皮脱毛后皮粒面光滑、干净,未见小毛的存在,粒面及肉面的颜色均呈现淡粉色(图 8-A3、A4);灰碱法脱毛后毛被被溶解、粒面干净呈现棕褐色,但毛囊周围的褐色细胞杂质未清除干净,肉面因硫化钠的作用呈现淡蓝色,水洗不掉(图 8-B3、B4)。两种工艺脱毛后的皮粒面显微观察见图 9,其中图 9-A中酶脱毛后毛孔清晰,边缘光滑无损伤;而灰碱法脱毛也观察到边缘清晰的毛孔,但毛孔中明显看到毛根的存在。脱毛试验感官结果表明JW-3蛋白酶能够达到灰碱法脱毛干净、粒面光滑的效果,且酶法脱毛能够去除毛根,获得完成动物毛发。
|
| 图 8 不同工艺脱毛黄牛裸皮粒面观察 A:JW-3酶法脱毛后黄牛皮粒面;B:灰碱法脱毛后黄牛皮粒面。1:脱毛前的牛皮;2:脱毛2h后的牛皮;3:脱毛结束后的皮粒面;4:脱毛结束后的皮肉面 |
|
| 图 9 不同工艺脱毛后黄牛裸皮粒面显微观察 A:JW-3酶法脱毛后的皮粒面;B:灰碱法脱毛后的皮粒面 |
由表 1可看出JW-3酶法脱毛浴液及皮块表面的pH均在中性左右,废水中pH指标显著优于灰碱法脱毛;总固含物(TS)与悬浮固体物(SS)是重要的污染指标,而酶法脱毛浴液中的TS及SS指标显著低于灰碱法;总氮(TNb)反应了脱毛的进程,两种工艺浴液中总氮相当,而灰碱法脱毛水平略高,可能是浴液中有少量牛毛水解后的角蛋白的加入。由于硫化钠的加入使灰碱法脱毛皮块膨胀利于后期的剖层,而JW-3酶法脱毛皮块厚度仅为前者的1/2,后期剖层工艺需要加入碱进行膨胀。综合比较两种脱毛工艺,虽感官比较中两种方法脱毛效果略有差异,但均能完成脱毛过程,且酶法脱毛未有烂面情况发生。但酶法脱毛所产生的污染负荷更小且能从毛根处脱毛,获得完整的动物毛发,虽在后期需要碱膨胀后剖层,但综合评价,JW-3酶法脱毛可以成为灰碱法脱毛的清洁化替代工艺。
随着制革业对清洁化生产工艺的需求,酶法脱毛制革因酶制剂来源广泛、易获得、无毒害、不污染环境等优点成为替代传统灰碱法脱毛工艺的首选[15, 16]。目前市场中的脱毛酶如1398中性蛋白酶、2709碱性蛋白酶、角蛋白酶等均可以完成脱毛工艺,但因酶制剂中胶原蛋白酶的存在,需对酶脱毛工艺严格要求,稍有控制差错便会造成皮块烂面;而纯化酶系,祛除胶原蛋白酶的工艺无疑增加使用成本[17],使得酶法脱毛始终不能在制革工艺中规模化推广。
本研究对前文构建工程菌株WB800N/pHT43-npr发酵生产JW-3蛋白酶的性质进行研究,明确该酶与灰碱法脱毛后的皮粒面效果相当,且产生的污染负荷小并可获得完整的动物毛发;同时建立了JW-3蛋白酶的脱毛工艺,并明确了潜在的有利于脱毛的化学助剂。本机构曾研发JW-1、JW-2脱毛酶推广应用至河北的制革区,皆因酶制剂对皮胶原的破坏而中断应用。目前对清洁化脱毛工艺的研究集中在无硫、少硫化学脱毛方法[18],脱毛用酶的研究热度下降,本研究首次报道了工程菌株生产的一种新型蛋白酶用于制革脱毛环节,解决了1398、2709等现有蛋白酶制剂在脱毛工艺的局限性[8],用其替代传统灰碱法脱毛工艺实现清洁化脱毛制革,缓解制革业的重污染现状,也为该酶处理制革中的含毛固体废弃物及纺织行业中动物毛发的获取途径提供了新的思路[19]。但研究发现工程菌株发酵产酶水平较低[20],且液体酶制剂的稳定性差、保质期相对较短,通过基因工程手段提升蛋白酶基因的表达水平及稳定性将更有利于JW-3蛋白酶推广至制革区应用[21]。
4 结论酶学性质试验表明JW-3蛋白酶在30℃、中性pH条件下及化学试剂Ca2+、Mn2+、Triton X-100、Tween20、Tween80中保存稳定性较好。经脱毛应用比较表明JW-3酶法脱毛可以成为替代灰碱法脱毛制革的清洁化生产工艺。
| [1] | Saran S, Mahajan RV, Kaushik R, et al. Enzyme mediated beam house operations of leather industry:a needed step towards greener technology. Journal of Cleaner Production, 2013, 54 (9): 315–322. |
| [2] | Kumar MM, Saranraj P. Commercial production and application of bacterial alkaline protease:an overview. Quaternary Science Reviews, 2015, 3 (34): 1–23. |
| [3] | 张玉红, 刘萌, 但卫华, 等. 4种典型脱毛工艺的对比(续). 中国皮革, 2015, 44(14): 20–23. |
| [4] | Rao MB, Tanksale AM, Ghatge MS, et al. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews, 1998, 62 (3): 597–635. |
| [5] | Aqel H, Al-Quadan F, Yousef TK. A novel neutral protease from thermophilic Bacillus strain HUTBS62. Journal of Bioscience & Biotechnology, 2012, 1 (2): 117–123. |
| [6] | Pandeeti EV, Pitchika GK, Jotshi J, et al. Enzymatic depilation of animal hide:identification of elastase (LasB) from Pseudomonas aeruginosa MCM B-327 as a depilating protease. PLoS One, 2011, 6 (2): e16742. DOI:10.1371/journal.pone.0016742 |
| [7] | Raju AA, Chandrababu NK, Samivelu N, et al. Eco-friendly enzymatic dehairing using extracellular proteases from a Bacillus species isolate. Journal of the American Leather Chemists Association, 1996, 91 (5): 115–119. |
| [8] | 于士强, 桂俊鸿, 王海燕. 短小芽孢杆菌胞外蛋白质组双向电泳分析及碱性胁迫下胞外差异蛋白鉴定. 应用与环境生物学报, 2014, 20(2): 217–222. |
| [9] | Macedo AJ, da Silva WO, Gava R, et al. Novel keratinase from Bacillus subtilis S14 exhibiting remarkable dehairing capabilities. Applied and Environmental Microbiology, 2005, 71 (1): 594–596. DOI:10.1128/AEM.71.1.594-596.2005 |
| [10] | Lateef A, Adelere IA, Gueguim-Kana EB. Bacillus safensis LAU 13:a new source of keratinase and its multi-functional biocatalytic applications. Biotechnology & Biotechnological Equipment, 2014, 29 (1): 54–63. |
| [11] | Pillai P, Archana G. Hide depilation and feather disintegration studies with keratinolytic serine protease from a novel Bacillus subtilis isolate. Applied Microbiology and Biotechnology, 2008, 78 (4): 643–650. DOI:10.1007/s00253-008-1355-z |
| [12] | 郑翔, 胡美荣, 刘春卯, 等. 一株皮革脱毛用工程菌的构建及酶法脱毛应用. 中国皮革, 2016, 45(10): 21–26. |
| [13] | Jabbar A, Rashid MH, Javed MR, et al. Kinetics and thermodynamics of a novel endoglucanase(CMCase)from Gymnoascella citrina produced under solid-state condition. Journal of Industrial Microbiology & Biotechnology, 2008, 35 (6): 515–524. |
| [14] | Watanabe K. Collagenolytic proteases from bacteria. Applied Microbiology and Biotechnology, 2004, 63 (5): 520–526. DOI:10.1007/s00253-003-1442-0 |
| [15] | Soerensen NH, Hoff T, Oestergaard PR, et al. Dehairing of skins and hides:US, 9267182B2[P]. 2016-2-23. |
| [16] | Dettmer A, Cavalli é, Ayub MAZ, et al. Environmentally friendly hide unhairing:enzymatic hide processing for the replacement of sodium sulfide and delimig. Journal of Cleaner Production, 2013, 47 (5): 11–18. |
| [17] | Wang R, Li ZQ, Liao LL. Isolation and purification of caseinase and collagenase from commercial Bacillus subtilis enzyme by affinity chromatography. Journal-Society of Leather Technologists and Chemists, 2009, 93 (1): 8–11. |
| [18] | 单志华, 李晶, 邵双喜, 等. 清洁技术从基础做起r=sc_long_. 中国皮革, 2010, 39(21): 26–29. |
| [19] | Singh R, Kumar M, Mittal A, et al. Microbial enzymes:industrial progress in 21st century. 3 Biotech, 2016, 6 (2): 174. DOI:10.1007/s13205-016-0485-8 |
| [20] | 李洪康, 李由然, 李赢, 等. 枯草芽孢杆菌产中性蛋白酶发酵条件优化. 食品与发酵工业, 2016, 42(5): 102–107. |
| [21] | Nirmal NP, Laxman RS. Enhanced thermostability of a Fungal alkaline protease by different additives. Enzyme Research, 2014, 2014 : 109303. |