2. 中国科学院上海生命科学研究院生化细胞所,上海 200031;
3. 四川辉阳生命工程股份有限公司,成都 610021
2. State Key Laboratory of Cell Biology, Shanghai Institute of Biochemistry and Cell Biology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 200031;
3. Sichuan Huiyang Life Science and Technology Corp, Chengdu 610021
C19orf18基因,又名19号染色体开放阅读框18,该基因定位于19q13.43,拥有6个外显子,编码215个氨基酸,蛋白质分子量约为24.2 kD,该基因在真核生物物种间进化保守。2002年发现其是一个编码基因[1],并在2004年得到证实[2],然而目前对其功能的研究较少。
Stephen A. Krawetz于2007年发现C19orf18蛋白在正常精子细胞中表达量要显著高于畸形精子[3],同时Ola'h[4]发现C19orf18蛋白与β淀粉样蛋白(阿兹海默症的特征蛋白)聚合物有显著的结合亲和力,为C19orf18蛋白可能参与到阿兹海默症的发病过程中提供证据。另外,有学者利用质谱技术从尿液中分离到了C19orf18蛋白,提示C19orf18作为分泌蛋白可能是某种疾病的潜在标志物[5]。我们利用COSMIC数据库发现在一些回盲肠腺癌,恶性黑色素瘤,卵巢癌或食管癌患者中C19orf18基因存在突变,在肝癌、十二指肠腺癌患者中存在C19orf18基因的高表达,提示该蛋白可能在癌症的发展进程中发挥作用。
基于以上研究以及一些临床数据,获得C19orf18蛋白的抗体对其在生理学和病理学的分子机制的研究迫在眉睫。本实验选择原核表达载体pET28a(+)和pET32a(+)进行C19orf18蛋白的表达,用异丙基-β-D-硫代半乳糖苷(IPTG)诱导得到C19orf18蛋白。之后用镍柱亲和纯化(Ni-NTA)得到高纯度的C19orf18蛋白对新西兰大白兔进行免疫,抗血清经过Protein A亲和纯化后再进行抗原亲和纯化得到C19orf18蛋白的多克隆抗体,最后通过酶联免疫吸附实验(ELISA)和蛋白免疫印迹实验(Western blotting)检测多克隆抗体的效价及特异性,旨为之后研究C19orf18蛋白的结构与功能奠定基础。
1 材料与方法 1.1 材料质粒pET28a(+)和pET32a(+)为本实验室保存;KOD-puls-neo和Ligation-high连接酶购于日本的TOYOBO公司;DNA MAKER购于中国的全式金生物技术有限公司;限制性内切酶购于美国的Fermentas公司;IP Lysis Buffer购于中国的碧云天生物技术有限公司;蛋白MAKER购于美国的Thermo Fisher Scientific公司;5个C19orf18蛋白相关的shRNA表达载体购于加拿大的ABM公司;Lipo3000转染试剂购于美国的Invitrogen公司。
1.2 方法 1.2.1 细胞培养人淋巴瘤Raji细胞系从上海中科院细胞库获得,Raji细胞培养在含10%胎牛血清的RPMI 1640中,37℃,5%二氧化碳培养箱培养[6, 7]。
1.2.2 C19orf18基因克隆及表达载体pET28a-C19orf18和pET32a-C19orf18的构建全长的C19orf18蛋白有215个氨基酸(AA)。从uniprot网站预测到,最前面的29个AA是C19orf18蛋白的信号肽,接下来的77个AA,21个AA,以及最后94个AA分别是C19orf18蛋白的胞外段(ED),穿膜区(TM)以及胞内段(ID)。通过NCBI查询人C19orf18基因序列(Gene ID:147685),在其编码的胞外段和胞内段基因的上下游各设计一对特异性引物,利用PCR扩增出C19orf18蛋白胞外段和胞内段的基因,模板为一段来自韩家淮教授赠予的cDNA,胞外段和胞内段中间通过甘氨酸-甘氨酸-甘氨酸-甘氨酸-丝氨酸(GGGGS)的柔性肽连接,再用BamH I和Not I双酶切得到pET28a与pET32a大片段。PCR程序为:94℃预变性3 min;98℃变性10 s,55℃退火30 s,68℃延伸1 min,共30个循环;最后进行终延伸68℃ 10 min。PCR产物用1%琼脂糖凝胶电泳进行分离,切取大小正确的条带,利用琼脂糖凝胶DNA提取试剂盒提取纯化PCR产物,将纯化后的PCR产物与载体用一步克隆法进行连接。将连接产物转化大肠杆菌BL21(DE3)感受态,在Luria-Bertani(LB)平板上挑取单克隆并于37℃振荡培养数小时后进行鉴定。
1.2.3 C19orf18蛋白的小量表达将鉴定正确的菌液接种于5 mL LB液体培养基中,37℃、220 r/min摇床上震荡培养过夜。一部分用于保存甘油菌,另取一部分按1:100的比例加入到10 mL新鲜的LB液体培养基中,37℃,220 r/min摇床中震荡培养使其OD值达到0.6-0.8之间,然后在实验组加入终浓度为0.5 mmol/L的IPTG诱导6 h,同时设立不加IPTG诱导的对照组。取5 mL菌液,5 000 r/min离心15 min,弃上清,收集菌体沉淀。然后将沉淀重悬于200 µL PBS中,震荡器震荡混匀,加入SDS-PAGE蛋白上样缓冲液(5×),100℃煮10 min变性,分别取诱导前和诱导后的样品20 µL进行SDS-PAGE电泳分析。为了研究C19orf18蛋白的溶解性,取5 mL的菌液,5 000 r/min离心15 min,沉淀用PBS重悬后置于冰浴中超声裂解,将上清和沉淀同时收集后进行SDS-PAGE电泳分析,最后进行考马斯亮蓝染色。
1.2.4 重组蛋白的纯化将鉴定正确的菌液接种于5 mL LB液体培养基中,37℃、220 r/min摇床上震荡培养过夜。将上面5 mL菌液按1:100的比例加入到200 mL的LB液体培养基中,37℃、220 r/min震荡培养使其OD值达到0.6-0.8之间,加入IPTG,使其终浓度为0.5 mmol/L,37℃震荡培养6 h后,将诱导表达的菌液在4℃、5 000 r/min离心15 min,弃上清,收集沉淀。用20 mL的PBS重悬菌体沉淀,置于冰浴中超声裂解细菌,超声波处理条件为:功率250 W,共作用3轮,每一轮作用5 s,间隔10 s,作用99次。将细菌裂解液4℃、12 000 r/min离心20 min,收集超声破碎后的沉淀,用20 mL的包涵体洗涤液(洗涤液1:10.0 mmol/L Tris-HCl(pH8.0),1.0 mmol/L EDTA,2 mol/L尿素;洗涤液2:10.0 mmol/L Tris-HCl(pH8.0),1.0 mmol/L EDTA,1% Triton X-100)对包涵体进行洗涤。8 000 r/min离心20 min,沉淀即为包涵体。将沉淀重悬于Buffer(8 mol/L Urea,0.01 mol/L Tris-HCl,0.1 mol/L Na2HPO4,pH8.0)中,并于摇床上放置30 min后,10 000 r/min离心30 min。将上清上样于预先用平衡缓冲液平衡好的Ni-NTA亲和柱中[8]。用含不同浓度咪唑(0、10、50、200和500 mmol/L)的洗脱缓冲液(50 mmol/L Tris,500 mmol/L NaCl,8 mol/L尿素,pH8.0)梯度洗脱,进行SDS-PAGE电泳分析。最后将得到的蛋白储存于-80℃冰箱。
1.2.5 C19orf18蛋白多克隆抗体的制备用纯化的C19orf18蛋白免疫新西兰白兔,每只家兔以100 µg/kg的剂量注射。将C19orf18与弗氏完全佐剂充分混匀后,进行背部多点肌肉注射。分别于15、29和43日用相同剂量的C19orf18蛋白与弗氏不完全佐剂混合加强免疫3次,第53天进行耳缘静脉采血,兔心脏采血,分离抗血清存放在-80℃冰箱,保存备用[9]。
1.2.6 抗血清的纯化为了得到高特异性的多克隆抗体,先对得到的抗血清进行Protein A亲和纯化。兔血清经0.45 μm滤膜过滤,Protein A亲和柱用10倍柱体积PBS平衡,流尽溶液,血清过亲和柱,流尽溶液,收集流穿,10倍柱体积PBS洗涤,流尽溶液,接着,5倍柱体积的甘氨酸溶液(0.1 mol/L,pH2.5)加入到柱子中,分管收集洗脱液,每管1 mL,加入pH8.8的1 mol/L Tris溶液以中和洗脱液。收集洗脱液检测280 nm处的吸光度,吸光度大于1.0的组分合并,用PBS进行透析过夜。取C19orf18蛋白,加入PBS,用1 L PBS透析过夜(4℃),取出蛋白,连接到活化的CNBr-activated Sepharose 4B上,制备抗原亲和柱,亲和柱用10倍柱体积PBS平衡。然后,将血清过层析柱并收集流出物。之后,再次用10倍柱体积的PBS平衡亲和层析柱,加入5 mL抗体洗脱液,分管收集洗脱液,每管1 mL,收集的洗脱液检测280 nm处的吸光度,吸光度大于1.0的组分合并,用PBS进行透析。
1.2.7 ELISA检测纯化后的多克隆抗体的效价C19orf18蛋白用pH9.6的0.05 mol/L碳酸钠-碳酸氢钠溶液稀释成1 µg/mL,加入酶标板中,每孔100 µL,4℃过夜。将包被液弃去,每孔加入200 µL封闭液(5%脱脂奶粉),37℃放置1.5 h。弃去封闭液,加入纯化的稀释好的多克隆抗体,每孔100 µL加入酶标板,37℃放置1 h。用洗涤缓冲液洗3次,每次3 min,加入100 µL用封闭液稀释至工作浓度的HRP标记的羊抗兔IgG二抗,每孔100 µL,37℃放置30 min后,用洗涤液洗3次。加入TMB显色底物,每孔100 µL,37℃放置15 min,每孔加入50 µL 2 mol/L H2SO4终止液。全波长酶标仪λ=450 nm波长处测吸光度[10]。
1.2.8 细胞转染进行细胞转染时,胰酶消化细胞并于6孔板进行转染,每孔4×105个细胞,操作按Thermo Fisher Scientific公司的Lipo3000转染手册进行。每孔2.5 µg质粒与脂质体共同孵育形成复合物后,与无血清的培养液一起加入培养板中,继续培养细胞,转染后24-72 h在荧光显微镜下观察转染效果,取效果最佳者进行Western blotting实验。
1.2.9 Western blotting鉴定将细胞用PBS洗3次后,加入细胞裂解液,4℃离心取上清,用BCA蛋白浓度测定试剂盒测蛋白的浓度。等量的总蛋白经常规SDS-PAGE电泳后,电转移至PVDF膜上,以5%脱脂奶粉常温封闭30 min;TBST洗涤3次后,以C19orf18蛋白多克隆抗体为一抗在4℃孵育过夜,TBST洗3次后,HRP标记的羊抗兔IgG为二抗,室温孵育2 h。同样经TBST清洗后,扫描PVDF膜并分析结果[11]。
2 结果 2.1 表达质粒构建设计合成引物进行C19orf18基因PCR扩增,插入到pET28a(+)和pET32a(+)载体中。C19orf18蛋白的胞外段基因和胞内段基因通过overlap PCR的方法拼接到一起,中间用柔性肽GGGGS连接,方案和所用引物如图 1和表 1所示。C19orf18基因片段插入到用BamH I和Not I双酶切的原核表达载体pET-28a(+)和pET-32a(+)中,构建pET28a-C19orf18及pET32a-C19orf18质粒,DNA测序结果正确。

|
| 图 1 pET28a-C19orf18和pET32a-C19orf18表达载体的构建方案 |
为了在大肠杆菌中表达C19orf18蛋白,将重组质粒转化到大肠杆菌BL21(DE3)中,并且在37℃条件下用0.5 mmol/L IPTG诱导6 h。最后,将所有大肠杆菌BL21(DE3)裂解,加入SDS-PAGE蛋白上样缓冲液(5×),100℃煮10 min。然后,通过SDS-PAGE电泳分析细菌裂解液。电泳结果(图 2)证实该蛋白在大肠杆菌BL21(DE3)细胞中成功表达,并且pET28a-C19orf18比pET32a-C19orf18表达的蛋白量要高很多,选择pET28a-C19orf18用于进一步的蛋白质表达纯化。
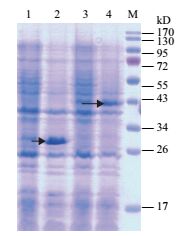
|
| 图 2 pET28a-C19orf18和pET32a-C19orf18在大肠杆菌BL21(DE3)中表达的SDS-PAGE电泳分析 M:蛋白分子量标准;1:pET28a-C19orf18全菌蛋白(未诱导);2:pET28aC19orf18全菌蛋白(0.5 mmol/L IPTG诱导6 h,37℃);3:pET32a-C19orf18全菌蛋白(未诱导);4:pET32a-C19orf18全菌蛋白(0.5 mmol/L IPTG诱导6 h,37℃)(箭头所指为目的条带) |
为了检测大肠杆菌中表达的C19orf18蛋白的溶解度,在超声处理后通过SDS-PAGE电泳分析细菌裂解液的上清液和沉淀物,观察到具有预期分子量大小的C19orf18蛋白条带(图 3)。结果表明大多数C19orf18蛋白是不溶性的,主要分布在细菌裂解液的沉淀中。
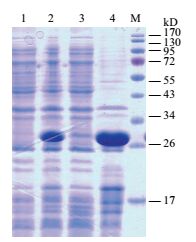
|
| 图 3 蛋白表达形式SDS-PAGE电泳分析 M:蛋白分子量标准;1:pET28a-C19orf18总菌体裂解液(未诱导);2:pET28a-C19orf18总菌体裂解液(0.5 mmol/L IPTG诱导6 h,37℃);3:IPTG诱导的大肠杆菌的上清液;4:IPTG诱导的大肠杆菌的沉淀物 |
将C19orf18蛋白变性后,通过Ni-NTA亲和纯化。高浓度的蛋白质可以通过加入不同浓度的咪唑(0、10、50、200和500 mmol/L)进行梯度洗脱(图 4)。使用SDS-PAGE电泳测定C19orf18蛋白的浓度,测得的C19orf18蛋白浓度为约0.8 μg/μL(图 5)。
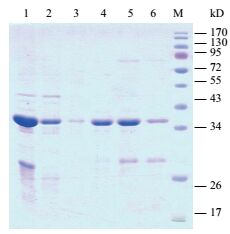
|
| 图 4 蛋白纯化SDS-PAGE电泳图 M:蛋白分子量标准;1:待纯化样品;2:过柱液;3:10 mmol/L咪唑洗脱;4:50 mmol/L咪唑洗脱;5:200 mmol/L咪唑洗脱;6:500 mmol/L咪唑洗脱 |
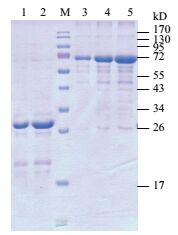
|
| 图 5 蛋白定量电泳图 M:蛋白分子量标准;1:C19orf18蛋白溶液2 μL;2:C19orf18蛋白溶液4μL;3:BSA蛋白标准品1 μg;4:BSA蛋白标准品2 μg;5:BSA蛋白标准品4 μg |
将纯化的C19orf18蛋白加入等量的弗氏完全佐剂免疫新西兰白兔,用添加弗氏不完全佐剂的C19orf18蛋白加强免疫,制备多克隆抗体。将单用Protein A纯化的多克隆抗体和用先经过Protein A纯化,后用抗原亲和纯化的多克隆抗体进行稀释,用ELISA方法进行抗体的效价检测,用免疫前血清纯化得到的IgG作为阴性对照。结果(图 6)显示,随着抗体浓度的降低,OD值逐渐变小,但经过抗原亲和纯化的多克隆抗体效价仍高达1:80 000以上,比单用Protein A纯化的多克隆抗体高。

|
| 图 6 多克隆抗体的效价检测 |
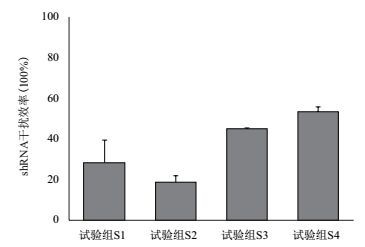
用4种特异性针对C19orf18基因的shRNA表达载体和一种阴性对照质粒瞬时转染Raji细胞,通过RNA干扰后,采用Western blotting检测各组细胞中C19orf18蛋白的表达水平。结果(图 7)显示,实验组S1、实验组S2、实验组S3、实验组S4的C19orf18蛋白表达水平与阴性对照组相比显著受到抑制。C19orf18蛋白被干扰的效率(图 8)显示,转染后,C19orf18基因的表达被明显抑制,进一步证明C19orf18蛋白多克隆抗体能够识别人源的C19orf18蛋白,特异性较好。

|
| 图 7 多克隆抗体的特异性检测 M:蛋白分子量标准;1:阴性对照组;2:实验组S1;3:实验组S2;4:实验组S3;5:实验组S4(黑色箭头所指为目的条带) |
|
| 图 8 C19orf18蛋白相关的shRNA干扰效率 |
随着人类基因组计划的发展,越来越多的具有未知功能的蛋白质被研究清楚,其中一些与人类疾病密切相关[12, 13]。其中,对C19orf18蛋白的了解却非常有限,功能尚不清楚。近来一些研究表明C19orf18蛋白与多种人类疾病相关,包括畸形精子症,阿尔茨海默病,回盲肠腺癌和黑色素瘤等等。为了研究C19orf18蛋白的功能,高特异性的C19orf18抗体对于理解C19orf18蛋白的分子机制和生理功能是非常重要的。
单克隆抗体制备程序较为复杂,且许多实验也无需使用单抗。多克隆抗体以其操作简便、对使用仪器要求不高、周期短、成本低、效果好等优点得到广泛运用[14-18]。使用原核表达蛋白免疫兔子制备多克隆抗体是目前最常见的手段之一[19]。在本实验中,为了获得具有更高特异性的C19orf18蛋白多克隆抗体,使用了去除预测的信号肽区和跨膜区的C19orf18的截短肽作为免疫原免疫兔子。首先,通过PCR的方法获得C19orf18基因的胞外段和胞内段,并克隆到原核表达的pET32a和pET28a载体中。之后,通过IPTG诱导表达,选择具有更高蛋白表达水平的pET28a载体。最后,我们纯化了大肠杆菌表达C19orf18重组蛋白。为了获得多克隆抗体,使用具有相对低的成本的兔子作为免疫动物模型。在免疫的过程中,加入弗氏佐剂来减缓蛋白质的释放,从而增加其在血清中的半衰期,这可提高巨噬细胞的吞噬作用的效率,使C19orf18蛋白更具免疫原性[20]。获得的多克隆抗体效价通过间接ELISA检测,达到了1:80 000以上,说明融合蛋白具有较好的免疫原性,最后通过Western blotting实验证实,C19orf18蛋白多克隆抗体对人内源的C19orf18蛋白有良好反应,我们成功获得了具有高特异性的多克隆抗体。
综上,我们制备的高度纯化的C19orf18重组蛋白和对人内源C19orf18蛋白具有高特异性多克隆抗体,将有利于在分子水平和细胞水平对C19orf18蛋白结构和功能的进行深入研究,使用这种抗体进行肿瘤方面的研究工作我们正在进行中。
4 结论本实验构建了pET28a-C19orf18和pET32a-C19orf18重组载体,并在大肠杆菌中成功表达了C19orf18蛋白,又用此蛋白作为抗原免疫新西兰白兔,得到C19orf18蛋白多克隆抗体。ELISA结果显示,多克隆抗体效价高达1:80 000,Western blotting证实多克隆抗体具有很好的特异性。
| [1] | Strausberg RL, Feingold EA, Grouse LH, et al. Generation and initial analysis of more than 15, 000 full-length human and mouse cDNA sequences. Proc Natl Acad Sci USA, 2002, 99 : 16899–16903. DOI:10.1073/pnas.242603899 |
| [2] | Gerhard DS, Wagner L, Feingold EA, et al. The status, quality, and expansion of the NIH full-length cDNA project:the Mammalian Gene Collection (MGC). Genome Res, 2004, 14 : 2121–2127. DOI:10.1101/gr.2596504 |
| [3] | Platts AE, Dix DJ, Chemes HE, et al. Success and failure in human spermatogenesis as revealed by teratozoospermic RNAs. Hum Mol Genet, 2007, 16 : 763–773. DOI:10.1093/hmg/ddm012 |
| [4] | Olah J, Vincze O, Virok D, et al. Interactions of pathological hallmark proteins:tubulin polymerization promoting protein/p25, beta-amyloid, and alpha-synuclein. J Biol Chem, 2011, 286 : 34088–34100. DOI:10.1074/jbc.M111.243907 |
| [5] | Gonzales PA, Pisitkun T, Hoffert JD, et al. Large-scale proteomics and phosphoproteomics of urinary exosomes. Journal of the American Society of Nephrology, 2009, 20 : 363–379. DOI:10.1681/ASN.2008040406 |
| [6] | Wang Y, Liu T, Huang P, et al. A novel Golgi protein (GOLPH2)-regulated oncolytic adenovirus exhibits potent antitumor efficacy in hepatocellular carcinoma. Oncotarget, 2015, 6 : 13564–13578. DOI:10.18632/oncotarget |
| [7] | Wilson AG, Symons JA, McDowell TL, et al. Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation. Proc Natl Acad Sci USA, 1997, 94 : 3195–3199. DOI:10.1073/pnas.94.7.3195 |
| [8] | Hwang WH, Lee WK, Ryoo SW, et al. Expression, purification and improved antigenicity of the Mycobacterium tuberculosis PstS1 antigen for serodiagnosis. Protein Expr Purif, 2014, 95 : 77–83. DOI:10.1016/j.pep.2013.11.011 |
| [9] | Daniel MD, Melendez LV, Hunt RD, et al. Herpesvirus saimiri:Ⅶ. Induction of malignant lymphoma in New Zealand white rabbits. J Natl Cancer Inst, 1974, 53 : 1803–1807. |
| [10] | Qasemi M, Behdani M, Shokrgozar MA, et al. Construction and expression of an anti-VEGFR2 Nanobody-Fc fusionbody in NS0 host cell. Protein Expr Purif, 2016, 123 : 19–25. DOI:10.1016/j.pep.2016.03.004 |
| [11] | ZhangYL, ChenSS, YangKG, 等. Functional expression, purifi-cation, and characterization of human Flt3 ligand in the Pichia pastoris system. Protein Expr Purif, 2005, 42: 246–254. |
| [12] | Stenson PD, Mort M, Ball EV, et al. The Human Gene Mutation Database:building a comprehensive mutation repository for clinical and molecular genetics, diagnostic testing and personalized genomic medicine. Hum Genet, 2014, 133 : 1–9. DOI:10.1007/s00439-013-1358-4 |
| [13] | Pericak-Vance MA, Bebout JL, Gaskell PC, J r., et al. Linkage studies in familial Alzheimer disease:evidence for chromosome 19 linkage. Am J Hum Genet, 1991, 48 : 1034–1050. |
| [14] | Cai SH, Yaol SY, Lu YS, et al. Immune response in Lutjanus erythropterus induced by the major outer membrane protein (OmpU) of Vibrio alginolyticus. Dis Aquat Organ, 2010, 90 : 63–68. DOI:10.3354/dao02206 |
| [15] | Zahn R, von Schroetter C, Wuthrich K. Human prion proteins expressed in Escherichia coli and purified by high-affinity column refolding. FEBS Lett, 1997, 417 : 400–404. DOI:10.1016/S0014-5793(97)01330-6 |
| [16] | Hu Z, Chen Z, Huang N, et al. Expression, purification of IL-38 in Escherichia coli and production of polyclonal antibodies. Protein Expr Purif, 2015, 107 : 76–82. DOI:10.1016/j.pep.2014.10.016 |
| [17] | Liu F, Wu X, Li L, et al. Expression, purification and characteriza-tion of two truncated peste des petits ruminants virus matrix proteins in Escherichia coli, and production of polyclonal antibodies against this protein. Protein Expr Purif, 2013, 91 : 1–9. DOI:10.1016/j.pep.2013.06.011 |
| [18] | Yang Y, Wang B, Yang D, et al. Prokaryotic expression of woodchuck cytotoxic T lymphocyte antigen 4(wCTLA-4) and preparation of polyclonal antibody to wCTLA-4. Protein Expr Purif, 2012, 81 : 181–185. DOI:10.1016/j.pep.2011.10.007 |
| [19] | Hernandez-Torres F, Pedrajas JR, Aranega AE, et al. Expression in bacteria of small and specific protein domains of two transcription factor isoforms, purification and monospecific polyclonal antibodies generation, by a two-step affinity chromatography procedure. Protein Expr Purif, 2008, 60 : 151–156. DOI:10.1016/j.pep.2008.03.015 |
| [20] | Lotan R, Beattie G, Hubbell W, et al. Activities of lectins and their immobilized derivatives in detergent solutions. Implications on the use of lectin affinity chromatography for the purification of membrane glycoproteins. Biochemistry, 1977, 16 : 1787–1794. DOI:10.1021/bi00628a004 |





