人白介素10(Interleukin-10,IL-10)是一种通过跨膜受体介导的重要的免疫细胞调节因子,是重要的抗炎细胞因子之一。普遍认为,IL-10可以抑制炎症反应和各种肿瘤,增强体液免疫应答[1-5]。IL-10是由多种细胞释放的,对T细胞、B细胞和骨髓瘤细胞有不同的影响[6],它可以下调Th1细胞因子的表达,促进B细胞的增值、生存。IL-10受体(IL-10R)由两条链组成,IL-10RA和IL-10RB,IL-10RA可以调节IL-10的免疫抑制信号,从而抑制促炎因子的合成[7, 8]。IL-10RA可参与PEDF通路、EGF-β通路、AKT信号通路、JAK-STAT信号通路。IL-10RA的激活可导致非受体型酪氨酸激酶JAK1的激活,引发下游信号转导通路的激活,产生一系列的反应。JAK1是非受体型酪氨酸蛋白激酶的家族成员之一,JAK1的突变或者过度表达可以引发多种疾病,如子宫内膜癌、胃癌等[9, 10]。因此,研究JAK1与IL-10RA之间的蛋白相互作用极具意义。
目前对于IL-10RA蛋白的研究主要是对下游的信号通路的激活等,IL-10RA与JAK1的相互作用的研究报道并不多。结合前期的工作,本实验室已成功构建并表达JAK1蛋白,接下来构建IL-10RA的真核表达质粒,并表达IL-10RA蛋白。共转染pENTER-IL-10RA-His和pENTER-JAK1-His重组质粒,用免疫印迹检测两者的表达,免疫共沉淀检测两者的相互作用,旨在为研究两者蛋白相互作用的机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料DH5α感受态细胞购自天根生化科技(北京)有限公司;pENTER-JAK1-His质粒、Hela细胞和HEK293细胞由南方医科大学抗体工程研究所保存。
1.1.2 试剂胎牛血清、1640培养基和DMEM培养基购自Hyclone公司;Total RNA小提试剂盒、和质粒提取试剂盒购自OMEGA公司;SuperScriptTM Ⅱ Reverse Transcriptase试剂盒和Lipofectamine® 2000转染试剂购自Invitrogen公司;PrimeStar Max DNA聚合酶和DNA 2000核酸Marker购自TaKaRa公司;限制性内切酶AsiS Ⅰ和MIu Ⅰ购自BioLabs公司;一步法克隆试剂盒购自biotool公司。引物合成和质粒测序由华大基因完成。蛋白Marker购自ThermoFisher;PVDF膜购自Bio-RAD公司。鼠源抗GAPDH抗体、鼠源抗His抗体、山羊抗鼠IgG-HRP、山羊抗兔IgG-HRP购自Bioworld公司;兔源抗JAK1抗体购自Cell Signaling Technology公司,抗IL-10RA抗体(鼠源)由罗树红教授赠与。Protein G Agrose beads购自Millipore公司。
1.1.3 仪器设备PCR扩增仪购自Life Technologies公司;蛋白电泳仪及转移装置购自BioRad公司;核酸电泳仪购自JUNYI。
1.2 方法 1.2.1 引物设计与合成在GenBank中获取IL-10RA基因序列(NM_001558),根据mRNA编码区,用Primier5.0软件进行引物设计,并在5'端加入保护碱基和酶切位点,上游引物:5'-GCCGCGATCGCCATGCTGCCGTGCCTCGTAGTGCTGC-3'(下划线为AsiS I酶切位点),下游引物:5'-GCATGCGCATCACTCACTTGACTGCAGGCTAGAG-3'(下划线为MIu I酶切位点)。扩增的IL10RA基因片段大小为1 756 bp。
1.2.2 IL-10RA基因的扩增用含10%胎牛血清的1640培养基培养HeLa细胞,按照Total RNA小提试剂盒的步骤提取人Hela细胞的总RNA,用1%的琼脂糖凝胶电泳鉴定。按照SuperScriptTM Ⅱ Reverse Transcriptase试剂盒说明书将提取的RNA逆转录成cDNA。PCR体系:PrimeStar Max 25 μL,cDNA模板5 μL,上游引物2 μL,下游引物2 μL,总体积为50 μL。PCR扩增反应条件:95℃ 10 min,95℃ 10 s,56℃ 5 s,72℃ 2 min,35个循环,72℃ 10 min,4℃保存。用1%的琼脂糖凝胶电泳鉴定扩增产物。
1.2.3 真核表达质粒pENTER-IL-10RA-His的构建将pENTER-His质粒进行AsiS Ⅰ和MIu Ⅰ双酶切3 h,IL-10RA的PCR克隆产物和pENTER-His质粒用胶回收试剂盒回收产物。用一步法克隆试剂盒连接IL-10RA回收产物和回收的pENTER-His产物(IL-10RA和pENTER-His的摩尔比为5:1),16℃,20 h。连接产物转化DH5α感受态细胞,次日挑取单克隆于5 mL含Kana的LB培养基中,37℃摇床培养10 h,按照质粒提取试剂盒说明书提取质粒。质粒经PCR扩增和双酶切鉴定为阳性克隆后,送至华大基因科技有限公司测序鉴定。
1.2.4 HEK293细胞培养及IL-10RA质粒转染用含10%胎牛血清的DMEM培养HEK293细胞。转染前1 d将细胞以4×105细胞/孔接种于6孔板培养。次日待细胞生长至60%,按照Lipofectamine® 2000转染试剂说明书转染,质粒(μg):转染试剂(μL)为1:3的比例将空质粒、重组质粒pENTER-IL-10RA-His各2 μg转染至HEK293细胞,转染6 h后HEK293细胞换液,转染48 h后收细胞进行蛋白水平鉴定。
1.2.5 JAK1与IL10RA质粒共转染转染前1 d将细胞以6×106细胞/皿接种于10 cm培养皿中。用同样的方法将7 μg的pENTER-JAK1-His和3 μg的pENTER-IL-10RA-His重组质粒和30 μL转染试剂转染至HEK293细胞中,7 μg的pENTER-JAK1-His和3 μg的pENTER-IL-10RA-His分别转染作为对照组。48 h后收细胞进行蛋白水平鉴定。
1.2.6 免疫印迹检测蛋白的表达将收集的蛋白样品加入等体积的SDS-loading buffer(2×),沸水煮15 min使蛋白变性,后14 000 r/min,室温离心15 min。经10% SDS-PAGE进行蛋白电泳。PVDF膜用甲醇浸泡5 min后进行电转移。PVDF膜用5%脱脂奶粉室温封闭2h,分别加入1:10 000用封闭液稀释的抗His标签的鼠抗和抗GAPDH抗体为一抗,室温孵育1 h。TBST工作液洗涤4次,每次8 min。加入山羊抗鼠IgG-HRP为二抗(1:10 000稀释),室温孵育1 h。TBST工作液洗涤6次,每次8 min。ECL显影。
1.2.7 免疫共沉淀鉴定IL-10RA和JAK1的相互作用将共转染表达的JAK1和IL-10RA的细胞用细胞裂解液收集,充分裂解。制备的裂解液中加入2 μg的抗IL-10RA的抗体,以HEK293细胞为对照,4℃结合过夜。40 μL/管Protein G Agrose beads 5 000 r/min离心1 min,弃上清,用40 μL细胞裂解液重悬,加入到过夜反应的混合液中,4℃结合1 h。5 000 r/min离心1 min弃上清,重复4次,加入40 μL SDS-loading buffer(2×)准备蛋白电泳样品,免疫印迹法检测,这里抗IL-10RA的抗体和抗JAK1的抗体为一抗分别孵育相应位置的条带,相对应的山羊抗鼠IgG-HRP和山羊抗兔IgG-HRP为二抗。
2 结果 2.1 人Hela细胞总RNA鉴定提取的Hela的总RNA经1%琼脂糖凝胶电泳,结果(图 1)显示,有明显的28S和32S两条条带,OD260/280约为1.98,说明此次提取的总RNA可用于逆转录cDNA。

|
| 图 1 人Hela细胞的总RNA |
合成的引物以cDNA为模板经PCR扩增目的片段,产物进行1%琼脂糖凝胶电泳。结果(图 2)显示约1 756 bp可见特异性目的条带,与IL-10RA大小一致。
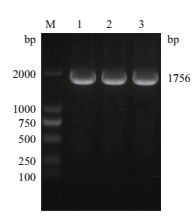
|
| 图 2 IL-10RA基因PCR产物电泳图 |
提取质粒并进行重组质粒的PCR鉴定。1%琼脂糖凝胶结果(图 3)在约1 756 bp可见特异性目的条带,与IL-10RA大小一致,说明重组质粒含有IL-10RA基因片段。
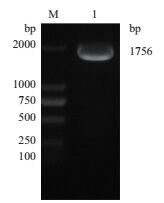
|
| 图 3 重组质粒pENTER-IL-10RA-His的质粒PCR M:DNA marker;1:IL-10RA基因质粒PCR产物 |
分别用限制性内切酶AsiSⅠ和MIuⅠ对重组质粒进行双酶切鉴定,产物进行1%琼脂糖凝胶电泳(图 4),在约1 756 bp和7 472 bp处可见IL-10RA基因和pENTER-His质粒的条带,说明重组质粒构建成功。
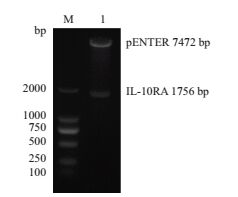
|
| 图 4 重组质粒pENTER-IL-10RA-His的双酶切鉴定 M:DNA marker;1:pENTER-IL-10RA-His双酶切产物 |
收集转染48 h的HEK293细胞,Western blotting鉴定IL-10RA蛋白表达量(图 5),以未处理的HEK293细胞作为对照组。实验组HEK293细胞中转染pENTER-IL-10RA-His质粒,Western Blotting鉴定可见约63 kD的IL-10RA蛋白条带。
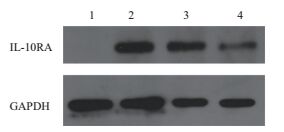
|
| 图 5 IL-10RA蛋白表达的western blotting分析结果 1:未转染组;2,3,4:pENTER-IL-10RA-His转染组 |
收集共转染重组质粒pENTER-IL-10RA-His和pENTER-JAK1-His的HEK293细胞,检测其蛋白表达量,以未处理的HEK293细胞、单转质粒pENTER-IL-10RA-His、质粒pENTER-JAK1-His为对照组,Western Blotting鉴定。由图 6可知,实验组出现两条条带,位置在约63 kD和133 kD处;未处理的HEK293细胞未出现特异性条带;单转染的质粒pENTER-IL-10RA-His在约63 kD有条带出现;单转染的质粒pENTER-JAK1-His在133 kD处出现条带,这与共转染的结果相符,说明共转染质粒成功表达IL-10RA和JAK1蛋白。
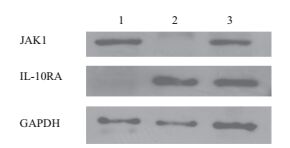
|
| 图 6 JAK1和IL-10RA共转染结果分析 1:单转染JAK1;2:单转染IL-10RA;3:共转染JAK1和IL-10RA |
共转染JAK1和IL-10RA质粒的细胞裂解液用抗IL-10RA的抗体捕获裂解液中的IL-10RA,同时捕获的还有可以与之相互作用的JAK1蛋白。Protein G Agrose beads可特异性结合抗IL-10RA的抗体。加入Protein G Agrose beads后,抗IL-10RA的抗体和IL-10RA及与之相互作用的蛋白JAK1均结合在Protein G Agrose beads上,通过低速离心,使得与裂解液中的其他蛋白分离,Western Blotting鉴定(图 7)。HEK293细胞对照组只出现抗体的重链和轻链,而实验组除了抗体的重链和轻链,还有目的条带JAK1和IL-10RA的条带,这说明两个蛋白在HEK293细胞中存在相互作用,并且可以用免疫共沉淀检测。
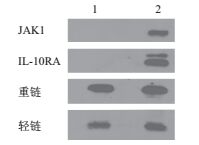
|
| 图 7 检测JAK1蛋白和IL-10RA蛋白相互左右的免疫共沉淀分析 1:HEK293细胞对照组;2:共转染JAK1和IL-10RA质粒的实验组 |
自90年代开始,人类开始实施基因组计划,至2003年经过世界各国科学家的努力,提前完成了人全基因组测定。但是,大多数疾病并非仅仅因为基因改变造成,随后又提出后基因组计划,蛋白质组的研究占据及其重要的部分,但是对于蛋白质功能及其相互作用方面的研究仍相对缺乏。目前研究蛋白质相互作用技术方法很多,如噬菌体展示技术、串联亲和纯化技术、pull down,免疫共沉淀等[11-17]。研究发现,IL-10可以调节相关细胞的神经炎症反应,而且也存在抗凋亡作用。IL-10通过与神经元上的IL-10RA相互作用,导致JAK1-STAT3通路的激活,抑制神经元凋亡和神经炎症[18]。Wagner等[19]发现JAK1激活程度不同可引起下游不同的信号转导通路,JAK1的抑制可某种程度上减轻自身免疫病及炎症,这提示未来JAK1的抑制剂可能可以应用于自身免疫性疾病的治疗。但是,目前对于IL-10RA蛋白的研究主要致力对下游信号通路的激活等,IL-10RA与JAK1的相互作用的研究报道并不多。因此,本研究尝试用免疫共沉淀的方法检测IL-10RA与JAK1的蛋白相互作用。而IL-10RA参与多条信号通路,因此与其存在相互作用的蛋白必然很多,现今用经典的免疫共沉淀的方法对这些相互作用蛋白尚并不能定量,而且检测过程繁琐而复杂。因此,尝试用免疫分析的方法如ELISA、时间分辨免疫分析、化学发光免疫分析等,以期对已知存在相互作用的蛋白进行简便快速的检测,同时也可为其他研究者寻找未报道的存在相互作用的蛋白提供便利,这将是未来的一个研究方向。
4 结论本实验从Hela细胞中提取人总RNA,并通过逆转录PCR获得IL-10RA基因全长,以pENTER-His为载体构建重组真核表达质粒转染至HEK293细胞表达蛋白,Western blot可检测到与人IL-10RA大小一致的蛋白条带。共转染及免疫共沉淀均可检测到IL-10RA和JAK1。真核表达蛋白特异性较强,具有生物学活性,其结构更接近天然蛋白。
| [1] | Mocellin S, Marincola FM, Young HA. Interleukin-10 and the immune response against cancer:a counterpoint. Journal of Leukocyte Biology, 2005, 78 (5): 1043–1051. DOI:10.1189/jlb.0705358 |
| [2] | von Lanzenauer SH, Wolk K, Kunz S, et al. Interleukin-10 receptor-1 expression in monocyte-derived antigen-presenting cell populations:dendritic cells partially escape from IL-10's inhibitory mechanisms. Genes & Immunity, 2015, 16 (1): 8–14. |
| [3] | Trifunović J, Miller L, Debeljak Z, et al. Pathologic patterns of interleukin 10 expression--a review. Biochemia Medica, 2015, 25 (1): 36–48. |
| [4] | Kim R, Emi M, Tanabe K, et al. Tumor-driven evolution of immunosuppressive networks during malignant progression. Cancer Research, 2006, 66 (11): 5527–5536. DOI:10.1158/0008-5472.CAN-05-4128 |
| [5] | Darnell JJ, Kerr IM, Stark GR. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins. Science, 1994, 264 (5164): 1415–1421. DOI:10.1126/science.8197455 |
| [6] | Beser OF, Conde CD, Serwas NK, et al. Clinical features of interleukin 10 receptor gene mutations in children with very early-onset inflammatory bowel disease. Journal of Pediatric Gastroenterology & Nutrition, 2014, 60 (3): 332–338. |
| [7] | Pestka S, Krause CD, Sarkar D, et al. Interleukin-10 and related cytokines and receptors. Annual Review of Immunology, 2004, 22 : 929–979. DOI:10.1146/annurev.immunol.22.012703.104622 |
| [8] | Commins S, Steinke JW, Borish L. The extended IL-10 superfamily:IL-10, IL-19, IL-20, IL-22, IL-24, IL-26, IL-28, and IL-29. Journal of Allergy & Clinical Immunology, 2008, 121 (5): 1108–1111. |
| [9] | Stelloo E, Versluis MA, Nijman HW, et al. Microsatellite instability derived JAK1 frameshift mutations are associated with tumor immune evasion in endometrioid endometrial cancer. Oncotarget, 2016, 7 (26): 39885–39893. |
| [10] | Song B, Zhan H, Bian Q, et al. Piperlongumine inhibits gastric cancer cells via suppression of the JAK1, 2/STAT3 signaling pathway. Molecular Medicine Reports, 2016, 13 (5): 4475–4480. |
| [11] | Li Q, Gu S, Li N, et al. Protein interaction network construction and biological pathway analysis related to atherosclerosis]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 2015, 32 (6): 1255–1260. |
| [12] | Verhelst J, De Vlieger D, Saelens X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein. J Vis Exp, 2015 (98): e52871. |
| [13] | Duan JW, Lu Z, Jiang B, et al. Discovery of pyrrolo[1, 2-b] pyridazine-3-carboxamides as Janus kinase (JAK) inhibitors. Bioorganic & Medicinal Chemistry Letters, 2014, 24 (24): 5721–5726. |
| [14] | Einarson MB, Pugacheva EN, Orlinick JR. GST Pull-down. CSH Protoc, 2007 (2007): t4757. |
| [15] | Valero ML, Sendra R, Pamblanco M. Tandem affinity purification of histones, coupled to mass spectrometry, identifies associated proteins and new sites of post-translational modification in Saccharomyces cerevisiae. J Proteomics, 2016, 136 : 183–192. DOI:10.1016/j.jprot.2016.01.004 |
| [16] | Saito Y, Nakagawa T, Kakihana A, et al. Yeast Two-Hybrid and One-Hybrid screenings identify regulators of hsp70 gene expression. J Cell Biochem, 2016, 117 (9): 2109–2117. DOI:10.1002/jcb.v117.9 |
| [17] | Yu Y, Li Y, Zhang Y. Yeast Two-Hybrid screening for proteins that interact with the extracellular domain of amyloid precursor protein. Neurosci Bull, 2016, 32 (2): 171–176. DOI:10.1007/s12264-016-0021-1 |
| [18] | Zhu Y, Chen X, Liu Z, et al. Interleukin-10 protection against lipopolysaccharide-induced neuro-inflammation and neurotoxicity in ventral mesencephalic cultures. International Journal of Molecular Sciences, 2016, 17 (1). |
| [19] | Wagner AH, Conzelmann M, Fitzer F, et al. JAK1/STAT3 activation directly inhibits IL-12 production in dendritic cells by preventing CDK9/P-TEFb recruitment to the p35 promoter. Biochem Pharmacol, 2015, 96 (1): 52–64. DOI:10.1016/j.bcp.2015.04.019 |




