党参(Codonopsis pilosula)是中国传统中药材,根据产地不同,其中以生长于山西晋东南地区的潞党参为最佳,含有丰富的多糖、皂苷、矿物质、膳食纤维等成分,具有调节免疫、抗肿瘤、清除氧自由基等药理活性[1, 2],在亚洲地区常被作为珍贵的保健食品。随着生活水平的提高,人们希望在摄取食物、补充营养的同时,还能够提高自身机体免疫力,尤其是对肿瘤的防御能力能够得到增强。根据世界卫生组织(World Health Organization,WHO)统计数据,恶性肿瘤是当今世界居民死亡的重要原因,宫颈癌则是仅次于乳腺癌的女性第二大最常见的恶性肿瘤[3]。各种肿瘤细胞的发生机制虽然各有不同,但大多具有两个基本的生理学特征,即细胞的无限增殖和对周围组织的侵袭浸润[4, 5]。目前,多数在研或临床应用的抗肿瘤药物多从上述两个方面着手。本研究以潞党参中重要的生物活性成分多糖(LDP)为研究对象,分析其对肿瘤细胞增殖和迁移的影响,探讨其作为保健食品提高机体防御恶性肿瘤的潜在价值,为其深度开发提供参考。
1 材料与方法 1.1 材料 1.1.1 材料及试剂潞党参购自山西省长治市万民药房;人宫颈癌细胞SiHa购自江苏齐氏生物科技有限公司;DMEM培养基购自北京索来宝生物科技有限公司;胎牛血清购自杭州四季青生物工程材料有限公司;胰蛋白酶购自上海索来宝生物科技有限公司;四氮甲唑蓝(MTT)、丝裂霉素C以及二甲基亚砜(DMSO)购自北京依托华茂生物科技有限公司;潞党参多糖参照文献[6]制备并保存。
1.1.2 仪器与设备多功能酶标仪SpectraMax M2 [美谷分子仪器(上海)有限公司];XSP-6C光学倒置显微镜(日本Olympus公司);CO2培养箱(美国热电公司)。
1.2 方法 1.2-1 SiHa细胞增殖能力检测用胰酶-EDTA溶液消化对数生长期的SiHa细胞,使其成为单细胞悬液,按照5×103细胞/孔的浓度接种于96孔板中,放入37℃的5% CO2培养箱中过夜培养后,向每个孔中加入对应浓度的LDP溶液,每个处理孔设置3个重复,在对应时间点向培养液中加入1/10体积的MTT溶液(5 mg/mL),继续培养4 h后,弃去培养液,加入150 μL DMSO,振荡10 min后,在酶标仪检测OD570值,按如下公式计算抑制率:
抑制率(%)=(OD对照组-OD处理组)/OD对照组×100%
式中,OD对照组为对照组在570 nm处的吸光值;OD处理组为LDP处理组在570 nm处的吸光值。
1.2.2 SiHa细胞黏附能力检测依据参考文献中的方法[7, 8],用胰酶-EDTA溶液消化对数生长期的SiHa细胞,按照2×104细胞/孔的浓度接种于96孔板中,每种细胞做6个复孔,放入37℃的5% CO2培养箱中过夜培养1 h后,弃去培养基,并用37℃预热的磷酸盐缓冲液清洗掉未贴壁的细胞,加入90 μL新鲜培养基和10 μL MTT溶液(5 mg/mL),继续培养4 h后,弃去培养液,加入150 μL DMSO,振荡10 min后,在酶标仪检测OD570值。
1.2.3 SiHa细胞铺展情况检测参考文献[9]的方法,将单细胞悬液接种于12孔板中,然后分别在0 h、4 h、8 h、12 h进行显微拍照,对铺展细胞的数量进行统计,并用Image-Pro Plus 6.0软件计算出铺展面积,分析LDP对细胞铺展的影响。
1.2.4 划痕试验将细胞接种12孔板中,每孔5×104个细胞,每个处理做3个复孔,于37℃、5% CO2条件下培养直至细胞汇合率达到100%,弃去培养基,用终浓度为25 μg/mL丝裂霉素C处理细胞1 h。然后,用10 µL枪头进行划痕,并用37℃预热的磷酸盐缓冲液漂洗3次,尽量去除脱落细胞,再加入新鲜培养基,于37℃、5% CO2条件下培养,分别在0 h、12 h和24 h进行显微拍照。利用Image-Pro Plus 6.0软件测量划痕宽度,按照如下公式计算迁移率:
迁移率(%)=(W0h-W12 h或24 h)/ W0 h×100%
式中,W0 h为0 h划痕宽度(μm);W12 h或24 h为培养12 h或24 h后划痕宽度(μm)。
1.3 数据统计利用SPSS 10.0软件,对实验数据进行统计学分析。
2 结果 2.1 LDP对SiHa细胞增殖的影响用不同浓度的LDP处理人宫颈癌细胞SiHa 48 h后,利用MTT法检测其对细胞存活的抑制率,结果如图 1所示,随着LDP浓度的增大,其抑制SiHa细胞的能力增强,与阴性对照相比,多糖终浓度为0.25 mg/mL、0.50 mg/mL和1.00 mg/mL时,细胞抑制率差异极显著(P < 0.01)。当终浓度为1 mg/mL时,抑制率接为68.19%,计算其IC50值为0.68 mg/mL。
用抑制率相对较低的LDP浓度(0.20 mg/mL)处理SiHa细胞,进行细胞增殖试验。结果如图 2所示,从第2天起,LDP处理组细胞数量开始少于对照组细胞,到第3天和第4天LDP处理组细胞数量显著少于对照组(P < 0.05),到培养的第5天,二者差异达到极显著(P < 0.01),表明长期低浓度的LDP处理,也能抑制SiHa细胞的生长。
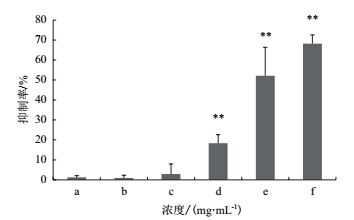
|
| 图 1 不同的LDP浓度对SiHa细胞的抑制作用 a.对照;b. 0.0625 mg/mL;c. 0.125 mg/mL;d. 0.25 mg/mL;e. 0.50 mg/mL;f.1.00 mg/mL;*表示与对照相比,差异显著(P<0.05);**表示与对照相比,差异极显著(P<0.01)。下同 |
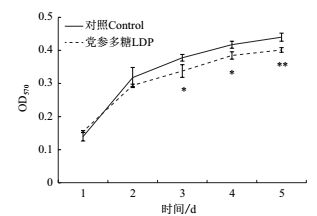
|
| 图 2 LDP对SiHa细胞增殖的影响 |
将单细胞悬液接种到6孔培养板中,选择细胞增殖抑制率低的LDP溶液(终浓度0.20 mg/mL)处理SiHa细胞,观察低浓度的LDP对其铺展的影响。结果(图 3)显示,培养6 h后,空白对照和LDP处理组中的大部分细胞均已变为扁平状,并形成了早期的片层伪足结构,即细胞进入铺展过程,但是通过显微镜观察发现LDP处理组细胞铺展面积小于空白对照组细胞面积,培养12 h后,这种差异仍存在。

|
| 图 3 LDP对SiHa细胞铺展过程的影响(×20) |
通过软件对细胞铺展面积进行计算和统计,结果如图 4所示,6 h时,LDP处理组细胞面积显著小于对照组细胞(P < 0.01),12 h时,两组细胞的铺展面积均增大,但是LDP处理组细胞面积仍然显著小于对照组细胞(P < 0.01)。上述结果表明,LDP抑制了肿瘤细胞SiHa的铺展过程。
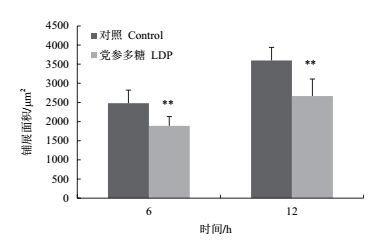
|
| 图 4 LDP对SiHa细胞铺展面积的影响 |
用终浓度为0.20 mg/mL的LDP处理SiHa细胞后,采用MTT法检测黏附细胞的相对数量,与未经处理的对照组细胞相比,黏附细胞的数量明显减少,差异极显著(P < 0.01)(图 5),表明LDP抑制了SiHa细胞的黏附作用。
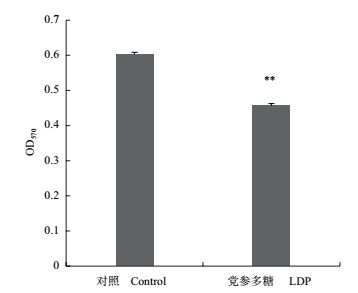
|
| 图 5 LDP对SiHa细胞黏附的影响 |
根据2.2和2.3的结果,用终浓度为0.20 mg/mL的LDP处理SiHa细胞24 h后,进行划痕实验(图 6-A)。经过统计后,结果如图 6-B所示,划痕12 h后,对照组细胞迁移率为40.32%,处理组细胞的迁移率为15.56%,而划痕24 h后,对照组细胞迁移率为64.53%,处理组细胞的迁移率为24.20%,表明LDP显著抑制了SiHa细胞的迁移能力(P < 0.01)。
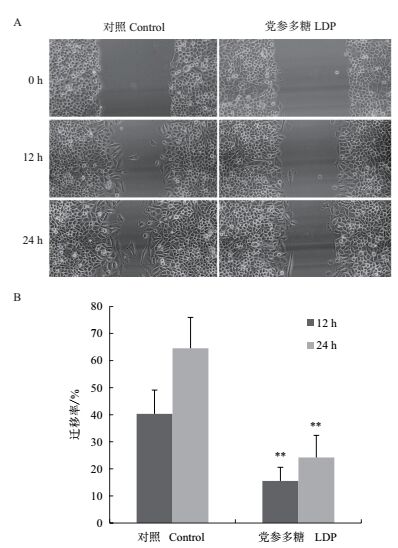
|
| 图 6 LDP抑制SiHa细胞的迁移运动 A:划痕试验(×20);B:划痕试验统计结果 |
中药植物多糖因其来源广泛、毒副作用小、极难产生耐药性等优势,近年来成为生物学和药学领域的研究热点,包括抗肿瘤、抗氧化、免疫调节等方面[10-13]。目前,对抗肿瘤药物研究多集中在抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡等方面,例如姜艳霞等[14]发现海带多糖通过激活Caspase-3,促进细胞凋亡,并导致AFP蛋白表达下调抑制人肝癌细胞Bel-7402增殖;鞠瑶瑶等[15]发现脆江蓠多糖能够诱导人宫颈癌细胞HeLa、食道癌细胞EC-109、肝癌细胞HepG-2以及乳腺癌细胞MCF-7的凋亡;刘容旭等[16]则发现五味子多糖通过上调Caspase-3表达,诱导两种肠道肿瘤细胞Caco-2和HT-29的凋亡;王慧等[17]对4种地衣的提取物的抗肿瘤活性进行比较研究发现,黑石耳粗多糖对人肝癌细胞HepG2具有强烈的抑制作用,而金刷把则显著抑制人宫颈癌细胞HeLa细胞的生长;陈文霞等[18]发现纹党参多糖在硒化后对肺癌细胞A549的抑制效应显著增强,具备开发为抗肿瘤药物的潜力;陈嘉屿等[19]发现纹党参多糖和白条党多糖均能显著增强荷瘤小鼠NK细胞活度,促进淋巴细胞增殖,并提高血清细胞因子IL-2、IL-1β、IL-6、TNF-α和INF-γ的含量,降低IL-4的水平,从而发挥较强的抗肿瘤作用;杨丰榕等[20]则确定了长治党参多糖发挥抑制人胃腺癌细胞BGC-823和人肝癌细胞Bel-7402的关键活性组分为CPS-3和CPS-4。在本研究中,MTT试验表明LDP能够显著抑制人宫颈癌细胞SiHa的增殖,IC50值为0.68 mg/mL。
迁移能力增强并向周围组织侵袭浸润是肿瘤细胞的另一个重要特征,也是恶性肿瘤致死的重要原因[21, 22],因此降低肿瘤细胞的迁移运动能力、抑制其组织转移是抗肿瘤药物开发的另一个切入点,但是,目前从该角度开发抗肿瘤药物的研究相对较少,例如朱庆均等[23]的研究表明罗勒多糖可能通过降低人淋巴管内皮细胞HLECs的体外成管能力以及下调VEGFR-3的表达来发挥其抗肿瘤转移的药理功能;朱家红等[24]发现当归多糖联合阿糖胞苷能有效抑制白血病细胞对肝小叶的浸润,并促进其凋亡;赵蕊等[25]研究发现马齿苋多糖可以抑制U14宫颈癌细胞的肺转移,而且效果优于经典抗肿瘤药环磷酰胺。在本研究中,通过细胞黏附试验、细胞铺展试验以及划痕试验发现LDP能够显著抑制人宫颈癌细胞SiHa的黏附和铺展,进而抑制其迁移运动能力。上述实验结果表明作为党参中的上品,潞党参的多糖成分具有开发为抗肿瘤药物的潜在价值,或者开发为具有防癌保健功能的食品添加成分的应用前景。但是,LDP的具体成分组成及其抗肿瘤作用的详细分子机制需要进一步的研究才能予以揭示。
4 结论通过MTT实验,证实上党地区道地药材潞党参多糖的成分能够抑制人宫颈癌细胞SiHa的增殖,IC50值为0.68 mg/mL。此外,低浓度的潞党参多糖溶液就能显著减弱SiHa细胞的黏附能力,延缓了其铺展过程,进而抑制了其迁移运动能力。
| [1] | 冯佩佩, 李忠祥, 原忠. 党参属药用植物化学成分和药理研究进展. 沈阳药科大学学报, 2012, 29(4): 307–311. |
| [2] | 关琳静, 连云岚, 李建宽, 等. 潞党参HPLC特征图谱研究. 中国中药杂志, 2015, 40(14): 2854–2861. |
| [3] | World Health Organization. World Cancer Report[R]. Geneva:WHO, 2014. |
| [4] | 王祥宇, 郑燕, 鲁明, 等. 肿瘤代谢与肿瘤转移. 复旦学报:医学版, 2016, 43(1): 86–93. |
| [5] | 陈博, 熊茂明, 孟翔凌. 重视肿瘤患者的营养支持治疗. 肿瘤, 2016, 36(6): 705–710. |
| [6] | 胡建燃, 郭阳, 李平. 潞党参多糖的提取及其抗氧化活性分析. 中国食品添加剂, 2016, 149(7): 93–96. |
| [7] | Weitz-schmidt G, Chreng S. Cell adhesion assays. Methods Mol Biol, 2012, 757 : 15–30. |
| [8] | Chigaev A, Sklar LA. Overview:assays for studying integrin-dependent cell adhesion. Methods Mol Biol, 2012, 757 : 3–14. |
| [9] | Vega FM, Colomba A, Reymond N, et al. RhoB regulates cell migration through altered focal adhesion dynamics. Open Biol, 2012, 2 (5): 120076. DOI:10.1098/rsob.120076 |
| [10] | 许春平, 杨琛琛, 郑坚强, 等. 植物叶多糖的提取和生物活性综述. 食品研究与开发, 2014, 35(14): 111–114. DOI:10.3969/j.issn.1005-6521.2014.14.33 |
| [11] | 陈高敏, 王顺春, 王璐, 等. 中药植物多糖抗皮肤光老化的研究进展. 南京中医药大学学报, 2016, 32(4): 396–400. |
| [12] | 解玉怀, 尚庆辉, 古丽美娜, 等. 饲料添加剂植物多糖的生物学作用. 草业科学, 2016, 33(3): 503–511. DOI:10.11829/j.issn.1001-0629.2015-0433 |
| [13] | 魏帮鸿, 杨志刚, 郭瑞瑞. 植物多糖在水产养殖中的应用. 饲料研究, 2016(14): 39–42. |
| [14] | 姜艳霞, 纪朋艳, 朱文赫, 等. 海带多糖对人肝癌细胞Bel-7402增殖的抑制作用及其机制. 食品科学, 2015, 36(15): 179–182. DOI:10.7506/spkx1002-6630-201515033 |
| [15] | 鞠瑶瑶, 等. 响应面试验优化脆江蓠多糖提取工艺及其对肿瘤细胞的抑制作用. 食品科学, 2016, 37(8): 57–62. DOI:10.7506/spkx1002-6630-201608010 |
| [16] | 刘容旭, 高辰哲, 姜帆, 等. 五味子多糖对两种肠道肿瘤细胞抑制作用的影响. 食品科学, 2016, 37(5): 192–196. |
| [17] | 王慧, 王启林, 田娇, 等. 4种地衣提取物抗氧化和抗肿瘤活性研究. 植物科学学报, 2014, 32(2): 181–188. |
| [18] | 陈文霞, 张培, 高霞, 等. 硒化纹党参多糖和其抗A549细胞的活性. 中成药, 2015, 37(11): 2408–2413. |
| [19] | 陈嘉屿, 胡林海, 吴红梅, 等. 党参多糖类对荷瘤小鼠免疫应答及抑瘤作用研究. 中华肿瘤防治杂志, 2015, 22(17): 1357–1362. |
| [20] | 杨丰榕, 李卓敏, 高建平. 党参多糖分离鉴定及体外抗肿瘤活性的研究. 时珍国医国药, 2011, 22(12): 2876–2878. DOI:10.3969/j.issn.1008-0805.2011.12.020 |
| [21] | 朱皓皞, 蔡勇. 肿瘤微浸润癌的诊断标准差异及临床意义. 诊断病理学杂志, 2016, 23(4): 300–303. |
| [22] | 安彩艳, 包良, 阿拉坦高勒. 胞外酸性与肿瘤的浸润转移. 中国生物化学与分子生物学报, 2013, 29(10): 926–931. |
| [23] | 朱庆均, 连松刚, 等. 罗勒多糖对HLECs中VEGFR-2/3表达的影响. 中药新药与临床药理, 2016, 27(3): 342–346. |
| [24] | 朱家红, 徐春燕, 穆欣艺, 等. 当归多糖联合阿糖胞苷对移植性人白血病小鼠模型肝脏的作用机制. 中国中药杂志, 2014, 39(1): 121–125. |
| [25] | 赵蕊, 蔡亚平, 陈志宝, 等. 马齿苋多糖对老龄荷瘤小鼠抗宫颈癌的作用. 中国老年学杂志, 2013, 33: 4480–4482. DOI:10.3969/j.issn.1005-9202.2013.18.048 |




