在进化的长河中,自然界中的动、植物为了种族的延续和发展,逐渐进化形成在特定的繁育特性,绵羊的季节性繁殖就是一个自然选择和适应的结果。许多绵羊品种特别是细毛羊品种具有季节性繁殖特点。在现代绵羊养殖生产中,提高绵羊的繁殖效率是增产增收的关键环节。结合MOET技术可以实现绵羊一年两产或两年三产,但需要投入大量的人力物力,而且在非繁殖季节外源激素处理的效果有时也差强人意。因此打破发情特性实现常年发情,提高绵羊的繁殖效率,选育具有常年发情特性的细毛羊品种是规模化养殖过程中急需解决的问题,而深入解析绵羊季节性发情的分子基础和作用机制是定向选育的第一步。
Leptin(瘦素)是肥胖基因(Obese gene,Ob)的表达产物,是一种由脂肪细胞分泌的多功能细胞因子,在能量平衡、食欲调节和繁殖方面起重要作用,主要在脂肪组织中表达,在其他组织中也有少量表达[1]。脂肪细胞分泌的leptin与血清蛋白结合,运输到靶组织,转变成游离的leptin[2],与受体结合作用于代谢调节中枢从而发挥其生物学功能。1996年小鼠的leptin受体被成功克隆[3]。Leptin受体包括6种异构体(LEPR a-f),其中长型受体LEPRb为主要的功能性受体,在leptin的信号转导中起重要作用。有研究表明leptin及其受体的表达变化与哺乳动物繁殖性能有一定关系[4]。ob/ob(leptin基因突变)和db/db(LEPRb基因突变)肥胖小鼠均无繁殖能力,ob/ob小鼠皮下注射外源leptin可使其体重和繁殖性能恢复正常[5],给性成熟前的小鼠注射人重组leptin会使小鼠的初情期提前[6],青春期时血清leptin会早于生殖激素/性激素开始上升,激活性腺轴,进而对青春期生殖功能的发育进行调节。Di等[7]发现给性成熟前的兔子注射大剂量的letpin会抑制排卵,但低剂量长时间的注射会促进幼兔卵泡发育和排卵。我们前期研究中发现,在常年发情和季节性发情绵羊外周血中的leptin含量存在显著的品种差异[8, 9],推测leptin参与绵羊发情调控,但其具体的调控机制和作用方式仍不明确。因此,本研究以发挥leptin主要生物学功能的长型受体为研究对象,分析其在发情周期的不同阶段和不同组织中的表达变化,为探讨leptin参与调控绵羊发情的作用机制提供研究基础。
1 材料与方法 1.1 材料选择年龄相近(3-4岁)、体况相似、健康的中国美利奴(军垦型)(新疆农垦科学院试验羊场)和多浪羊(新疆农垦科学院试验羊场)各12只,统一饲养管理。秋分后开始早晚公羊试情,跟踪2个情期后采集不同发情时期的组织样品(下丘脑、卵巢和子宫)[10],并迅速置于液氮保存备用。
1.2 方法 1.2.1 总RNA提取及cDNA的合成Trizol(Invitr-ogen)一步法提取各组织总RNA,0.8%琼脂糖凝胶电泳检测总RNA完整性,核酸蛋白分析仪(Implen)检测RNA浓度及纯度。参照Transcriptor First Strand cDNA Synthesis Kit(Roche)说明书合成cDNA第一链。
1.2.2 绵羊LEPRb基因实时荧光定量PCR检测分别以各组织样品的cDNA为模板,以持家基因GAPDH为内参,利用实时荧光定量PCR方法检测LEPRb的表达水平,每个样品设置3个重复。参考绵羊LEPRb(U62124.1) 序列和GAPDH(NM_001190390.1) 序列信息设计检测引物(表 1)。依照LightCycler 480 SYBR Green I Master(Roche)试剂盒说明书进行实时荧光定量PCR分析,反应条件为: 95℃预变性10 min;95℃ 10 s;60℃ 20 s;72℃ 25 s;45个循环。
采用2-ΔΔCT法分析不同组织中LEPRb基因表达变化,SPSS 16.0软件单因素方差分析对结果进行统计学分析。
2 结果 2.1 总RNA的提取及目的基因扩增提取的各组织总RNA经0.8%琼脂糖凝胶电泳检测显示总RNA完整性较好且无蛋白和基因组DNA污染;核酸蛋白分析仪检测OD260/OD280比值在1.8-2.0之间,各组织总RNA浓度及纯度符合试验要求。分别以不同组织总RNA为模板反转录合成cDNA第一链。以cDNA为模板,利用LEPRb与GAPDH特异引物扩增目的片段,PCR产物与预期大小相符且扩增片段特异。
2.2 LEPRb在不同品种绵羊发情不同时期的组织表达变化将下丘脑组织LEPRb表达水平定义为1,对定量PCR检测结果进行标准化处理。图 1所示为LEPRb在不同绵羊品种不同发情阶段各组织表达情况。整个发情过程中,LEPRb在下丘脑、卵巢和子宫组织中均有表达,但表达变化趋势不同。
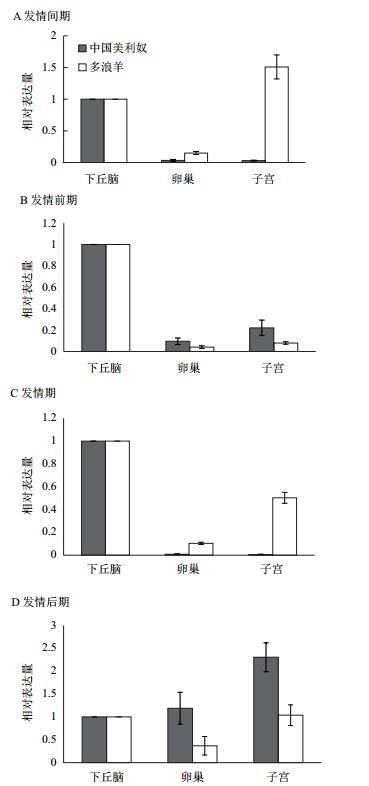
|
| 图 1 LEPRb在不同绵羊品种不同发情时期的组织表达变化 |
在发情间期(图 1-A),中国美利奴下丘脑的LEPRb表达水平极显著高于卵巢和子宫(P < 0.01),而卵巢和子宫的相对表达水平无显著差异;多浪羊LEPRb表达水平由高到低依次为:子宫、下丘脑、卵巢,其中子宫LEPRb表达水平显著高于下丘脑(P < 0.05),极显著高于卵巢(P < 0.01)。
发情前期(图 1-B)两品种绵羊在3个组织中的表达变化相同,下丘脑LEPRb表达水平极显著高于卵巢和子宫(P < 0.01),卵巢中的表达水平最低,子宫组织LEPRb基因表达水平均略高于卵巢组织,同一品种子宫和卵巢组织的表达水平无显著差异(P > 0.05)。
与发情前期的变化趋势相似,发情期(图 1-C)的中国美利奴LEPRb表达水平由高到低依次为下丘脑、卵巢、子宫,且下丘脑的表达水平极显著高于卵巢和子宫(P < 0.01),子宫和卵巢LEPRb表达水平无显著差异。多浪羊LEPRb表达水平由高到低依次为下丘脑、子宫、卵巢,其中下丘脑中的表达水平极显著高于卵巢(P < 0.01),显著高于子宫(P < 0.05);子宫中的表达水平显著高于卵巢(P < 0.05)。
发情后期(图 1-D),中国美利奴和多浪羊各组织LEPRb表达与前3个时期有明显的差异。LEPRb在中国美利奴发情后期的子宫中表达水平最高,但不同组织中的表达水平无显著差异。多浪羊子宫和下丘脑的LEPRb表达水平较高,极显著地高于卵巢(P < 0.01)。
2.3 不同发情阶段不同组织LEPRb的表达变化发情季节不同发情阶段各组织中LEPRb表达变化如图 2所示。同一品种相同组织发情间期的表达水平为对照,以比较分析同一组织不同时期LEPRb的表达变化。图 2-A为下丘脑LEPRb相对表达水平。与发情间期相比,中国美利奴下丘脑中LEPRb的表达呈现出从发情间期向发情期逐渐下降趋势,至发情期LEPRb的表达水平有所回升,但与发情间期和发情前期的差异不显著(P < 0.05),发情期至发情后期急剧减少,发情后期的表达水平极显著低于其它阶段(P < 0.01)。多浪羊下丘脑组织不同发情时期LEPRb的表达水平在发情前期达到最高点,然后逐渐下降至发情间期时达到最低点,发情前期表达水平是发情间期的2.14倍(P < 0.01)。
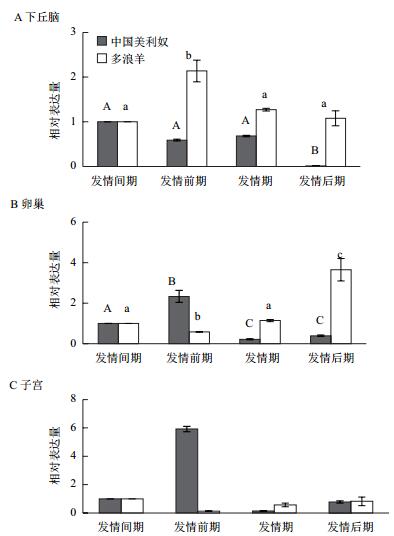
|
| 图 2 LEPRb在不同绵羊品种不同发情阶段的组织表达变化 |
从图 2-B中可以看出,中国美利奴卵巢LEPRb表达水平从发情期的最低点开始逐渐升高,至发情前期达到最高水平,发情前期的表达水平极显著高于其他3个阶段(P < 0.01)。多浪羊卵巢LEPRb表达水平从发情前期开始逐渐升高至发情后期达到最高点后下降,发情后期LEPRb表达水平极显著高于其他3个阶段(P < 0.01)。
图 2-C为两品种绵羊子宫LEPRb表达变化。从图中可以看出,两品种绵羊子宫组织LEPRb表达变化趋势与卵巢相似。在发情前期中国美利奴子宫LEPRb表达水平达到最高值,极显著高于其他3个时期(P < 0.01);同期多浪羊子宫LEPRb表达水平达到最低值,极显著低于发情间期(P < 0.01),显著低于发情后期(P < 0.05)。
2.4 不同品种不同组织LEPRb表达变化以相同发情时期多浪羊组织LEPRb表达水平为对照组,分析在发情季节不同发情阶段中国美利奴与多浪羊各组织LEPRb表达水平变化。从图 3中可以看出在不同发情阶段中国美利奴各组织中LEPRb表达水平都高于多浪羊,但在发情后期各组织、发情间期和发情期子宫组织表达水平在品种之间差异不显著。
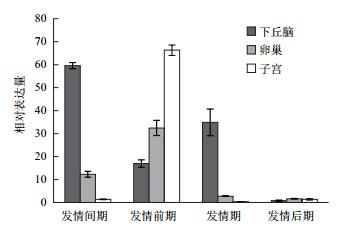
|
| 图 3 LEPRb在不同绵羊品种各组织相对表达变化 |
Leptin是主要由脂肪细胞分泌的多功能细胞因子,是联系机体生长发育和下丘脑促性腺激素释放激素释放系统的外周信号之一。大鼠的研究中发现leptin能显著刺激雄性大鼠下丘脑分泌GnRH[11, 12],使正中隆起弓状外植体释放促黄体素释放激素(LHRH),刺激垂体前叶释放FSH和LH[13],添加leptin可促进LHRH和LH的分泌[14]。leptin可以直接作用于卵巢,影响卵泡发育和排卵[15]。LEPR蛋白由一个细胞外结构域、一个小的疏水跨膜结构域和一个细胞内结构域组成,其中细胞内结构域的长短决定了受体亚型。长型受体LEPRb有完整的细胞内结构域,是leptin的功能性受体。目前研究已证实leptin长受体在大鼠和羊下丘脑[16-18]、垂体[16, 17, 19]和卵巢[20-22]中均有表达。Leptin及其受体的mRNA和蛋白在山羊卵泡中均有表达[23],且在牛小卵泡中表达量很高,并随着卵泡的生长和E2浓度的增加而显著下调,表明leptin对卵泡发育和卵母细胞成熟有潜在的调控作用[24]。在体外培养卵巢试验中,添加不同浓度的leptin均可以增加leptin受体的表达,且低leptin浓度促进孕酮分泌,高leptin浓度则抑制孕酮分泌[14]。在大鼠卵巢排卵过程的研究发现低浓度leptin促进排卵,高浓度抑制排卵。Luoh等[25]发现LEPRb是在下丘脑表达的主要受体亚型。人LEPRb突变会导致早发性病态肥胖,而且纯合型突变致使青春期停滞、生长激素和促甲状腺素的分泌减少[26]。LEPRb的表达变化可能改变了机体对leptin的敏感性。在ob/ob和db/db小鼠的研究中发现,主要的功能性受体LEPRb在弓状核中mRNA含量比+/ob小鼠高2.3倍。与注射生理盐水的对照组相比,ob/ob小鼠注射leptin后弓状核LEPRb mRNA含量下降30%。正常小鼠禁食48h后,弓状核LEPRb mRNA水平极显著升高。此外,禁食48 h的大鼠的LEPRb mRNA水平在弓状核和腹内侧核分别提高40%和75%[23]。
Leptin通过与其受体结合发挥抑制食欲、减少能量摄取、增加能量消耗和抑制脂肪合成等生物学功能。下丘脑是控制能量平稳的区域,而leptin在脂肪和能量代谢中起重要作用,因此下丘脑是leptin重要的靶器官,而LEPRb就是leptin在下丘脑发挥作用的连接点。本研究中发现除发情后期外,中国美利奴各组织LEPRb的表达水平都低于下丘脑,但在发情后期卵巢和子宫LEPRb的表达水平都显著高于下丘脑。Leptin及其受体的mRNA和蛋白在牛小卵泡中高水平表达,并随着卵泡的生长和E2浓度的增加而显著下调,表明leptin在卵泡发育和卵母细胞成熟方面存有潜在的调控作用[24],这与我们的研究结果相同。在同一组织内,两品种绵羊在不同时间同一组织的LEPRb的表达变化趋势和变化幅度有所差异。多浪羊中LEPRb在下丘脑组织的表达变化是从发情前期开始逐渐下降,作为性腺轴的下游靶器官卵巢和子宫中LEPRb的表达变化滞后于下丘脑,这与下丘脑和卵巢、子宫在性腺轴所处的位置相符。中国美利奴各组织LEPRb的表达变化略有不同,但卵巢和子宫LEPRb的表达水平在发情前期最高,呈现协同变化特点。下丘脑LEPRb的表达变化呈现出明显的品种特异性。在发情季节不同发情阶段中国美利奴各组织LEPRb的表达水平都高于常年发情的多浪羊,这与本研究血清leptin浓度检测的结果趋势相同[9]。
4 结论通过分析比较LEPRb在不同绵羊品种不同发情时期的不同组织中的表达变化,发现LEPRb的表达变化与绵羊发情存在相关关系,但具体的作用机制仍需要进一步的研究。
| [1] | Fruhbeck G. Intracellular signalling pathways activated by leptin. The Biochemical Journal, 2006, 393 (Pt 1): 7–20. |
| [2] | Houseknecht KL, Mantzoros CS, Kuliawat R, et al. Evidence for leptin binding to proteins in serum of rodents and humans: modulation with obesity. Diabetes, 1996, 45 (11): 1638–43. DOI:10.2337/diab.45.11.1638 |
| [3] | Tartaglia LA, Dembski M, Weng X, et al. Identification and expre-ssion cloning of a leptin receptor, OB-R. Cell, 1995, 83 (7): 1263–1271. DOI:10.1016/0092-8674(95)90151-5 |
| [4] | Catteau A, Caillon H, Barriere P, et al. Leptin and its potential interest in assisted reproduction cycles. Human Reproduction Update, 2016, 22 (3). |
| [5] | Chehab FF, Lim ME, Lu R. Correction of the sterility defect in homozygous obese female mice by treatment with the human recombinant leptin. Nature Genetics, 1996, 12 (3): 318–320. DOI:10.1038/ng0396-318 |
| [6] | Ahima RS, Dushay J, Flier SN, et al. Leptin accelerates the onset of puberty in normal female mice. The Journal of Clinical Investigation, 1997, 99 (3): 391–395. DOI:10.1172/JCI119172 |
| [7] | Di Yorio MP, Bilbao MG, Biagini-Majorel AM, et al. Ovarian signalling pathways regulated by leptin during the ovulatory process. Reproduction, 2013, 146 (6): 647–658. DOI:10.1530/REP-13-0257 |
| [8] | 石国庆, 茆达干, 程瑞禾, 等. 湖羊和新疆细毛羊妊娠早期内分泌比较. 南京农业大学学报, 2008, 31(1): 146–148. |
| [9] | 卢守亮, 高磊, 李辉, 等. 瘦素在不同绵羊品种中的分泌检测[C]. 第七次全国动物生物技术学术研讨会暨新疆畜牧科学院第六次学术年会. 2013. |
| [10] | 高磊, 甘尚权, 杨井泉, 等. 绵羊发情周期不同组织Cry1 mRNA转录水平相对定量研究. 遗传, 2013, 35(1): 85–92. |
| [11] | Woller M, Tessmer S, Neff D, et al. Leptin stimulates gonadotropin releasing hormone release from cultured intact hemihypothalami and enzymatically dispersed neurons. Experimental Biology and Medicine, 2001, 226 (6): 591–596. |
| [12] | Seth A, Stanley S, Jethwa P, et al. Galanin-like peptide stimulates the release of gonadotropin-releasing hormone in vitro and may mediate the effects of leptin on the hypothalamo-pituitary-gonadal axis. Endocrinology, 2004, 145 (2): 743–750. DOI:10.1210/en.2003-0873 |
| [13] | Yu WH, Walczewska A, Karanth S, et al. Nirtic oxide mediates leptin-induced luteinizing hormone releasing hormone. Endocrinology, 1997, 138 (11): 5055–5058. DOI:10.1210/endo.138.11.5649 |
| [14] | Di Yorio MP, Bilbao MG, Pustovrh MC, et al. Leptin modulates the expression of its receptors in the hypothalamic-pituitary-ovarian axis in a differential way. The Journal of Endocrinology, 2008, 198 (2): 355–66. DOI:10.1677/JOE-07-0622 |
| [15] | 张谊. 唐素与哺乳动物繁殖活动关系的研究进展. 中国畜牧兽医, 2015, 42(7): 1836–1841. |
| [16] | Di Yorio MP, MG Bilbao, Faletti AG. Neuropeptide Y regulates the leptin receptors in rat hypothalamic and pituitary explant cultures. Regulatory Peptides, 2014, 188 : 13–20. DOI:10.1016/j.regpep.2013.11.003 |
| [17] | Dyer CJ, Simmons JM, Matteri RL, et al. Leptin receptor mRNA is expressed in ewe anterior pituitary and adipose tissues and is differentially expressed in hypothalamic regions of well-fed and feed-restricted ewes. Domestic Animal Endocrinology, 1997, 14 (2): 119–128. DOI:10.1016/S0739-7240(96)00119-1 |
| [18] | Iqbal J, Pompolo S, Murakami T, et al. Immunohistochemical characterization of localization of long-form leptin receptor(OB-Rb)in neurochemically defined cells in the ovine hypothalamus. Brain Research, 2001, 920 (1-2): 55–64. DOI:10.1016/S0006-8993(01)02932-8 |
| [19] | Iqbal J, Pompolo S, Considine RV, et al. Localization of leptin receptor-like immunoreactivity in the corticotropes, somatotropes, and gonadotropes in the ovine anterior pituitary. Endocrin-ology, 2000, 141 (4): 1515–1520. DOI:10.1210/endo.141.4.7433 |
| [20] | Ryan NK, Van der Hoek KH, Robertson SA, et al. Leptin and leptin receptor expression in the rat ovary. Endocrinology, 2003, 144 (11): 5006–5013. DOI:10.1210/en.2003-0584 |
| [21] | Munoz-Gutierrez M, Findlay PA, Adam CL, et al. The ovarian expression of mRNAs for aromatase, IGF-I receptor, IGF-binding protein-2, -4 and -5, leptin and leptin receptor in cycling ewes after three days of leptin infusion. Reproduction, 2005, 130 (6): 869–81. DOI:10.1530/rep.1.00557 |
| [22] | Pisani LF, Antonini S, Pocar P, et al. Effects of pre-mating nutrition on mRNA levels of developmentally relevant genes in sheep oocytes and granulosa cells. Reproduction, 2008, 136 (3): 303–312. DOI:10.1530/REP-07-0394 |
| [23] | Batista AM, Silva DM, Rêgo MJ, et al. The expression and localization of leptin and its receptor in goat ovarian follicles. Animal Reproduction Science, 2013, 141 (3-4): 142–147. DOI:10.1016/j.anireprosci.2013.08.007 |
| [24] | Sarkar M, Schilffarth S, Schams D, et al. The expression of leptin and its receptor during different physiological stages in the bovine ovary. Molecular Reproduction and Development, 2010, 77 (2): 174–81. |
| [25] | Luoh SM, Di Marco F, Levin N, et al. Cloning and characterization of a human leptin receptor using a biologically active leptin immunoadhesin. Journal of Molecular Endocrinology, 1997, 18 (1): 77–85. DOI:10.1677/jme.0.0180077 |
| [26] | Clement K, Vaisse C, Lahlou N, et al. A mutation in the human leptin receptor gene causes obesity and pituitary dysfunction. Nature, 1998, 392 (6674): 398–401. DOI:10.1038/32911 |





