碱性亮氨酸拉链(Basic leucine zipper,bZIP)转录因子是真核生物中最保守、分布最广泛的一类转录因子。目前,科学家们已经在拟南芥、大豆、水稻等多个物种的基因组中发现了大量的bZIP转录因子家族成员[1-3]。这些不同家族的bZIP转录因子成员广泛参与植物的生长发育、光信号转导、病菌防御、对逆境胁迫的响应、花的发育、叶片衰老、种子成熟和植物激素信号转导等多种生物学过程[4-7]。
近年来的研究表明,bZIP转录因子家族成员FD(bZIP14) 及其同源基因FDP在植物开花控制过程中发挥重要作用,拟南芥fd突变体表现出非常明显的晚花表型[8, 9],FD蛋白主要在顶端分生组织中表达。植物开花素蛋白FT在叶片中合成,经维管束的长距离运输到达顶端分生组织,促进开花[10]。目前,已经在一些物种中证实,其FD同源蛋白与FT同源蛋白在顶端分生组织形成复合体发挥作用。玉米中,bZIP转录因子蛋白DLF1与玉米中FT的同源蛋白ZCN8在酵母中相互作用[11, 12]。水稻中过表达OsFD1与水稻FT同源蛋白Hd3a能够上调花分生组织识别基因OsMADS15的表达[13, 14]。但是,这些FD同源蛋白与FT同源蛋白之间并不存在直接的相互作用,而是需要14-3-3蛋白的介导形成复合体。其中FT与14-3-3互作的证据主要来自番茄和水稻中同源蛋白的相互作用。番茄中,14-3-3的一个亚型14-3-3/74与番茄中FT的同源基因SP在酵母中直接相互作用,过表达番茄14-3-3能够恢复SP缺失的表型[15]。在水稻中发现的8个14-3-3家族成员中,有4个与水稻FT的同源基因Hd3a相互作用。如果同时下调这4个水稻14-3-3蛋白的表达量,那么,因过表达Hd3a与OsFD1被上调的OsMADS15的表达量也会在一定程度上降低[16]。目前,FD与14-3-3互作的证据主要来自水稻同源蛋白。14-3-3蛋白识别的特异序列通常是R/K-S-X-P或者R/K-X-X-S-P,在水稻中14-3-3蛋白正是与水稻OsFD1的C末端SAP结构域直接相互作用[14]。但是在拟南芥中,FD是否与14-3-3/GRFs之间存在直接的相互作用目前还不清楚,基于此,本研究利用酵母双杂交和双分子荧光互补技术来研究FD与14-3-3/GRF7之间的相互作用,旨为FT-14-3-3-FD蛋白复合体的存在提供更多的证据。
1 材料与方法 1.1 材料酵母菌株AH109、酵母双杂交载体PGADT7和PGBKT7、酵母转化试剂、酵母培养基均购于Clontech公司;pCRTM8克隆试剂盒(K2520-20) 和LR重组试剂盒(11791020) 购自Invitrogen公司。
1.2 方法 1.2.1 酵母双杂交载体的构建使用FD基因特异性引物,cDNA作为模板扩增得到FD全长基因,利用pCRTM8克隆试剂盒将其构建到入门载体pCRTM8上,转化大肠杆菌DH5α,菌落PCR和测序鉴定后获得FD入门载体(FD-pCRTM8)。将FD-pCRTM8分别与目标载体PGADT7和PGBKT7利用LR重组试剂盒进行LR重组,转化大肠杆菌DH5α,菌落PCR和测序鉴定获得目标载体FD/PGADT7(FD-AD)和FD/PGBKT7(FD-BD)。
1.2.2 酵母双杂交试验将0.5 µg FD-BD和0.5 µg 14-3-3/GRF7-AD共同加入到酵母感受态细胞中,室温孵育过夜。42℃水浴中热激30 min。冰上放置1-2 min。取适量酵母转化液涂布在-Leu/-Trp双缺固体培养基上,30℃培养箱中培养2-4 d直至克隆长出。各个对照组也利用上述方法进行转化。待酵母克隆长至合适大小,挑取酵母单克隆溶于50-100 µL无菌水中,各吸取10 µL滴在-Leu/-Trp/-His/-Ade四缺固体培养基上,培养2-4 d观察菌落生长情况。
1.2.3 BiFC载体的构建利用LR重组试剂盒,将入门载体FD-pCRTM8和14-3-3/GRF7-pCRTM8分别与BiFC系统目标载体px-nYFP和px-cYFP重组,转化大肠杆菌DH5α,菌落PCR鉴定和测序鉴定,获得正确的目标载体后转化农杆菌GV3101。
1.2.4 烟草注射与荧光信号的观察分别接种要注射的农杆菌于5 mL LB液体培养基中摇培过夜,室温离心收集菌体,用注射缓冲液(10 mmol/L MES,pH5.6;10 mmol/L MgCl2,150 µmol/L acetosyringone)洗涤2-3次,每次离心3 000 r/min。利用注射缓冲液重悬菌体至OD600约为0.6-0.8,室温缓慢摇培2-4 h。取等体积的两种农杆菌液体混匀,用去掉针头的注射器将混匀的农杆菌菌液缓慢注射入烟草叶片下表皮,并做好标记。注射好的烟草放回培养室培养36-48 h。取生长良好的烟草叶片,距针孔周围5 mm处剪下大约5 mm的叶片,平放在载玻片上,用荧光显微镜观察和拍照。
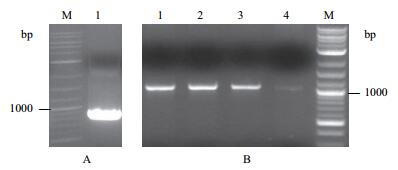
2 结果 2.1 酵母双杂交载体的构建使用FD基因特异性引物扩增得到858 bp的FD全长基因(图 1-A),利用pCRTM8克隆试剂盒将其构建到入门载体pCRTM8上,菌落PCR和测序鉴定后获得FD入门载体(FD-pCRTM8)(图 1-B)。将FD-pCRTM8与目标载体PGBKT7利用LR重组试剂盒进行重组,获得目标载体FD/PGBKT7(FD-BD)。
|
| 图 1 FD-pCRTM8入门载体的构建 A: FD基因的扩增;M: DNA分子量标准;1: FD基因,B: FD-pCRTM8载体的菌落PCR鉴定结果;M: DNA分子量标准;1-4:不同的菌落 |
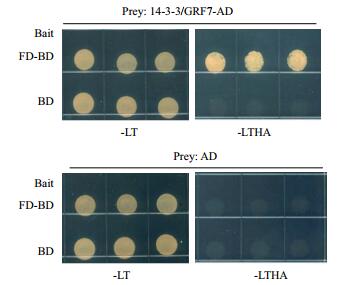
将FD-BD与14-3-3/GRF7-AD共转化酵母AH109感受态细胞,同时共转化AD与BD,AD与FD-BD,14-3-3/GRF7-AD与BD作为阴性对照。转化后将酵母细胞涂布于-Leu/-Trp双缺培养基上培养2-4 d。待酵母克隆长至合适大小,从每个平板上挑取3个酵母单克隆分别溶于50-100 µL无菌水中,各吸取10 µL滴在-Leu/-Trp/-His/-Ade四缺培养基上,培养2-4 d观察菌落生长情况,相同的酵母菌液同时滴在-Leu/-Trp双缺培养基上作为对照。生长2-4 d后,在保证酵母菌落在双缺培养基上生长良好的情况下,观察-Leu/-Trp/-His/-Ade四缺培养基上酵母菌落生长情况。共转化AD与BD,AD与FD-BD,14-3-3/GRF7-AD与BD的酵母菌落在-Leu/-Trp/-His/-Ade四缺培养基上都没有生长,而共转化FD-BD与14-3-3/GRF7-AD的酵母菌落与阴性对照相比,生长良好(图 2)。结果表明,FD与14-3-3/GRF7在酵母中直接相互作用。
|
| 图 2 FD与14-3-3/GRF7在酵母中直接相互作用 |
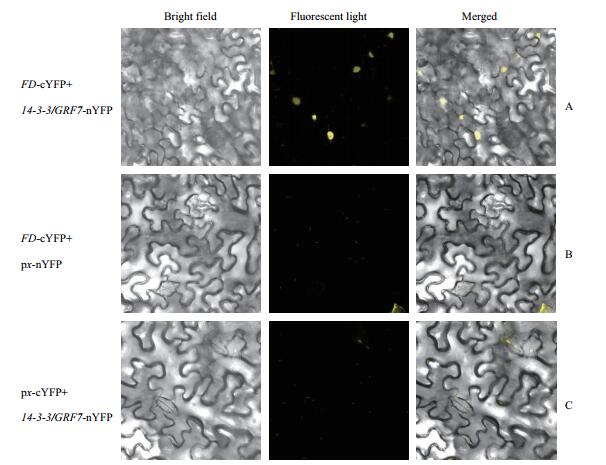
在酵母中验证了FD与14-3-3/GRF7的相互作用之后,又进一步利用BiFC技术验证FD与14-3-3/GRF7在烟草细胞中是否直接相互作用。首先将FD与YFP的C端(cYFP)融合,14-3-3/GRF7与YFP的N端(nYFP)融合获得FD-cYFP和14-3-3/GRF7-nYFP融合载体。通过农杆菌介导的转染技术将转化有FD-cYFP与14-3-3/GRF7-nYFP的农杆菌菌液共注射到烟草叶表皮细胞中,36-48 h内在激光共聚焦显微镜下观察荧光表达情况。转化FD-cYFP与14-3-3/GRF7-nYFP载体的农杆菌共注射烟草细胞之后,在细胞核内观察到很强的荧光信号(图 3-A)。而转化FD-cYFP载体与px-nYFP(空载体)的农杆菌共注射烟草细胞之后没有观察到荧光信号(图 3-B);转化px-cYFP(空载体)与14-3-3/GRF7-nYFP载体的农杆菌共注射烟草细胞之后也没有观察到荧光信号(图 3-C)。
|
| 图 3 FD-cYFP与14-3-3/GRF7-nYFP在烟草中直接相互作用 A: FD-cYFP与14-3-3/GRF7-nYFP在烟草中直接相互作用;B,C:对照组 |
为排除标签的影响,试验中又做了标签互换,将FD与YFP的N端(nYFP)融合,14-3-3/GRF7与YFP的C端(cYFP)融合,获得FD-nYFP和14-3-3/GRF7-cYFP融合载体。结果显示,转化FD-nYFP与14-3-3/GRF7-cYFP载体的农杆菌共注射烟草细胞之后仍然在细胞核内观察到很强的荧光信号(图 4-A);而转化FD-nYFP载体与px-cYFP(空载体)的农杆菌共注射烟草细胞之后没有观察到荧光信号(图 4-B);转化px-nYFP(空载体)与14-3-3/GRF7-cYFP载体的农杆菌共注射烟草细胞之后也没有观察到荧光信号(图 4-C)。

|
| 图 4 FD-nYFP与14-3-3/GRF7-cYFP在烟草中直接相互作用 A: FD-nYFP与14-3-3/GRF7-cYFP在烟草中直接相互作用;B,C:对照组 |
综上所述,FD-cYFP和14-3-3/GRF7-nYFP在烟草细胞中共注射时,在细胞核内能观察到很强的绿色荧光信号;FD-nYFP和14-3-3/GRF7-cYFP在烟草细胞中共注射时同样在细胞核内观察到很强的绿色荧光信号。由此说明,在烟草细胞中FD与14-3-3/GRF7之间存在直接相互作用。
3 讨论蛋白质作为生物体生命活动的主要承担者,几乎参与细胞中的每一个生理过程,诸如DNA包装、基因表达调控、细胞信号转导等。在蛋白质组学方面,关于蛋白质相互作用的研究是一个重点。蛋白间的相互作用会产生蛋白复合体,调控生物体的生命活动,研究蛋白质间的相互作用是了解生物体生命活力过程的关键。关于蛋白质相互作用的研究手段很多,如酵母双杂交(YTH)、双分子荧光互补(BiFC)、凝胶孵育(Overlay)、免疫共沉淀(Co-IP)等,这些技术各有其优缺点,互为补充。我们利用酵母双杂交和双分子荧光互补两种技术共同证实了植物开花调控途径中的转录因子FD和14-3-3/GRF7之间存在直接的相互作用。
植物的开花过程是一个受众多因素调控的复杂过程。关于植物开花方面的研究一直是生物学领域研究的重点和难点,取得了很多重要的研究进展,但仍然存在很多未解决的问题。已有研究表明,植物的开花时间由光周期途径、春化途径、自主途径和赤霉素途径这4条途径交互作用控制。在这些途径的交汇节点处发挥关键作用的是一对同源基因FT与TFL1,二者发挥相反的作用,FT促进开花,TFL1抑制开花[17]。FT蛋白被称作开花素,过去很长一段时间,人们认为FT蛋白是转录因子,直接调控下游基因的表达。直到后来人们才发现FT本身不是转录因子,而是在植物顶端分生组织处与转录因子FD形成蛋白复合体共同调控下游基因的表达[8, 9]。近年来的研究结果又进一步在水稻中证实FT同源蛋白Hd3a与水稻FD蛋白复合体的形成需要14-3-3蛋白的介导[14]。本研究证实拟南芥中FD和14-3-3/GRF7直接互作,为拟南芥FT-14-3-3-FD蛋白复合体的存在提供了更多的证据。14-3-3蛋白也被称作生长调节因子(GRFs),广泛参与多种信号转导通路以及介导多种信号通路之间的交互作用。14-3-3蛋白可以与多种蛋白结合,并且通常与磷酸化的蛋白结合,通过改变这些蛋白的活性、亚细胞定位、稳定性等发挥作用[18]。如在植物激素BR信号转导通路中,14-3-3蛋白与磷酸化状态的转录因子BZR1结合后,使BZR1滞留在细胞质中而不能进入细胞核调控下游基因表达[19]。那么,在植物开花调控中,14-3-3蛋白是否也通过改变FD或者FT蛋白的定位来发挥作用,其参与开花调控的分子机制目前还不清楚。此外,拟南芥中的FD蛋白第282位苏氨酸(T282) 可以被CPKs蛋白激酶家族成员CPK33和CPK6磷酸化[20],因此T282是否参与FD蛋白与14-3-3蛋白GRF7的互作目前也不清楚。这些问题都值得进一步深入研究与探索,也将是我们今后工作的方向和重点。
4 结论本研究构建了FD和14-3-3/GRF7基因的酵母双杂交载体,利用酵母双杂交技术证实了FD与14-3-3/GRF7之间存在直接的相互作用。其次,构建了FD与14-3-3/GRF7基因的双分子荧光互补系统载体,利用双分子荧光互补技术也证实了FD和14-3-3/GRF7之间存在直接的相互作用。两种技术互为补充,互相印证,更加确定了结果的真实可靠。
| [1] | Wei KF, Chen J, Wang YM, et al. Genome-wide analysis of bZIP-encoding genes in maize. DNA Res, 2012, 19 (6): 463–476. DOI:10.1093/dnares/dss026 |
| [2] | 杨颖, 高世庆, 唐益苗, 等. 植物bZIP转录因子的研究进展. 麦类作物学报, 2009, 29(4): 730–737. |
| [3] | 张计育, 渠慎春, 郭忠仁, 等. 植物bZIP转录因子的生物学功能. 西北植物学报, 2011, 31(5): 1066–1075. |
| [4] | Zheng CL, Halaly T, Acheampong AK, et al. Abscisic acid(ABA)regulates grape bud dormancy, and dormancy release stimuli may act through modification of ABA metabolism. Journal of Experimental Botany, 2015, 66 (5): 1527–1542. DOI:10.1093/jxb/eru519 |
| [5] | Lee J, He K, Stolc V, et al. Analysis of transcription factor HY5 genomic binding sites revealed its hierarchical role in light regulation of development. Plant Cell, 2007, 19 (3): 731–749. DOI:10.1105/tpc.106.047688 |
| [6] | Rodriguez-Uribe L, O'Connell MA. A root-specific bZIP transcription factor is responsive to water deficit stress in tepary bean(Phaseolus acutifolius)and common bean(P-vulgaris). Journal of Experimental Botany, 2006, 57 (6): 1391–1398. DOI:10.1093/jxb/erj118 |
| [7] | Wang YC, Gao CQ, Liang YN, et al. A novel bZIP gene from Tamarix hispida mediates physiological responses to salt stress in tobacco plants. J Plant Physiol, 2010, 167 (3): 222–230. DOI:10.1016/j.jplph.2009.09.008 |
| [8] | Abe M, Kobayashi Y, Yamamoto S, et al. FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex. Science, 2005, 309 (5737): 1052–1056. DOI:10.1126/science.1115983 |
| [9] | Wigge PA, Kim MC, Jaeger KE, et al. Integration of spatial and temporal information during floral induction in Arabidopsis. Science, 2005, 309 (5737): 1056–1059. DOI:10.1126/science.1114358 |
| [10] | Wickland DP, Hanzawa Y. The FLOWERING LOCUS T/TERMIN-AL FLOWER 1 gene family: functional evolution and molecular mechanisms. Mol Plant, 2015, 8 (7): 983–997. DOI:10.1016/j.molp.2015.01.007 |
| [11] | Lazakis CM, Coneva V, Colasanti J. ZCN8 encodes a potential orthologue of Arabidopsis FT florigen that integrates both endogenous and photoperiod flowering signals in maize. J Exp Bot, 2011, 62 (14): 4833–4842. DOI:10.1093/jxb/err129 |
| [12] | Meng X, Muszynski MG, Danilevskaya ON. The FT-like ZCN8 gene functions as a floral activator and is involved in photoperiod sensitivity in maize. Plant Cell, 2011, 23 (3): 942–960. DOI:10.1105/tpc.110.081406 |
| [13] | Kojima S, Takahashi Y, Kobayashi Y, et al. Hd3a, a rice ortholog of the Arabidopsis FT gene, promotes transition to flowering downstream of Hd1 under short-day conditions. Plant Cell Physiol, 2002, 43 (10): 1096–1105. DOI:10.1093/pcp/pcf156 |
| [14] | Taoka K, Ohki I, Tsuji H, et al. 14-3-3 proteins act as intracellular receptors for rice Hd3a florigen. Nature, 2011, 476 (7360): 332–335. DOI:10.1038/nature10272 |
| [15] | Pnueli L, Gutfinger T, Hareven D, et al. Tomato SP-interacting proteins define a conserved signaling system that regulates shoot architecture and flowering. Plant Cell, 2001, 13 (12): 2687–2702. DOI:10.1105/tpc.13.12.2687 |
| [16] | Purwestri YA, Ogaki Y, Tamaki S, et al. The 14-3-3 Protein GF14c acts as a negative regulator of flowering in rice by interacting with the florigen Hd3a. Plant And Cell Physiology, 2009, 50 (3): 429–438. DOI:10.1093/pcp/pcp012 |
| [17] | Coelho CP, Minow MA, Chalfun A, et al. Putative sugarcane FT/TFL1 genes delay flowering time and alter reproductive architecture in Arabidopsis. Frontiers In Plant Science, 2014, 5 : 221. |
| [18] | Roberts MR. 14-3-3 Proteins find new partners in plant cell signalling. Trends In Plant Science, 2003, 8 (5): 218–223. DOI:10.1016/S1360-1385(03)00056-6 |
| [19] | Gampala SS, Kim TW, He JX, et al. An essential role for 14-3-3 proteins in brassinosteroid signal transduction in Arabidopsis. Developmental Cell, 2007, 13 (2): 177–189. DOI:10.1016/j.devcel.2007.06.009 |
| [20] | Kawamoto N, Sasabe M, Endo M, et al. Calcium-dependent protein kinases responsible for the phosphorylation of a bZIP transcription factor FD crucial for the florigen complex formation. Sci Rep, 2015, 5 : 8341. DOI:10.1038/srep08341 |



