与酒精、吗啡、大麻、可卡因等致瘾性药物相似,反复抽吸含有烟碱的卷烟,也能导致成瘾。卷烟烟气中,烟碱是引起习惯性抽烟的主要成分,也是吸烟致瘾的主要原因[1, 2]。但是,烟碱成瘾相关的分子机制尚不清楚,需要对烟碱成瘾相关分子机制展开进一步研究。研究表明,反复接触致瘾性药物可以诱导脑部特定区域蛋白质表达水平的改变,这种表达的改变将介导个体神经元和神经通路的改变,进而导致成瘾[3, 4]。已有研究表明烟碱可以诱导大鼠前额皮质、杏仁核、伏隔核和纹状体区域发动蛋白、层粘连蛋白受体,醛缩酶、α-烯醇酶1和N-马来亚酰胺融合蛋白显著差异表达[5, 6]。因此,研究成瘾蛋白质表达水平的变化,可以为研究成瘾相关的分子机制提供重要的数据支撑和理论解释。
目前各种分子技术已被用来研究与药物成瘾相关蛋白质表达的变化。蛋白组学技术可以整体获得药物成瘾过程中蛋白质组的动态变化,为更好的理解药物成瘾的分子机制提供强有力的工具[7]。细胞模型可以简化模型的复杂程度,观察单一类型细胞蛋白质的变化,鉴定一些在成瘾中发挥重要作用的低丰度蛋白,而且实验条件可控,如温度、烟碱浓度和暴露时间[8],烟碱诱导蛋白质分子水平地改变更容易检测。
因此,本研究使用人神经母瘤细胞(SH-SY5Y)作为体外研究烟碱成瘾相关蛋白质表达的细胞系。以同位素相对标记与绝对定量(iTRAQ)蛋白组学技术通过nao-LC-Q-TOF分离鉴定烟碱诱导组和对照组蛋白表达的差异,最终,通过生物信息学分析差异表达蛋白质的细胞组成、生物过程、生物功能和参与的相关信号通路(图 1),结果将有助于理解调控烟碱成瘾相关的生物过程。
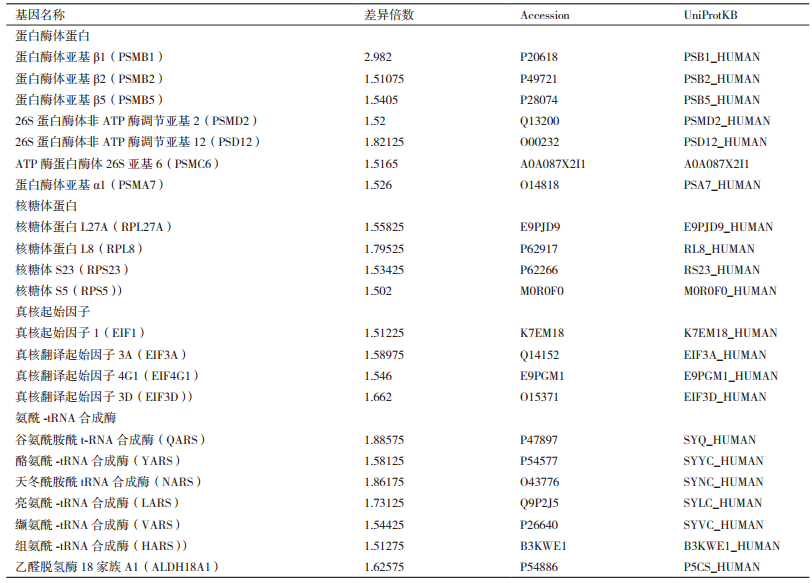
|
| 图 1 烟碱诱导SH-SY5Y细胞蛋白质差异表达的分析流程 |
材料:SH-SY5Y(美国ACTT细胞库)。
试剂:DMEM培养基和青链霉素(美国Hyclone公司);优级胎牛血清(美国Gibco公司);PBS,二硫苏糖醇(DTT),碘乙酰胺(IAA),四乙铵(TEAB)(美国Sigma公司);乙腈(ACN)、尿素、甲酸(FA)、质谱级胰酶和N-PER神经蛋白提取液(Promega公司);iTRAQ试剂盒(美国AB Sciex公司);仪器:Nano-LC9(Thermo)-Q-TOF MS(德国Bruker),多功能酶标仪(美国Molecular Devices),真空冷冻干燥机(德国CHRIST)。
1.2 方法 1.2.1 细胞培养和收集细胞接种后,在37℃、5% CO2条件下培养,使用含有10%血清和1%双抗的DMEM培养基,当细胞的融合度达到80%时随机分为实验组和对照组各3瓶分别在有无1 mmol/L的烟碱培养基中培养1 h后,酶解消化收集,使用磷酸缓冲盐溶液(PBS)清洗后加入蛋白提取液,BCA法蛋白定量。
1.2.2 蛋白定量标记分别取100 μg细胞全蛋白每组做2次重复实验,定容到30 μL;加3倍体积(0.01 mol/L DTT、8 mol/L尿素、0.1 mol/L Tris-HCL(pH8.5))的还原剂,37℃水浴1 h;加入与还原剂等体积的烷基化试剂(0.05 mol/L IAA、8 mol/L尿素、0.1 mol/L Tris-HCL(pH8.5))室温避光20 min;将蛋白溶液移入10 kD的超滤管中离心40 min(12 000×g,4℃),将未反应液体全部离心;向每个超滤管中加入150 μL的0.3 mol/L TEAB离心40 min(12 000×g,4℃),将未反应的液体全部离心下去,重复3次;然后按20:1比例加入胰蛋白酶37℃酶解16 h;将酶切好的样品室温下离心10 min(12 000×g,4℃),加100 μL的0.2 mol/L TEAB,室温离心20 min(12 000×g),重复上述步骤2次;酶解消化后的肽段溶液离心于收集管底;冷冻干燥后,向其中加入100 μL 0.2 mol/L TEAB使其浓度为1 μg/μL充分混匀,向4管对应iTRAQ标签(分子量分别为114、115、116和117的标签)中加入200 μL乙醇,115、116标记对照组,114、117标记实验组;室温反应2 h,加400 μL色谱水终止反应30 min;混合后经sep-park C18柱除盐,冻干。
1.2.3 肽段液相分离将冻干后的样品用0.1%甲酸水溶液复溶上到Trap柱(100 μm×2 cm,C18,5 μm),由流动相A(0.1%甲酸水)和B(0.1%甲酸乙腈)经梯度(表 1)洗脱到分析柱(75 μm×50 cm,C18,2 μm)。
液相色谱分离后进入Q-TOF MS(Bruker)鉴定。采用CaptiveSpray离子源,在正离子模式下,毛细管电压为4 500 V,干燥气体流速为4.0 L/min,干燥温度为180℃,固定循环扫描时间为3 s,质谱全扫描质量范围50-2 200 m/z,二级质谱全扫描质量范围50-2 200 m/z,碰撞能量范围为23-65 eV进行信号采集。
1.2.5 数据库检索使用Mascot(Version 2.4.1)搜索引擎对Uniprot-human数据库搜库。搜库参数:最大漏切位点数2;半胱氨酸脲甲基化固定修饰、蛋氨酸可变氧化修饰、N端乙酰化可变修饰;定量:iTRAQ 4标;肽端允许误差:20 ppm;MS/MS允许误差:0.1 Da,显著阈值:P < 0.05。
1.2.6 定量蛋白质组学和生物信息学分析利用iTRAQ定量的比值(代表实验组/对照组平均值表达量比值的4个ratio值的平均值)筛选出暴露组和对照组的差异表达的蛋白。使用DAVID对差异蛋白质进行生物过程,细胞组成,生物功能进行分析,KEGG进行生物通路分析。搜索STRING数据库并构建差异蛋白互作模型。
2 结果 2.1 蛋白质组鉴定和iTRAQ定量分析对1 mmol/L烟碱暴露1 h的SH-SY5Y进行iTRAQ差异蛋白组学分析,在烟碱暴露组和实验组中共鉴定到1 316种蛋白质,其中1 273种蛋白有定量信息,iTRAQ标记效率为96.7%,表明标记效率良好。对照组两次重复标记定量蛋白比值95%的置信区间分布在(1.091,1.147);实验组两次重复标记定量蛋白比值95%的置信区间分布在(1.099,1.142),表明重复性好,实验结果可靠。由于体系偏差的存在,为减少假阳性的结果,至少选择有两个定量肽段、|比值|≥1.5倍且单样本t检验P < 0.05的蛋白为差异蛋白,共筛选出132种差异蛋白。
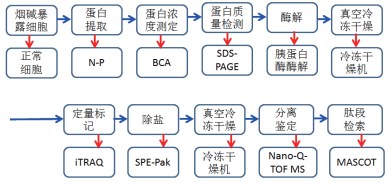
2.2 差异蛋白功能分类分析使用DAVID软件依据Gene Ontology条目对132个差异蛋白进行GO分析,这些蛋白质显著富集了58种生物学过程,30种细胞组成和22种分子功能。显著富集的细胞位置主要包括胞外体(45.54%),细胞质(43.56%),核(43.56%),膜(36.63%),线粒体(20.79%)和蛋白酶体复合物(8.91%)等(图 2)。根据分子功能注释(图 3)显著富集的分子功能主要为结合蛋白质和活性蛋白质。根据生物过程注释(图 4),主要的生物过程为小分子代谢(27.7%),基因表达(25.7%),细胞氮化合物代谢过程(16.8%)和病毒过程(15.8%),此外还有GTP调节信号传导(12.8%),MAPKK激活(6.9%),MAPK级联(6.9%)和神经营养因子TRK信号通路(6.9%)等生物过程(图 4)。

|
| 图 2 差异蛋白亚细胞定位 |
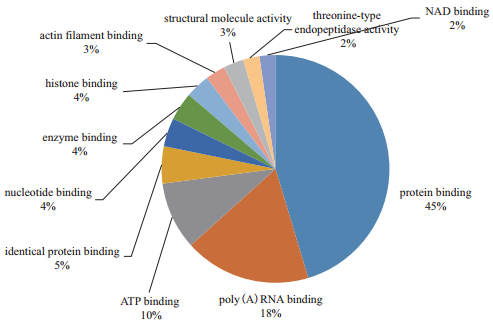
|
| 图 3 差异蛋白分子功能分析 |
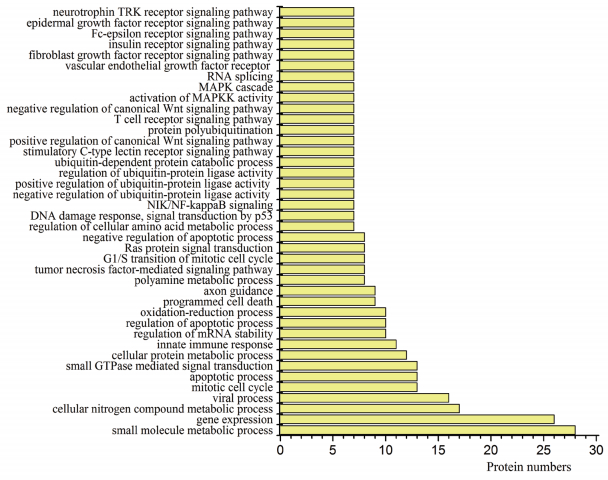
|
| 图 4 差异蛋白生物过程分析 |
对上述132种显著差异表达的蛋白质进行KEGG分析,参与的生物通路主要包括代谢途径,泛素化-蛋白酶体通路,精氨酸和脯氨酸代谢,系统性红斑狼仓和氨酰tRNA生物合成。此外,还有与细胞外粘附,连接相关的通路,和细胞内质网蛋白质加工,谷胱甘肽代谢,RNA转运,肌动蛋白细胞骨架,钙信号通路和cGMP-PKG信号通路,及神经疾病相关的酒精成瘾和亨廷顿病相关的通路。
2.4 差异蛋白互作分析对上述132显著差异的蛋白质进行STRING蛋白质互作分析,117个蛋白质均与STRING数据库中的蛋白质匹配(图 5)。该网络以(图 5红色圈出蛋白)蛋白酶体家族、核糖体蛋白家族、真核翻译起始因子、氨酰t-RNA合成酶和乙醛脱氢酶18家族A1(表 2)等蛋白质为中心,向四周扩散,在烟碱诱导的神经元细胞蛋白质的表达中发挥重要作用。

|
| 图 5 差异蛋白互作网络分析 |
根据生物信息学分析的结果,位于互作网图交汇点的差异表达蛋白包括蛋白酶体家族,核糖体蛋白家族,真核翻译起始因子,氨酰-tRNA合成酶和乙醛脱氢酶18家族A1。差异表达的蛋白酶体蛋白主要包括PSMB1、PSMB2、PSMB5、PSMD2、PSMD12、PSMC6和PSMA1,这与Kane等[11]发现烟碱诱导大鼠前额皮质中蛋白酶体显著差异表达结果相似。这些差异表达的蛋白酶体蛋白主要参与MAPK级联生物过程和泛素-蛋白酶体通路。烟碱通过α7nAChR乙酰胆碱受体诱导MAPK级联反应[12-14],能够进一步激活其下游的长时程增强效应和长期记忆[15, 16];泛素化-蛋白酶体通路中, 蛋白酶体能够识别并清除泛素化的蛋白,维持烟碱诱导生物体产生蛋白质的稳态[11, 17],长期的烟碱暴露将导致神经元突触可塑性[18]。差异表达的核糖体蛋白主要包括L27A、L8、L31、S23和S5,这与烟碱暴露小鼠皮层神经元的研究中发现一致[19]。差异表达的核糖体蛋白和酰胺酰t-RNA合成酶主要参与蛋白质的合成,这可能是由于蛋白合成上游的信号级联反应如蛋白激酶C和PI3K信号通路被烟碱抑制[19]。在安非他命急性诱导小鼠大脑区域的研究中,氨酰t-RNA合成酶基因同样存在差异表达,影响安非他命依赖[20]。因此,酰胺酰t-RNA合成酶对烟碱依赖的形成影响值得进一步的研究。值得注意的是,本研究发现的ALDH18A1显著差异表达,尚未见相关报道。多项研究指出,乙醛与烟碱共同暴露增强大鼠的烟碱依赖程度[21],由于ALDH18A1是乙醛氧化为乙酸反应的催化剂,ALDH18A1可能在烟碱和乙醛的协同依赖中发挥重要作用。
在神经退行性疾病的通路中,差异蛋白的表达包括超氧化物歧化酶(SOD1)、电压依赖阴离子通道1(VDAC1)和电压依赖阴离子通道3(VDAC3)。研究表明,烟碱对突触前后信号调节与神经退行性疾病亨廷顿病,帕金森综合症显著相关[22, 23]。SOD1过表达在神经退行性疾病中具有保护作用,影响生物体氧化防御系统[24, 25];VDAC1和VDAC3蛋白家族位于线粒体外膜上,VDAC缺失小鼠的学习能力和突触可塑性都有所减弱[26];另外,VDAC蛋白通过偶联乙酰胆碱受体,影响烟碱与烟碱乙酰胆碱受体的结合[27]。目前,烟碱对SOD1、VDAC1和VDAC3蛋白表达的影响还未见报道。
4 结论本研究通过iTRAQ蛋白组学技术初步鉴定了烟碱诱导神经元蛋白质的差异表达,共鉴定筛选出132个差异表达蛋白,差异表达的蛋白质中蛋白酶体、真核翻译起始因子、氨酰-tRNA合成酶核糖体蛋白、ALDH18A1位于蛋白质互作的中心,在烟碱诱导神经元蛋白质的表达中发挥重要作用。但烟碱诱导差异表达的蛋白在神经元中的作用仍需要进一步验证,这些差异表达的蛋白在烟碱依赖的形成中如何发挥作用的,仍需要动物成瘾模型进行进一步的评估。
| [1] | Subramaniyan M, Dani JA. Dopaminergic and cholinergic learning mechanisms in nicotine addiction. Annals of the New York Academy of Sciences, 2015, 1349 (1): 46–63. DOI:10.1111/nyas.12871 |
| [2] | Prochaska JJ, Benowitz NL. The Past, present, and future of nicotine addiction therapy. Annual Review of Medicine, 2015, 67 (1): 411–420. |
| [3] | Wong CC, Mill J, Fernandes C. Drugs and addiction: an introduction to epigenetics. Addiction, 2011, 106 (3): 480–490. DOI:10.1111/add.2011.106.issue-3 |
| [4] | Renthal W, Nestler EJ. Chromatin regulation in drug addiction and depression. Dialogues in Clinical Neuroscience, 2009, 11 (3): 257–268. |
| [5] | Hwang YY, Li MD. Proteins differentially expressed in response to nicotine in five rat brain regions: Identification using a 2-DE/MS-based proteomics approach. Proteomics, 2006, 6 (10): 3138–3153. DOI:10.1002/(ISSN)1615-9861 |
| [6] | Yeom M, Shim I, Lee HJ, et al. Proteomic analysis of nicotine-associated protein expression in the striatum of repeated nicotine-treated rats. Biochem Biophys Res Commun, 2005, 326 (2): 321–328. DOI:10.1016/j.bbrc.2004.11.034 |
| [7] | Hemby SE. Cocainomics: new insights into the molecular basis of cocaine addiction. Journal of Neuroimmune Pharmacology, 2010, 5 (1): 70–82. DOI:10.1007/s11481-009-9189-8 |
| [8] | Bodzon-Kulakowska A, Suder P, Mak P, et al. Proteomic analysis of striatal neuronal cell cultures after morphine administration. J Sep Sci, 2009, 32 (8): 1200–1210. DOI:10.1002/jssc.v32:8 |
| [9] | Benowitz NL. Nicotine addiction. The New England Journal of Medicine, 2010, 362 (24): 311–631. |
| [10] | Dajas-Bailador F, Wonnacott S. Nicotinic acetylcholine receptors and the regulation of neuronal signalling. Trends in Pharmacological Sciences, 2004, 25 (6): 317–324. DOI:10.1016/j.tips.2004.04.006 |
| [11] | Kane JK, Konu Ö, Ma JZ, et al. Nicotine coregulates multiple pathways involved in protein modification/degradation in rat brain. Molecular Brain Research, 2004, 132 (2): 181–191. DOI:10.1016/j.molbrainres.2004.09.010 |
| [12] | Arora K, Cheng J, Nichols RA. Nicotinic acetylcholine receptors sensitize a MAPK-linked toxicity pathway on prolonged exposure to β-Amyloid. Journal of Biological Chemistry, 2015, 290 (35): 21409–21420. DOI:10.1074/jbc.M114.634162 |
| [13] | Schaal C, Chellappan SP. Nicotine-mediated cell proliferation and tumor progression in smoking-related cancers. Molecular Cancer Research, 2014, 12 (1): 14–23. DOI:10.1158/1541-7786.MCR-13-0541 |
| [14] | Tang K, Wu H, Mahata SK, et al. A crucial role for the mitogen-activated protein kinase pathway in nicotinic cholinergic signaling to secretory protein transcription in pheochromocytoma cells. Molecular Pharmacology, 1998, 54 (1): 59–69. |
| [15] | Picciotto MR. Nicotine-mediated activation of signal transduction pathways. Novartis Foundation Symposium, 2008, 275 (2): 83–95. |
| [16] | Lykhmus O, Mishra N, Koval L, et al. Molecular mechanisms regulating LPS-induced inflammation in the brain. Frontiers in Molecular Neuroscience, 2016, 19 (9): 1–13. |
| [17] | Li MD, Kane JK, Wang J, et al. Time-dependent changes in transcriptional profiles within five rat brain regions in response to nicotine treatment. Brain Research Molecular Brain Research, 2004, 132 (2): 168–180. DOI:10.1016/j.molbrainres.2004.09.009 |
| [18] | Ehlers MD. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nature Neuroscience, 2003, 6 (3): 231–242. DOI:10.1038/nn1013 |
| [19] | Wang J, Gutala R, Sun D, et al. Regulation of platelet-derived growth factor signaling pathway by ethanol, nicotine, or both in mouse cortical neurons. Alcoholism Clinical & Experimental Research, 2007, 31 (3): 357–375. |
| [20] | Sokolov BP, Polesskaya OO, Uhl GR. Mouse brain gene expression changes after acute and chronic amphetamine. Journal of Neurochemistry, 2003, 84 (2): 244–252. DOI:10.1046/j.1471-4159.2003.01523.x |
| [21] | Belluzzi JD, Wang R, Leslie FM. Acetaldehyde enhances acquisition of nicotine self-administration in adolescent rats. Neuropsychopharmacology, 2005, 30 (4): 705–712. DOI:10.1038/sj.npp.1300586 |
| [22] | Quik M, Perez XA, Bordia T. Nicotine as a potential neuroprotective agent for Parkinson's disease. Movement Disorders, 2012, 27 (8): 947–957. DOI:10.1002/mds.v27.8 |
| [23] | Dineley KT. Nicotinic acetylcholine receptors in Alzheimer's and Parkinson's disease[M]. Springer New York, 2014: 383-415. |
| [24] | Song G, Nesil T, Cao J, et al. Nicotine mediates expression of genes related to antioxidant capacity and oxidative stress response in HIV-1 transgenic rat brain. Journal of Neurovirology, 2015, 22 (1): 114–124. |
| [25] | Lin C, Yona JM, Lee BJ, et al. Antiteratogenic effects of β-Carotene in cultured mouse embryos exposed to nicotine. Evidence-based Complementary and Alternative Medicine, 2013, 2013 (2): 70–75. |
| [26] | 王红霞, 何家田, 刘炳玉, 等. 电压依赖性阴离子通道蛋白1和G蛋白N端乙酰化的纳升电喷雾串联质谱分析[C]. 中国蛋白质组学学术大会, 2005. |
| [27] | Lykhmus O, Gergalova G, Koval L, et al. Mitochondria express several nicotinic acetylcholine receptor subtypes to control various pathways of apoptosis induction. International Journal of Biochemistry & Cell Biology, 2014, 53 (7): 246–252. |