2. 北京中医药大学中医药研究院,北京 100029
2. Research Laboratory Center of Beijing University of Chinese Medicine, Beijing 100029
核酸适配体是能够与特定靶分子结合且具有高亲和力和高特异性的寡核苷酸[1]。与抗体相比,核酸适配体具有很独特特点[2]。第一核酸适配体高亲和力和高特异性,核酸适配体与靶分子的结合力很强,对靶分子的结合具有很高的特异性,能够识别分辨不同配基上的一个基团差别,甚至能够识别同一种蛋白分子不同构象的不同功能状态;第二靶分子范围具有广泛性,核酸适配体不仅能够与蛋白质、酶、生长因子、抗体等生物大分子结合,还能与金属离子、核苷酸、氨基酸等小分子物质特异性结合;第三容易修饰和标记,核酸适配体能够在体外通过化学合成的方法合成,可进行特定的位点修饰,如酶、生物素、放射性同位素、生物素等;第四具有良好的稳定性,核酸适配体本质是核酸,对温度、酸碱度、离子强度具有一定的耐受性,便于长期保存、运输和应用,与抗体相比,具有更好的稳定性。第五核酸适配体能够通过聚合酶链反应大量扩增,一旦筛选得到特异性的核酸适配体,就可扩增出更多纯度很高的产物[3-5]。
典型的核酸适配体的筛选过程主要包括三个步骤:(1)结合:即靶标与随机寡核苷酸文库孵育,形成核酸适配体-靶标复合物。(2)分离:即通过特定的方法,如离心、滤膜过滤等分离结合靶标和未结合靶标的核酸适配体分离开。(3)扩增:即对获得的能与靶标特异性结合的核酸适配体序列进行扩增,生成次级文库,进行下一轮的筛选[6, 7]。
然而传统的SELEX方法操作繁琐,筛选周期长,需要几个月的时间才能筛选出与靶标具有特异性的核酸适配体[8]。随着SELEX的快速发展,近年来出现了很多新型的筛选方法,这些新的方法大大提高了筛选周期和筛选效率,拓展了核酸适配体的应用,如以提高核酸适配体选择性为目的的筛选方法:反向筛选(counter SELEX)、消减筛选(subtractive SELEX)、光交联筛选(photo SELEX)、负筛选(negative SELEX);以提高核酸适配体普适性为目的的核酸适配体筛选方法:混合筛选(blended SELEX)、复合靶筛选(complex targets SELEX)、表达盒筛选(expression SELEX)、切换筛选(toggling SELEX);以缩短筛选周期为目的的高效筛选方法:自动化筛选(automated SELEX)、不放大筛选(non-SELEX)、荧光磁珠筛选(FluMag SELEX);不同结合库相结合以增加目标核酸适配体筛选机率的方法:加尾筛选(tailored SELEX)、基因筛选(genomic SELEX)等[4, 6, 9-14]。本文将介绍几种近3年来发展的新的筛选方法,这不仅有助于人们进步了解、认识核酸适配体筛选技术的发展现状,同时能更好地促进核酸适配体在各个领域的应用。
1 氧化石墨烯SELEX(Multiple GO-SEL-EX)氧化石墨烯(graphene oxide)是一种性能优异的新型碳材料,具有较高的比表面积和表面丰富的官能团,材料在多领域应用范围广泛,近些年一直是一个研究热点[15, 16]。Multiple GO-SELEX方法正是采用石墨烯氧化物进行筛选的一种简单,快速,高通量的核酸适配体的筛选方法,有效地降低了筛选成本,缩短了SELEX的筛选时间。这是一种对蛋白质,对病毒颗粒都适用的筛选方法。氧化石墨烯能够与核酸适配体通过π-π键结合,但当靶标到GO表面上时,其与核酸适配体结合,结合后具有高亲和力的单链DNA结构就会被改变,在GO表面的π-π键被破坏后折叠成新的空间结构,结果导致从GO表面释放出来,而非特异性的核酸适配体仍然结合在GO表面,从而能够快速有效的将特异性与非特异性核酸适配体分开。其筛选方法如图 1所示,筛选第一步首先先进行反筛选,去除假阳性结合,然后加入氧化石墨烯进行筛选。2014年,Nguyen等[17]第一次报道了这种Multiple GO-SELEX筛选方法,这种方法可以同时筛选多个靶标的核酸适配体。他们利用此方法在3种农药中成功获得的10种不同的单链DNA核酸适配体,其亲和力在10-100 nmol/L的范围内。除了每个靶标的核酸适配体外,他们发现了几个灵活的多目标核酸适配体,能与2个或3个不同的分子结合。这些能与多种靶标结合的适体不但对小分子的快速结合有重要意义,而且也有利于核酸适配体生物传感器的发展。Gu等[18]研究报道,用GO-SELEX筛选方法筛选出了能够与冈田酸(okadaic acid,OA)特异性结合的核酸适配体,并将这种核酸适配体应用于酶连适配体检测(ELAA)方法中,该方法可用于检测具有高灵敏度的特点,不仅可以用于检测海产品中的冈田酸,还可能适用于其他小分子分析物的测定。随着不断地发展与提高,现如今,氧化石墨烯已经成为核酸适配体领域研究的一个热点。但是氧化石墨烯在生物效应和安全性能方面的研究目前还是比较少,如果其运用于生物体,是否会结合DNA等生物大分子,影响生物体正常的生理功能,这些问题仍需解决[19]。
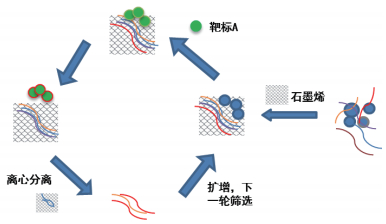
|
| 图 1 氧化石墨烯SELEX筛选技术示意图 |
碳纳米管作为一维纳米材料,其广阔的应用前景不断地被探索。单壁碳纳米管(single-walled carbon nanotubes,SWCNTs)在生物医学中已经被广泛研究,核酸、蛋白质以及其他一些难溶性的含芳环药物等能够通过物理包埋和π-π吸附等方式加载到碳纳米管表面[20, 21]。单壁碳纳米管辅助细胞SELEX这是一种采用单壁碳纳米管辅助的细胞筛选方法,具有很高的筛选效率,能够有效的缩短筛选周期,与普通Cell-SELEX相比,此法仅需6轮筛选,而传统的Cell-SELEX需要15轮的筛选过程。传统的Cell-SELEX方法采用简单的洗脱方法来分离特异性与非特异性结合的核酸适配体,这种分离方法会导致分离不完全,而SWCNTs-assisted cell-SELEX这种方法能够在单壁碳纳米管辅助下,快速有效的将特异性与非特异性结合的核酸适配体分离开来。单链的DNA能够通过π-π堆积力而成螺旋形的包裹在单壁碳纳米管上,因此在分离这一步时加入单壁碳纳米管。加入后,不能与靶分子结合的或者结合力较弱的核酸适配体都能够吸附于纳米管上,而特异性的核酸适配体由于与靶标的特异性结合而仍然留在细胞表面,从而达到了有效的分离目的。2014年,Tan等[22]第一次报道了这种筛选方法,他们选用两种鼻咽癌(nasopharyngeal carcinoma,NPC)的细胞系CNE2细胞和HONE细胞分别作为靶细胞和阴性对照的细胞,结果只用了六轮的筛选过程就筛选到了对CNE2细胞具有高特异性和高亲和力的核酸适配体,这引起了关于鼻咽癌的临床诊断和生物医学应用方面的高度关注。同时,这种方法为癌症分化和癌转移机制的研究提供了一个有效的工具。
3 基于芯片的细胞SELEX(on-chip Cell-SELEX)以整个细胞作为靶标来筛选出与其特异性结合的核酸适配体的技术称为细胞SELEX(cell-SELEX)[23]。随着核酸适配体在各个领域的普遍关注,核酸适配体在生物医学中得到了广泛的应用。on-chip Cell-SELEX这种筛选方法是在Cell-SELEX筛选方法基础上发展改进的一种更快速的筛选方法,在细胞筛选的基础上,增加微流控芯片。这种筛选方式只需要5轮的筛选,这与传统的筛选方法相比,大大的缩短了筛选过程。Hung等[24]用这种自动化的芯片SELEX筛选方法筛选得到了13种卵巢癌细胞(Ovarian cancer)的高特异性核酸适配体,其中3种核酸适配体与靶标的解离常数达到1.8、8.3和1.3 nmol/L,这种筛选系统将来可能用于靶向治疗和检测。Hung等[25]用这种芯片细胞SELEX自动筛选系统成功的筛选出了8种结直肠癌细胞(CR-CSC/CRC)的特异性核酸适配体,其中有3种具有很高的特异性,与靶标的解离常数达到27.4、28.5和12.3 nmol/L。
4 序列构造SELEX(sequence-constructive SELEX)序列构造SELEX,这是一种通过在筛选过程中,对核酸适配体序列进行一定修饰,从而使其提高对靶标的亲和力和特异性,这种筛选过程的分离步骤在被链霉亲和素包被的磁珠的帮助下完成的。2014年,Wang等[26]报道了这种筛选方法。他们用这种新的阶梯序列构造的筛选方法用于Globo H(一种和肿瘤相关的表面抗原)筛选,并筛选出了对Globo H具有高亲和力和高特异性的核酸适配体。筛选过程如图 2所示,每一步的筛选过程都包含7轮的筛选步骤。第一步筛选中起始的寡核苷酸文库选择了中间部分具有15个随机核苷酸,两端为固定序列,经过7轮的筛选,得到了37种不同的寡核苷酸,对其与Globo H的亲和力进行测定后,选择了4种特异性的亲和力较高的寡核苷酸用于下1步的筛选。在第2步的筛选中,先将第1步得到的4种寡核苷酸分别用四种含有14个随机序列的寡核苷酸进行修饰,修饰后通过七轮的筛选得到高亲和力的特异性核酸适配体用于第3轮的筛选。第3步的筛选过程同第2步的。经过3轮筛选,将得到的适体进行克隆,测序并对其分子结构进行分析。分析发现,延长序列被修饰盐延长后,其特异性显著增加。但是这种筛选方法筛选周期长,每一步的筛选,都需要7轮筛选,因此这种方法的应用还有待于进一步研究与完善。
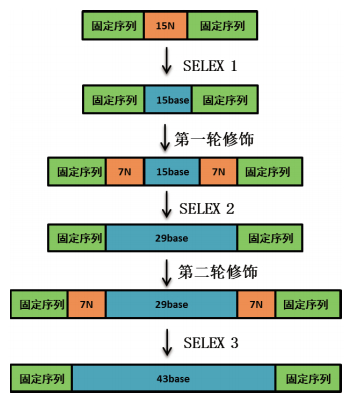
|
| 图 2 序列构造SELEX方法示意图 |
高保真SELEX即Hi-Fi SELEX,这种筛选方式有3个主要的特点。第一,在筛选过程中引用了一种固定区封闭元件即互补序列,从而能增加起始文库的功能多样性,这是因为通常情况下,两种常见的侧翼序列会干扰核酸适配体的空间折叠和功能,从而降低了起始文库的多样性。第二,靶标固定在涂有吸附钝化的聚乙二醇和表面活性剂的微量滴定板上,大大增加了靶分子与核酸适配体结合特异性。这种化学修饰表面不仅大大的减少了非特异性结合,而且可以在核酸适配体和邻近靶分子之间起到一个桥接的作用。第三,扩增时用数字聚合酶链反应(dPCR)的方法,扩增更具有特异性和准确性,能够实现绝对定量。2015年,Ouellet等[27]首次报道了这种新的筛选方法,并用这种方法以凝血酶α、人因子IXa、人因子X及人因子D为靶标筛选出其特异性核酸适配体。用这种方法筛选3轮之后,靶分子与核酸适配体间的解离常数(Kd)值就达到了nM水平。他们用Hi-Fi SELEX筛选体系确定了能够抑制补体因子D的结构相关的核酸适配体,其能够抑制补体系统激活途径中的旁路途径,这有助于旁路途径相关疾病的治疗研究和发展。
6 展望近年来,关于核酸适配体的筛选方法发展迅速,在很多领域都得到了广泛应用,随着不断地发展,研究者将很多新型的材料应用于核酸适配体的筛选上,使得很多新的筛选技术不断被发现、优化和完善,从筛选速度、特异性、准确性、高效性等各方面都不断提高。从传统的SELEX技术,发展到光交联筛选(photo SELEX)、自动化筛选(automated SELEX)、荧光磁珠筛选(FluMag SELEX)等新的筛选方法,再到本文介绍到的更优化的筛选技术氧化石墨烯SELEX(Multiple GO-SELEX)、单壁碳纳米管辅助细胞SELEX(SWCNTs-assisted cell-SELEX)、基于芯片的细胞SELEX(on-chip Cell-SELEX)、序列构造SELEX(Sequence-constructive SELEX)、高保真SELEX(High-Fidelity SELEX)。如今,核酸适配体作为一种有效的工具,在化学生物学、分析化学、生物医学、疾病诊断,疾病治疗、药物研发等研究中广泛应用。未来,核酸适配体不仅会在疾病治疗和诊断上发挥重要的作用,而且会在基础研究中扮演重要角色,为生物分子间相互作用和功能的研究带来前所未有的准确性。核酸适配体还有许多潜在的应用有待发展,需要我们开阔自己的想象力,去不断的探索与发现。
| [1] | Thiel WH, Thiel KW, Flenker KS, et al. Cell-internalization SELEX: method for identifying cellInternalizing RNA aptamers for delivering siRNAs to target cells. Methods Mol Biol, 2015, 1218 : 187–199. DOI:10.1007/978-1-4939-1538-5 |
| [2] | 吕彬, 张骏, 杜文琪, 等. Cell-SELEX技术在肿瘤诊治中的应用进展. 复旦学报:医学版, 2013, 40(2): 227–238. |
| [3] | Iliuk AB, Hu LH, Tao WA. Aptamer in bioanalytical applications. Anal Chem, 2011, 83 : 4440–4452. DOI:10.1021/ac201057w |
| [4] | 朴喜航, 任姝颖, 夏薇. SELEX技术的研究进展及在医学中的应用. 吉林医药学院学报, 2015, 36: 45–49. |
| [5] | 满燕, 吕雪飞, 张玉奎, 等. 核酸适配体及其在生物医学研究中的应用. 航天医学与医学工程, 2013, 26(6): 485–490. |
| [6] | Ozer A, Pagano JM, Lis JT. New technologies provide quantum changes in the scale, speed, and success of SELEX methods and aptamer characterization. Molecular Therapy-Nucleic Acids, 2014, 3 : 2162–2531. |
| [7] | Kim YS, Gu MB. Advances in aptamer screening and small molecule aptasensors. Adv Biochem Eng Biotechnol, 2014, 140 : 29–67. |
| [8] | Mayer G. The chemical biology of aptamers. Angew Chem Int Ed, 2009, 48 : 2672–2689. DOI:10.1002/anie.200804643 |
| [9] | Stoltenburg R, Reinemann C, Strehlitz B. FluMag-SELEX as an advantageous method for DNA aptamer selection. Anal Bioanal Chem, 2005, 383 : 83–91. DOI:10.1007/s00216-005-3388-9 |
| [10] | Jensen KB, Atkinson BL, Willis MC, et al. Using in vitro selection to direct the covalent attachment of human immunodeficiency virus type 1 Rev protein to high-affinity RNA ligands. Proc. Natl Acad Sci USA, 1995, 92 : 12220–12224. DOI:10.1073/pnas.92.26.12220 |
| [11] | Yang Y, Yang DL, Schluesener HJ, et al. Advances in SELEX and application of aptamers in the central nervous system. Biomolecular Engineering, 2007, 24 : 583–592. DOI:10.1016/j.bioeng.2007.06.003 |
| [12] | Cox JC, Hayhurst A, Hesselberth J, et al. Automated selection of aptamers against protein targets translated in vitro: from gene to aptamer. Nucleic Acids Res, 2002, 30 : e108. DOI:10.1093/nar/gnf107 |
| [13] | Mendonsa SD, Bowser MT. In vitro selection of high-affinity DNA ligands for human IgE using capillary electrophoresis. Anal Chem, 2004, 76 : 5387–5392. DOI:10.1021/ac049857v |
| [14] | Vater A, Jarosch F, Buchner K, et al. Short bioactive Spiegelmers to migraine-associated calcitonin gene-related peptide rapidly identified by a novel approach: Tailored-SELEX. Nucleic Acids Research, 2003, 31 : e130. DOI:10.1093/nar/gng130 |
| [15] | 沈贺, 张立明, 张智军. 石墨烯在生物医学领域的应用. 东南大学学报:医学版, 2011, 30(1): 219–223. |
| [16] | Wang Y, Li ZH, Wang J, et al. Graphene and grapheneo xide: biofunctionalization and applications in biotechnology. Trends in Biotechnology, 2011, 29 : 205–212. DOI:10.1016/j.tibtech.2011.01.008 |
| [17] | Nguyen VT, Kwon YS, Kim JH, et al. Multiple GO-SELEX for efficient screening of flexible aptamers. Chem Commun, 2014, 50 : 10513–10516. DOI:10.1039/C4CC03953J |
| [18] | Gu HJ, Duan N, Wu SJ, et al. Graphene oxide-assisted nonimmob-ilized SELEX of okdaic acid aptamer and the analytical application of aptasensor. Scientific Reports, 2016, 6 : 21665. DOI:10.1038/srep21665 |
| [19] | 林彦锋, 刘宇洋, 高顺祥, 等. 氧化石墨烯与核酸适配体在检测方面应用的进展. 中国生化药物杂志, 2015, 35(8): 186–188. |
| [20] | Liang F, Chen B. A review on biomedical applications of single-walled carbon nanotubes. Current Medicinal Chemistry, 2010, 17 : 10–24. DOI:10.2174/092986710789957742 |
| [21] | 李玲. 单壁碳纳米管的改性及其在生物医药领域的初步应用研究[D]. 上海: 上海交通大学, 2010. |
| [22] | Tan YY, Guo QP, Xie Q, et al. Single-walled carbon nanotubes (SWCNTs)-assisted cell-systematic evolution of ligands by exponential enrichment (Cell-SELEX) for improving screening efficiency. Anal Chem, 2014, 86 (19): 9466–9472. DOI:10.1021/ac502166b |
| [23] | Guo KT, Paul A, Schichor C, et al. CELL-SELEX: novel perspec-tives of aptamer-based therapeutics. Int J Mol Sci, 2008, 9 : 668–678. DOI:10.3390/ijms9040668 |
| [24] | Hung LY, Wang CH, Hsu KF, et al. An on-chip Cell-SELEX process for automatic selection of high-affinity aptamers specific to different histologically classified ovarian cancer cells. Lab Chip, 2014, 14 : 4017–4028. DOI:10.1039/C4LC00587B |
| [25] | Hung LY, Wang CH, Che YJ, et al. Screening of aptamers specifi to colorectal cancer cells and stem cells by utilizing On-chip Cell-SELEX. Scientific Reports, 2015, 5 : 10326. DOI:10.1038/srep10326 |
| [26] | Wang CY, Wu CY, Hung TC, et al. Sequence-constructive SELEX: A new strategy for screening DNA aptamer binding to Globo H, Biochem. Biophys. Res Commun, 2014, 452 (3): 484–489. |
| [27] | Ouellet E, Foley JH, Conway EM, et al. Hi-Fi SELEX: a high-fidelity digital-PCR based therapeutic aptamer discovery platform. Biotechnol. Bioeng, 2015, 112 : 1506–1522. DOI:10.1002/bit.v112.8 |




