2. 农业部华北地区园艺作物生物学与种质创制重点实验室,北京 100097
2. Key Laboratory of Biology and Genetic Improvement of Horticultural Crops (North China), Ministry of Agriculture, Beijing 100097
糖类化合物如蔗糖、葡萄糖、果糖是高等植物光合作用的主要产物。这些糖具有多种功能,或为蛋白质、核酸等大分子提供碳骨架,或为渗透调节物质,或为信号分子,或暂时贮藏在植物液泡中为细胞生命活动提供能量,或通过韧皮部从叶片向根、茎、嫩叶、花、果实、种子等库器官运输,为新生细胞生长发育提供营养物质[1-3]。糖类化合物不能独立跨植物生物膜系统进行运输,而需要相应糖转运蛋白的协助,如单糖转运蛋白(monosaccharide transporters,MSTs)[4]、蔗糖转运蛋白(sucrose transporters,SUTs)[2, 3]和糖外排转运蛋白(sugars will eventually be exported transporters,SWEETs)[5]。SWEET是近年来才发现的一类新型的糖转运蛋白基因家族,目前对其功能研究主要集中在拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)上。尽管对SWEET基因家族开展研究的时间不长,但现有的结果已经表明它们通过调控植物体内糖类化合物的运输、分配和贮藏,参与了植物生长发育的重要生理过程[6, 7]。本文就SWEET基因家族的发现、结构特征、生理功能及逆境调控研究进展做介绍,对SWEET基因家族的进一步研究具有重要意义。
1 新型糖转运蛋白SWEET基因家族的发现荧光共振能量转移(fluorescence resonance ene-rgy transfer,FRET)传感器是一种新型的荧光信号标签,将其在动植物体内表达,并将荧光信号的变化强度量化可实时监测底物(如糖、氨基酸、离子等)在活体组织细胞水平及亚细胞水平的浓度变化,是研究动植物生理代谢过程的有效方法[8, 9]。Chen等[5]首次利用葡萄糖FRET传感器在哺乳动物细胞HEK293T中筛选,从拟南芥中鉴定出一类新型的糖转运蛋白基因家族SWEET。SWEET蛋白利用细胞内外糖浓度梯度进行跨膜运转,而不是依靠质子梯度,因此其转运糖的活性不依赖于环境pH值[5, 10]。更为重要的是,SWEET蛋白可在溶质势驱动下顺浓度梯度对糖分进行跨膜双向运输[5, 10],即顺糖分浓度梯度从胞内向胞外运输糖分(efflux)或者将糖分从胞外运输到胞内(uptake),而其他已知的MSTs和SUTs均与H+偶联,利用细胞内外H+浓度梯度对糖分进行跨膜单向运输[2-4]。研究者们很早就意识到,在植物许多重要生理过程如韧皮部装载、花粉发育、花蜜产生中,可能存在糖外流载体(sugar efflux transporter)的参与[3],但是在SWEET基因家族发现之前并没有分离克隆到这样的糖载体,因此对植物这些重要生理过程的分子生理机制的了解并不全面。糖外流载体SWEET基因家族的发现对于全面了解植物这些重要生理过程的分子生理机制具有举足轻重的作用。
随后研究人员发现,SWEET其实是一个在原核生物、动物和植物中广泛存在的基因家族,但原核生物和动物中SWEET基因家族成员较少,高等维管束植物中数目较多,如关节炎支原体(Mycoplasma arthritidis)、原绿球藻(Prochlorococcus marinus)、死亡梭杆菌(Fusobacterium mortiferum)等原核生物以及人类(Homo sapiens)、狒狒(Papio anubis)、小鼠(Mus musculus)等哺乳动物中均只含有1个SWEET基因[11, 12],维管束植物拟南芥、水稻、玉米(Zea mays)、番茄(Solanum lycopersicum)、葡萄(Vitis vinifera)、大豆(Glycine max)分别含有17、21、23、29、17和52个SWEET基因[5, 12-15]。另外,同一植物不同SWEET家族成员可能运转不同的糖,如拟南芥17个SWEET基因家族成员大多数具有转运蔗糖或葡萄糖的功能[5, 10],AtSWEET2转运2-脱氧葡萄糖[16],AtSWEET17转运果糖[17],而AtSWEET11、12和16同时具备转运蔗糖、葡萄糖和果糖的功能[18, 19]。其次,同一物种不同SWEET基因家族成员具有不同的组织表达特征[5, 10]。这些结果暗示SWEET基因家族在植物中可能具有多种重要的生理功能。
2 植物SWEET蛋白结构特征在SWEET基因家族蛋白发现之前,植物中鉴定到的MSTs和SUTs均属于MFS超家族(major facilitator superfamily),其N末端和C末端都位于胞内一侧,一般含有12个跨膜α-螺旋(α-helical transmembrane domains,TMs),中间面向细胞质的部分有1个大的胞质环,将蛋白分为各含6个TMs的N端和C端两个结构域[20, 21]。这两个结构域的拓扑结构非常相似,以一种假二次轴对称的方式存在,而形成每个结构域的6个TMs可拆分为两组由3个TMs组成的以反向平行方式对称的重复单元[20-22]。这种独特的折叠方式被称为MFS折叠方式(MFS fold)[23]。
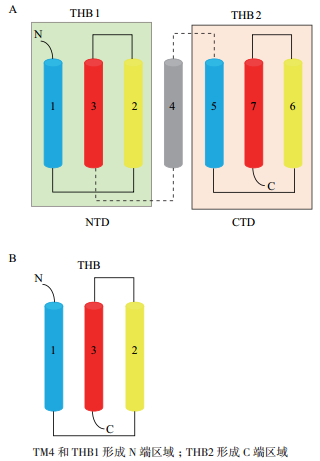
植物SWEET蛋白属于MtN3/saliva家族(PF03083),N末端和C末端分别在细胞胞质的外侧和内侧,一般含有7个TMs,第4个TM保守性较低主要起链接作用,将蛋白分为各含3个TMs的两个MtN3/saliva结构域,形成3-1-3的结构[5]。进一步研究发现,形成每个MtN3/saliva结构域的3个TMs以TM1-TM3-TM2的形式排列形成三螺旋束(triple-helix bundles,THB)(图 1-A)。从这些结果可以看出,SWEET蛋白的拓扑结构与MSTs、SUTs明显不同,这可能是SWEET具有从胞内向胞外运输糖分的重要原因。另外,原核生物的SWEET同源蛋白序列只含有1个由3个TMs组成的MtN3/saliva结构域(图 1-B),因此它们被命名为SemiSWEET[24]。可以推测在进化过程中,原核生物的1个MtN3/saliva结构域发生了复制融合或横向基因转移(horizontal gene transfer)融合,导致真核生物中具有2个MtN3/saliva结构域的SWEET蛋白的产生。
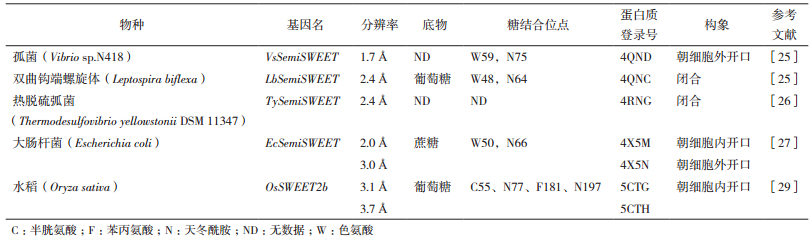
Xuan等[24]利用分裂泛素和分裂GFP系统对SWEET进行截短互补实验,结果表明SWEET蛋白必须发生寡聚化形成同源或异源多聚体才能行使糖运转的功能,而最可能的情形是真核生物SWEET蛋白形成二聚体,而原核生物SemiSWEET形成四聚体。紧接着,SemiSWEET蛋白的三维结构解析取得突破性进展。截至目前,总共有4个来自细菌的SemiSWEET家族成员蛋白的高分辨率三维结构被解析(表 1),结果表明两个SemiSWEET蛋白单体通过形成对称的(symmetrical)同源二聚体构成基本运输孔隙(translocation pore)单元,并且来自TM2的色氨酸和来自TM3的天冬酰胺残基是SemiSWEET蛋白行使糖运转功能的关键位点[25-28]。最近,水稻OsSWEET2b蛋白的三维结构被解析,这是截至目前唯一一个三维结构被解析的真核生物SWEET蛋白[29](表 1)。Tao等[29]的研究结果表明,一个OsSWEET2b蛋白单体即可形成基本运输孔隙单元,TM4和THB1紧密联系构成N端区域,THB2构成C端区域(图 1-A)。这解释了Xuan等[24]将AtSWEET1蛋白截短为THB1+TM4和THB2后共表达具有运输葡萄糖的能力,而截短为THB1和TM4+THB2则不具备运输葡萄糖的能力的原因。同时,由于TM4与THB1、THB2紧密程度不一致,导致THB1和THB2结构上的差异,两者不对称排列(asymmetrical),这与原核生物SemiSWEET同源二聚体两个THBs的对称排列明显不同[29]。另外,来自TM2的半胱氨酸、TM3和TM7的天冬酰胺以及TM6的苯丙氨酸是OsSWEET2行使葡萄糖运转功能的关键位点[29]。截至目前,研究者们发现SemiSWEET或SWEET蛋白具有朝细胞外开口(outward open conformation)、朝细胞内开口(inward open conformation)和闭合(occluded conformation)3种构象(表 1)。尽管到目前为止未能在生物体内观察到同一SemiSWEET或SWEET蛋白的3种构象(表 1),但是已有的研究结果已为阐明其底物结合和糖转运机理奠定了一定的结构基础,研究者们根据这些结果提出了摇杆运动(rocking-type motion)理论[25]。在OsWEET2b中,TM1、TM2、TM5和TM6上的脯氨酸可能是促使其在不同构象间转变的关键因素[29]。
光合产物在叶片中合成后,通过韧皮部装载、长距离运输和库器官的韧皮部卸载,实现光合产物在源、库器官间的转运和分配。以蔗糖为光合产物主要运输形式的植物,其韧皮部装载多以质外体途径为主,该途径涉及蔗糖的跨膜运输,需要在相应蔗糖转运蛋白的协助下完成[30]。在SWEET蛋白发现之前,对于蔗糖在何种转运蛋白的协助下从韧皮部薄壁细胞外运至筛分子/伴胞复合体附近的质外体这一过程并不清楚,而这正是质外体途径中实施韧皮部蔗糖装载的先决条件。2012年,Chen等[10]发现定位在叶片韧皮部薄壁细胞质膜上的AtSWEET11和AtSWEET12负责该过程,首次证明了植物SWEET蛋白作为糖外流载体在蔗糖韧皮部质外体输出中起关键作用,为H+/蔗糖共向转运蛋白SUT1/SUC2将蔗糖从质外体运输至筛分子/伴胞复合体细胞内提供了前提准备,从而揭示了韧皮部质外体装载的整个过程[31, 32]。
水稻OsSWEET11(又称为Os8N3/Xa13)是拟南芥AtSWEET11和AtSWEET12的同源基因,也是蔗糖低亲和运输的载体[10]。OsSWEET11定位在质膜上,且主要在水稻叶片组织的韧皮部中表达,虽然已有的研究结果不能确认OsSWEET11是在韧皮部的薄壁细胞中表达,但足以推测OsSWEET11可能也参与了蔗糖在水稻韧皮部装载的过程[6, 10, 33]。
3.2 参与果实发育可溶性糖含量(主要指蔗糖、葡萄糖和果糖)是决定果实品质的重要指标。植物中SWEET基因家族具有糖运输功能,可以预料它们可能在果实发育过程中起着关键作用。甜橙(Citrus sinensis)基因组含有16个SWEET基因家族成员,其中Cs2g28300、Cs3g14550、Cs7g02970、Cs3g14500、Cs3g20720、Cs2g04140和orange1.1t02627这7个SWEET基因在果实中高度表达[34]。葡萄中有6个SWEET基因(VvSWEET4、7、10、11、15和17d)随着浆果发育表达量增加[13]。苹果(Malus domestica)基因组含有29个SWEET基因家族成员,其中MdSWEET1.1/2、MdSWEET2.4和MdSWEET3.5在幼果中表达量较高,而MdSWEET3.6/7在大果中表达量较为丰富[35]。栽培番茄品种‘Heinz 1706’中SlSWEET1b、SlSWEET1c、SlSWEET2a、SlSWEET7a和SlSWEET14在1-3 cm的幼果中具有较高的表达量,随着果实的成熟这5个基因的表达量逐渐降低;SlSWEET12c在1-3 cm的幼果中的表达量较低,在果实绿熟期表达量急剧增加达到最大值,之后又有所回落[14]。野生番茄‘LA1598’中SlSWEET12c和SlSWEET14在花后33天的果实中表达量最高,而SlSWEET10a和SlNEC1在花后20 d的果实中表达量达到最高值[14]。尽管到目前为止尚未有SWEET基因在果实发育过程中具体功能的详细报道,但是以上数据表明SWEET可能参与了果实中可溶性糖的运输和分配,对果实产量和品质具有重大影响。
3.3 参与蜜腺分泌蜜腺能分泌花蜜,引诱昆虫前来采蜜完成传粉过程,从而保证植物获取异源基因、保证种群繁衍和进化。尽管人们早已了解花蜜的功能及组成,但是在SWEET基因家族被发现之前人们对花蜜分泌的机制尚不清楚。矮牵牛(Petunia hybrida)中存在一个主要在蜜腺薄壁细胞中表达的NEC1(AtSWEET9的同系物)基因,其表达量与花蜜分泌量成正相关[36]。沉默NEC1的表达导致雄性不育,但没有与花蜜表型相关的报道[37]。Lin等[38]发现具有蔗糖运输功能的拟南芥AtSWEET9定位于质膜,在蜜腺薄壁细胞中特异表达,该基因突变体atsweet9花蜜分泌量减少,明确了AtSWEET9在蜜腺花蜜分泌中具有重要作用。芜菁(Brassica rapa)和烟草(Nicotiana attenuata)中均发现了AtSWEET9的同系物,抑制BrSWEET9或NaSWEET9的表达也导致突变体植株花蜜分泌量的减少[38],说明这2个基因可能也在蜜腺花蜜分泌中起着关键作用。
3.4 参与种子发育可溶性糖往发育中种子的转运能力影响了种子的大小和重量,进而决定了玉米、水稻和小麦等农作物的产量[39]。作物在长期驯化过程中,种子粒型变大,这种选择必然与可溶性糖的代谢和运输相关,但有关种子灌浆(seed filling)过程中可溶性糖的转运机制所知甚少。Sosso等[15]通过比较和筛选不同类型玉米的基因表达数据库发现,在种子中高丰度表达的ZmSWEET4c在玉米和蜀黍(Zea mays L. ssp. parviglumis)(玉米的祖先)中存在较大的差异,推测该基因可能是玉米驯化过程中一个与糖转运调控相关的位点。进一步研究发现,ZmSWEET4c定位于基底胚乳转移层(basal endosperm transfer layer)细胞膜上,该基因T-DNA插入突变体的胚乳变小,种子淀粉含量和重量均显著低于野生型对照,出现“空种皮”的表型,明确了ZmSWEET4c在玉米种子灌浆中具有关键作用[15]。研究人员将此项研究延伸到水稻中发现,水稻中存在一个ZmSWEET4c的同源基因OsSWEET4,该基因表达、底物运输等特性及突变体植株表型与玉米ZmSWEET4c类似,推测该基因可以调控水稻种子的灌浆过程,是水稻驯化过程中的一个与糖转运调控相关的位点[15]。
在拟南芥种子发育过程中,位于质膜上的蔗糖外流载体AtSWEET11、AtSWEET12和AtSWEET15(也称为SAG29)在种子中展示出特定的时空表达特性;atsweet11;12;15三突变体种子的胚发育迟缓,种子重量、淀粉含量和油脂含量均显著低于野生型对照,种子皱缩、干瘪[40]。这些结果说明,SWEET可以将由韧皮部运输而来的蔗糖从母体组织外运出来,从而为种子胚发育提供碳素营养[40]。大豆基因组含有52个SWEET基因家族成员,其中大部分成员在种子中表达,且在种子灌浆期表达量逐渐增加,之后随着种子的成熟表达量降低,这说明GmSWEET可能在大豆种子发育过程中起着关键作用[12]。
3.5 参与花粉发育植物中的SWEET基因家族通常还参与花粉的发育,与植株育性相关。矮牵牛NEC1除了在蜜腺中表达还在雄蕊中表达,尤其是在花药裂口细胞(anther stomium cell)和花丝上部表达;抑制NEC1的表达导致花药早裂,而此时花粉尚未成熟,最终导致雄性不育[36, 37]。在拟南芥中,AtSWEET1、AtSWEET5、AtSWEET7、AtSWEET8(又称为RPG1)、AtSWEET13(又称为RPG2)等在花粉发育中都有表达,可能参与了拟南芥的生殖发育。在这些拟南芥花粉发育相关基因中,对AtSWEET8的功能研究比较完整。AtSWEET8在小孢子母细胞和绒毡层中高度表达,atsweet8突变体植株四分体时期小孢子质膜不能形成规则的波浪状结构,引起孢粉素不能正常沉积,导致花粉外壁发育受到影响和花粉的降解,atsweet8突变体植株雄性育性显著降低[41, 42]。AtSWEET13也在花药中表达,尽管atsweet13突变体植株花粉外壁的网状结构有轻微缺陷,但atsweet13突变体育性与野生型没有明显差异[42]。研究进一步证实,AtSWEET13可部分回补atsweet8突变体育性,atsweet8;atsweet13双突变体与atsweet8单突变相比育性显著降低,这说明AtSWEET8和AtSWEET13在植株育性方面存在部分冗余[42]。AtSWEET8主要影响早期花序的育性,而AtSWEET13主要影响花序发育后期的育性[41, 42]。AtSWEET1在花原端和雄蕊原基中具有较高的表达,表明AtSWEET1可能为发育中的配子体提供营养[5, 43]。AtSWEET5(又称为VEX1)在花粉营养细胞中表达[44],AtSWEET7在花粉发育时优先表达[45]。
与拟南芥类似,水稻中也存在着调控植株育性的SWEET基因。定位在质膜上的OsSWEET11在小穗和花粉中高度表达,RNAi转基因植株中OsSWEET11的表达受到抑制,花粉发育停留在单核花粉期或二核花粉期,花粉的淀粉含量降低,花粉发育不良,导致植株不育或者半不育[33, 46, 47]。除了OsSWEET11、OsSWEET1a、OsSWEET2a、OsSWEE-T3a、OsSWEET5和OsSWEET15在不同发育阶段的花或圆锥花序中具有较高的表达水平,表明它们可能在水稻生殖发育中起着重要作用[11]。
除了矮牵牛、拟南芥和水稻,其他植物中可能也存在着与花粉发育相关的SWEET基因。甜橙中有5个SWEET基因家族成员(Cs7g02970、Cs3g14550、Cs3g20720、Cs9g04180和Cs2g28270)在花中的表达量较为丰富[34]。番茄SlSWEET5b(也称为LeSTD1)在花中表达量最高[14],且特异的在成熟花粉粒中表达[48]。葡萄中有7个SWEET基因家族成员(VvSWEET3、4、5a、5b、7、10和11)在花中表达量较高[13]。大豆中有超过20个GmSWEET基因在花中高度表达[12],烟草TOBC023B06基因特异的在雄花柱头表达[49]。
3.6 参与叶片衰老植物中的SWEET基因家族也参与衰老过程的调控。水稻OsSWEET5具有半乳糖运输活性,在衰老叶片中表达,超量表达该基因后引起植株叶片中可溶性糖含量和IAA含量的显著变化,导致植株在幼苗阶段表现出生长延迟和早衰,说明OsSWEET5介导的半乳糖转运在植物体内具有重要作用[50]。但是,敲除OsSWEET5基因的植株并没有引起表型的变化,这说明水稻中可能还存在其他具有半乳糖运输功能的与OsSWEET5功能冗余的SWEET基因[50]。与OsSWEET5类似,拟南芥AtSWEET15在叶片衰老过程中表达量逐渐增加,转基因过表达植株表现出生长延迟和叶片衰老速度加快的表型,但AtSWEET15的T-DNA插入突变体与野生型植株相比没有明显差异[51, 52]。从这些研究结果来看,过量表达某些SWEET基因可能破坏可溶性糖正确的分配流向或引起可溶性糖外渗,从而对植株生长产生负面影响。
3.7 参与离子运输植物中的SWEET基因家族对于离子的转运也起着重要作用。拟南芥根系用25 µmol/L铝离子处理后AtSWEET13表达量上调了近160倍,说明该基因可能在维持根系铝离子含量中起重要作用[53]。大豆幼苗进行缺铁处理,1 h后发现叶片中Glyma05g38351(AtSWEET12的同源基因)表达量增加了大约3倍,而Glyma05g38340和Glyma08g01310(两个均是AtSWEET13的同源基因)的表达量降低,表明这3个SWEET基因可能参与了铁元素在大豆体内的运输分配[54]。大麦(Hordeum vulgare)幼苗分别用铵态氮(NH4+)和硝态氮(NO3-)处理后检测基因的表达发现,1个SWEET基因(与AtSWEET11同源性最高)在铵态氮处理植株中的表达量是硝态氮处理植株的2倍,这说明该基因可能在调控氮元素细胞间的运输中有重要作用[55]。在苜蓿(Medicago truncatula)共生根瘤形成过程中,缺硼将导致SWEET基因家族表达水平降低,但当向其提供钙离子时这些下调SWEET基因的表达水平迅速恢复,说明SWEET基因家族在钙/硼离子平衡中可能发挥重要作用[56]。
SWEET基因家族在铜离子运输中的功能研究比较完整。在水稻中,Yuan等[47]通过酵母双杂系统,用OsSWEET11的保守结构域做诱饵筛选到2个定位在质膜上的铜离子转运蛋白(copper transporter)COPT1和COPT5。在酵母铜离子载体功能缺失突变体菌株MPY17中只有同时表达OsSWEET11、COPT1和COPT5才能恢复酵母运输铜的功能,表明三者相互作用在细胞膜上形成一个铜离子转运蛋白复合体,发挥其将铜离子从细胞外摄入细胞内的功能[47]。在水稻中超量表达OsSWEET11、COPT1和COPT5,发现地上组织和根中铜离子含量增加,而木质部液流中铜离子含量降低[47]。从这些结果来看,可以确定OsSWEET11能影响水稻中铜离子的再分配,调控铜离子的运输[47],但是COPT1和COPT5为什么必须和OsSWEET11同时表达才能恢复MPY17的铜离子运输功能尚不得而知。
3.8 参与宿主与病原菌之间的互作SWEET基因家族在植物-病原菌的互作中也起着关键作用。当细菌或真菌病原菌入侵植物后,引起植物中SWEET基因表达量上调,从而有助于病原菌从植物中获取糖类供其生长繁殖。在水稻21个SWEET基因家族成员中,有5个(OsSWEET11-15)已经被证明能够为水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae)提供营养[46, 57-64]。白叶枯病菌侵染水稻植株后分泌特定的转录激活(transcription activator-like,TAL)效应因子,该效应因子与目标OsSWEET基因的启动子特异元件结合,诱导该OsSWEET基因上调表达,导致更多糖类外流,病原菌因获得营养而繁殖,植株感病。目前,OsSWEET11[46]、OsSWEET12[62]、OsSWEET13[60, 64]和OsSWEET15各发现1个TAL效应因子[63],OsSWEET14[57-59, 61, 63]发现了4个TAL效应因子。
病原菌诱导SWEET基因家族上调表达并不是水稻特有的。木薯(Manihot esculenta)MeSWEET10a可被细菌性枯萎病(Xanthomonas axonopodis pv. manihotis)的TAL20效应因子诱导表达[65],甜橙CsSWEET1可被细菌性溃疡病(Xanthomonas citri ssp. citri)的PthA4和PthAw效应因子诱导[66],葡萄VvSWEET4能够与灰霉病菌(Botrytis cinerea)相互作用[13]。葡萄VvSWEET4在拟南芥上的同源基因是AtSWEET4,灰霉病菌侵染后AtSWEET4表达量上调[5],但atsweet4突变体对灰霉病菌不敏感[13]。最近有研究表明,腐霉菌(Pythium irregulare)侵染拟南芥根系后,AtSWEET2表达量急剧增加,而atsweet2突变体对腐霉菌不敏感,推测定位于液泡膜的AtSWEET2可为腐霉菌提供葡萄糖供其生长繁殖[16]。除了灰霉病菌和腐霉病菌,拟南芥中还有多个AtSWEET基因受到如番茄细菌性叶斑病菌(Pseudomonas syringae pv. tomato DC3000)、白粉菌(Golovinomyces cichoracearum)和根肿病菌(Plasmodiophora brassicae)的诱导[5, 67]。辣椒(Capsicum annuum)中SWEET基因(UPA16)受细菌性疮痂病菌(Xanthomonas campestris pv. vesicatoria)诱导表达量增加[68]。小麦(Triticum aestivum)SWEET基因的表达受条锈病菌(Puccinia striiformis)的诱导[69]。
上述结果说明SWEET基因家族确实参与了宿主-病原菌之间的互作,但仅有少数SWEET基因与病原菌互作的机理得到阐释,而某种病原菌是如何特异的识别SWEET基因的尚不得而知,阐明这些机制有助于人们通过分子生物学手段改造病原菌的结合位点,从而获得对病原菌具有抗性的作物。最近的研究表明,SWEET家族基因不仅能为病原菌提供碳水化合物,也能为有益微生物提供营养,如苜蓿MtSWEET11可被根瘤菌诱导表达,为共生根瘤的形成提供糖类化合物[70]。
4 逆境对SWEET基因家族表达的影响可溶性糖是细胞中重要的能量和物质来源,在植物生长发育和逆境胁迫响应调控中具有重要作用。在逆境胁迫下,植物通过调节体内可溶性糖的再分配,维持细胞渗透势的平衡,以利于植物在逆境胁迫下维持正常生长[71]。糖转运蛋白是调控可溶性糖再分配的关键因子,能够响应多种逆境胁迫,与植物抗逆响应密切相关。在茶树(Camellia sinensis)自然冷驯化过程中,CsSWEET2、CsSWEET3和CsSWEET16的表达被显著抑制,而CsSWEET1和CsSWEET17的表达量急剧增加[72]。Feng等[14]在番茄SlSWEET基因家族成员的上游启动子区域发现多个与逆境和激素响应相关的顺式作用元件,并发现在高糖、高盐、高温和低温条件下叶片、根、绿熟期果实和红熟期果实中多个SlSWEET基因表达量发生明显改变。
目前对拟南芥中AtSWEET基因响应非生物胁迫的研究较为深入。AtSWEET16和AtSWEET17是同系物,二者均与非生物胁迫有关。在低氮和冷胁迫条件下,atsweet17突变体植株叶片中果糖含量显著增加,根生长量显著减少;在冷胁迫条件下,过表达AtSWEET17植株叶片中果糖含量降低了80%,但根生长量明显增加[17, 73]。这些结果说明,AtSWEET17负责果糖的双向运输来维持拟南芥叶片和根部胞质中果糖的平衡,以提高植株对低氮、冷胁迫等非生物胁迫的耐受性。冷害、渗透压胁迫和低氮均能引起AtSWEET16表达量的下降;过表达AtSWEET16造成植株中可溶性糖含量与野生型植株迥异,种子发芽率和耐寒性提高;在供氮充足的情况下过表达AtSWEET16植株生长效率和氮肥利用率高于野生型,但在低氮胁迫下野生型氮肥利用率高于过表达植株[18]。这些结果说明,AtSWEET16参与了多种非生物胁迫,且其在这些非生物胁迫中的功能可能是相对独立的[18]。
拟南芥AtSWEET15在叶片自然衰老过程中表达量逐渐增加,而低温、干旱和高盐胁迫均可诱导AtSWEET15表达,这种渗透胁迫下的诱导表达依赖于脱落酸途径[51, 52, 74]。过表达AtSWEET15不仅造成植株叶片衰老速度加快,且对盐胁迫敏感,而atsweet15突变体植株对高盐胁迫的耐受性明显高于野生型植株,这可能是由于过表达AtSWEET15导致转基因植株根部细胞活力降低造成的[52]。
最近的研究表明,AtSWEET11和AtSWEET12不仅存在于叶片中具有蔗糖运输功能,二者还存在于花茎木质部导管中,同时具备蔗糖、葡萄糖和果糖运输能力[19]。在低温胁迫下,atsweet11;12双突变体植株茎的直径、茎韧皮部和木质部面积均显著降低,但双突变体植株的低温耐受性明显提高[19]。这些结果说明,AtSWEET11和AtSWEET12除了具有韧皮部装载功能[10],还可以向次生木质部运输糖分满足次生细胞壁形成所需营养,从而调控拟南芥植株对低温逆境的耐受性[19]。AtSWEET11和AtSWEET12的表达量还受水分胁迫的调节。在水分亏缺条件下,拟南芥植株叶片中与蔗糖韧皮部装载相关的3个基因AtSWEET11、AtSWEET12和AtSUC2表达量增加,蔗糖从叶片向根系运输的能力增强;同时,根中AtSUC2、AtSWEET11-15的表达量增加,说明这些基因在根中可能具有蔗糖韧皮部卸载的功能[75]。这些结果说明,在水分亏缺逆境下植株通过调控蔗糖载体蛋白的表达量调节体内碳水化合物的再分配,即将叶片中合成的碳水化合物更多的分配到根系中去,从而减少水分亏缺对植株生长带来的不利影响。
5 结语目前,对于SWEET基因家族的研究才刚开始,仍有许多问题需要解决。例如,植物SWEET基因家族的功能与其结构紧密相关,但目前只有1个具有葡萄糖转运功能的真核生物SWEET蛋白的三维结构得到解析,且只观察到朝细胞内开口一种构象,尚未能在同一物种中观察到同一SWEET蛋白的三种构象,这些研究结果还不足以全面了解SWEET蛋白的糖转运机理。因此,进一步加强不同糖分转运功能SWEET蛋白的晶体结构解析,有助于阐明植物中多个SWEET基因家族成员是如何区分识别各自的底物以及促使其在不同构象间转变的关键因素。大多数高等植物中含有多个SWEET基因家族成员,这些基因是如何协同运作的;如何被调控的;是在转录水平还是翻译水平被调控。SWEET基因家族成员上存在蛋白磷酸化位点[14],这些磷酸化位点是否为调控SWEET表达的关键位点。另外,同一SWEET基因可能同时参与植物多种重要生理过程,如AtSWEET11和AtSWEET12不仅具有韧皮部装载功能[10],还参与种子和木质部发育[19, 40]。植物中的SWEET基因是如何实现功能多样化的?转录组学、蛋白组学、代谢组学等的综合运用,将有助于多层次地全面揭示SWEET基因家族的功能。此外,虽然已经在大多数高等植物中发现SWEET基因家族成员的存在,但是目前对于其功能研究主要集中在拟南芥和水稻上,而在其他作物上的功能研究亟待加强,以利于全面揭示SWEET基因家族的功能。如甜橙、葡萄、苹果、番茄、草莓、木瓜等重要园艺作物中发现了可能与果实发育相关的SWEET基因家族成员[12-14, 34, 35],加强其在这些植物中的功能研究将填补SWEET基因家族在果实发育中生理功能的空白。
尽管对SWEET基因家族开展研究的时间不长,但现有的结果已经表明它参与了植物韧皮部装载、花粉发育、蜜腺分泌、种子灌浆、叶片衰老、果实发育等重要生理过程,并在宿主-病原菌互作、各种逆境响应中起关键作用。这些研究结果说明,通过分子手段和技术调控SWEET基因的表达,人为控制植物碳水化合物的流向,在提高作物产量、品质以及培育抗病抗逆品种方面具有非常重大的潜在价值,对于应对全球粮食危机具有重要意义。
| [1] | Neuhaus HE. Transport of primary metabolites across the plant vacuolar membrane. FEBS Lett, 2007, 581 (12): 2223–2226. DOI:10.1016/j.febslet.2007.02.003 |
| [2] | Kühn C, Grof CP. Sucrose transporters of higher plants. Curr Opin Plant Biol, 2010, 13 (3): 288–298. |
| [3] | Ayre BG. Membrane-transport systems for sucrose in relation to whole-plant carbon partitioning. Mol Plant, 2011, 4 (3): 377–394. DOI:10.1093/mp/ssr014 |
| [4] | Slewinski TL. Diverse functional roles of monosaccharide transporters and their homologs in vascular plants: a physiological perspective. Mol Plant, 2011, 4 (4): 641–662. DOI:10.1093/mp/ssr051 |
| [5] | Chen LQ, Hou BH, Lalonde S, et al. Sugar transporters for intercellular exchange and nutrition of pathogens. Nature, 2010, 468 (7323): 527–532. DOI:10.1038/nature09606 |
| [6] | Chen LQ. SWEET sugar transporters for phloem transport and pathogen nutrition. New Phytol, 2014, 201 (4): 1150–1155. DOI:10.1111/nph.12445 |
| [7] | Chandran D. Co-option of developmentally regulated plant SWEET transporters for pathogen nutrition and abiotic stress tolerance. IUBMB Life, 2015, 67 (7): 461–471. DOI:10.1002/iub.1394 |
| [8] | Looger LL, Lalonde S, Frommer WB. Genetically encoded FRET sensors for visualizing metabolites with subcellular resolution in living cells. Plant Physiol, 2005, 138 (2): 555–557. DOI:10.1104/pp.104.900151 |
| [9] | Bermejo C, Haerizadeh F, Takanaga H, et al. Optical sensors for measuring dynamic changes of cytosolic metabolite levels in yeast. Nat Protoc, 2011, 6 (11): 1806–1817. DOI:10.1038/nprot.2011.391 |
| [10] | Chen LQ, Qu XQ, Hou BH, et al. Sucrose efflux mediated by SWEET proteins as a key step for phloem transport. Science, 2012, 335 (6065): 207–211. DOI:10.1126/science.1213351 |
| [11] | Yuan M, Wang S. Rice MtN3/saliva/SWEET family genes and their homologs in cellular organisms. Mol Plant, 2013, 6 (3): 665–674. DOI:10.1093/mp/sst035 |
| [12] | Patil G, Valliyodan B, Deshmukh R, et al. Soybean (Glycine max) SWEET gene family: insights through comparative genomics, transcriptome profiling and whole genome re-sequence analysis. BMC Genomics, 2015, 16 : 520. DOI:10.1186/s12864-015-1730-y |
| [13] | Chong J, Piron MC, Meyer S, et al. The SWEET family of sugar transporters in grapevine: VvSWEET4 is involved in the interaction with Botrytis cinerea. J Exp Bot, 2014, 65 (22): 6589–6601. DOI:10.1093/jxb/eru375 |
| [14] | Feng CY, Han JX, Han XX, et al. Genome-wide identification, phylogeny, and expression analysis of the SWEET gene family in tomato. Gene, 2015, 573 (2): 261–272. DOI:10.1016/j.gene.2015.07.055 |
| [15] | Sosso D, Luo D, Li QB, et al. Seed filling in domesticated maize and rice depends on SWEET-mediated hexose transport. Nat Genet, 2015, 47 (12): 1489–1493. DOI:10.1038/ng.3422 |
| [16] | Chen HY, Huh JH, Yu YC, et al. The Arabidopsis vacuolar sugar transporter SWEET2 limits carbon sequestration from roots and restricts Pythium infection. Plant J, 2015, 83 (6): 1046–1058. DOI:10.1111/tpj.2015.83.issue-6 |
| [17] | Guo WJ, Nagy R, Chen HY, et al. SWEET17, a facilitative transporter, mediates fructose transport across the tonoplast of Arabidopsis roots and leaves. Plant Physiol, 2014, 164 (2): 777–789. DOI:10.1104/pp.113.232751 |
| [18] | Klemens PA, Patzke K, Deitmer J, et al. Overexpression of the vacuolar sugar carrier AtSWEET16 modifies germination, growth, and stress tolerance in Arabidopsis. Plant Physiol, 2013, 163 (3): 1338–1352. DOI:10.1104/pp.113.224972 |
| [19] | Le Hir R, Spinner L, Klemens PA, et al. Disruption of the sugar transporters AtSWEET11 and AtSWEET12 affects vascular development and freezing tolerance in Arabidopsis. Mol Plant, 2015, 8 (11): 1687–1690. DOI:10.1016/j.molp.2015.08.007 |
| [20] | Büttner M, Sauer N. Monosaccharide transporters in plants: structure, function and physiology. BBA-Biomembranes, 2000, 1465 (1-2): 263–274. DOI:10.1016/S0005-2736(00)00143-7 |
| [21] | Sauer N. Molecular physiology of higher plant sucrose transporters. FEBS Lett, 2007, 581 (12): 2309–2317. DOI:10.1016/j.febslet.2007.03.048 |
| [22] | Hirai T, Heymann JAW, Maloney PC, et al. Structural model for 12-helix transporters belonging to the major facilitator superfamily. J Bacteriol, 2003, 185 (5): 1712–1718. DOI:10.1128/JB.185.5.1712-1718.2003 |
| [23] | Forrest LR, Krämer R, Ziegler C. The structural basis of secondary active transport mechanisms. BBA-Bioenergetics, 2011, 1807 (2): 167–188. DOI:10.1016/j.bbabio.2010.10.014 |
| [24] | Xuan YH, Hu YB, Chen LQ, et al. Functional role of oligomerization for bacterial and plant SWEET sugar transporter family. PNAS, 2013, 110 (39): E3685–E3694. DOI:10.1073/pnas.1311244110 |
| [25] | Xu Y, Tao Y, Cheung LS, et al. Structures of bacterial homologues of SWEET transporters in two distinct conformations. Nature, 2014, 515 (7527): 448–452. DOI:10.1038/nature13670 |
| [26] | Wang J, Yan C, Li Y, et al. Crystal structure of a bacterial homologue of SWEET transporters. Cell Res, 2014, 24 (12): 1486–1489. DOI:10.1038/cr.2014.144 |
| [27] | Lee Y, Nishizawa T, Yamashita K, et al. Structural basis for the facilitative diffusion mechanism by SemiSWEET transporter. Nat Commun, 2015, 6 : 6112. DOI:10.1038/ncomms7112 |
| [28] | Feng L, Frommer WB. Structure and function of SemiSWEET and SWEET sugar transporters. Trends Biochem Sci, 2015, 40 (8): 480–486. DOI:10.1016/j.tibs.2015.05.005 |
| [29] | Tao Y, Cheung LS, Li S, et al. Structure of a eukaryotic SWEET transporter in a homotrimeric complex. Nature, 2015, 527 (7577): 259–263. DOI:10.1038/nature15391 |
| [30] | Rennie EA, Turgeon R. A comprehensive picture of phloem loading strategies. PNAS, 2009, 106 (33): 14162–14167. DOI:10.1073/pnas.0902279106 |
| [31] | Frank Baker R, Leach KA, Braun DM. SWEET as Sugar: new sucrose effluxers in plants. Mol Plant, 2012, 5 (4): 766–768. DOI:10.1093/mp/SSS054 |
| [32] | Braun DM. SWEET! The pathway is complete. Science, 2012, 335 (6065): 173–174. DOI:10.1126/science.1216828 |
| [33] | Chu Z, Yuan M, Yao J, et al. Promoter mutations of an essential gene for pollen development result in disease resistance in rice. Gene Dev, 2006, 20 (10): 1250–1255. DOI:10.1101/gad.1416306 |
| [34] | Zheng QM, Tang Z, Xu Q, et al. Isolation, phylogenetic relationship and expression profiling of sugar transporter genes in sweet orange (Citrus sinensis). Plant Cell Tiss Org, 2014, 119 (3): 609–624. DOI:10.1007/s11240-014-0560-y |
| [35] | Wei X, Liu F, Chen C, et al. The Malus domestica sugar transporter gene family: identifications based on genome and expression profiling related to the accumulation of fruit sugars. Front Plant Sci, 2014, 5 : 569. |
| [36] | Ge YX, Angenent GC, Wittich PE, et al. NEC1, a novel gene, highly expressed in nectary tissue of Petunia hybrida. Plant J, 2000, 24 (6): 725–734. DOI:10.1046/j.1365-313x.2000.00926.x |
| [37] | Ge Y, Angenent G, Dahlhaus E, et al. Partial silencing of the NEC1 gene results in early opening of anthers in Petunia hybrida. Mol Genet Genomics, 2001, 265 (3): 414–423. DOI:10.1007/s004380100449 |
| [38] | Lin IW, Sosso D, Chen LQ, et al. Nectar secretion requires sucrose phosphate synthases and the sugar transporter SWEET9. Nature, 2014, 508 (7497): 546–549. DOI:10.1038/nature13082 |
| [39] | Wang E, Wang J, Zhu X, et al. Control of rice grain-filling and yield by a gene with a potential signature of domestication. Nat Genet, 2008, 40 (11): 1370–1374. DOI:10.1038/ng.220 |
| [40] | Chen LQ, Lin IW, Qu XQ, et al. A cascade of sequentially expressed sucrose transporters in the seed coat and endosperm provides nutrition for the Arabidopsis embryo. Plant Cell, 2015, 27 (3): 607–619. DOI:10.1105/tpc.114.134585 |
| [41] | Guan YF, Huang XY, Zhu J, et al. RUPTURED POLLEN GRAIN1, a member of the MtN3/saliva gene family, is crucial for exine pattern formation and cell integrity of microspores in Arabidopsis. Plant Physiol, 2008, 147 (2): 852–863. DOI:10.1104/pp.108.118026 |
| [42] | Sun MX, Huang XY, Yang J, et al. Arabidopsis RPG1 is important for primexine deposition and functions redundantly with RPG2 for plant fertility at the late reproductive stage. Plant Reprod, 2013, 26 (2): 83–91. DOI:10.1007/s00497-012-0208-1 |
| [43] | Wellmer F, Alves-Ferreira M, Dubois A, et al. Genome-wide analysis of gene expression during early Arabidopsis flower development. PLoS Genet, 2006, 2 (7): 1012–1024. |
| [44] | Engel ML, Holmes-Davis R, McCormick S. Green sperm. Identification of male gamete promoters in Arabidopsis. Plant Physiol, 2005, 138 (4): 2124–2133. DOI:10.1104/pp.104.054213 |
| [45] | Bock KW, Honys D, Ward JM, et al. Integrating membrane transport with male gametophyte development and function through transcriptomics. Plant Physiol, 2006, 140 (4): 1151–1168. DOI:10.1104/pp.105.074708 |
| [46] | Yang B, Sugio A, White FF. Os8N3 is a host disease-susceptibility gene for bacterial blight of rice. PNAS, 2006, 103 (27): 10503–10508. DOI:10.1073/pnas.0604088103 |
| [47] | Yuan M, Chu Z, Li X, et al. The bacterial pathogen Xanthomonas oryzae overcomes rice defenses by regulating host copper redistribution. Plant Cell, 2010, 22 (9): 3164–3176. DOI:10.1105/tpc.110.078022 |
| [48] | Salts Y, Sobolev I, Chmelnitsky I, et al. Genomic structure and expression of Lestd1, a seven-transmembrane-domain proteon-encoding gene specically expressed in tomato pollen. Isr J Plant Sci, 2005, 53 (2): 79–88. |
| [49] | Quiapim AC, Brito MS, Bernardes LA, et al. Analysis of the Nicotiana tabacum stigma/style transcriptome reveals gene expression differences between wet and dry stigma species. Plant Physiol, 2009, 149 (3): 1211–1230. DOI:10.1104/pp.108.131573 |
| [50] | Zhou Y, Liu L, Huang W, et al. Overexpression of OsSWEET5 in rice causes growth retardation and precocious senescence. PLoS One, 2014, 9 (4): e94210. DOI:10.1371/journal.pone.0094210 |
| [51] | Quirino BF, Normanly J, Amasino RM. Diverse range of gene activity during Arabidopsis thaliana leaf senescence includes pathogen-independent induction of defense-related genes. Plant Mol Biol, 1999, 40 (2): 267–278. DOI:10.1023/A:1006199932265 |
| [52] | Seo PJ, Park JM, Kang SK, et al. An Arabidopsis senescence-associated protein SAG29 regulates cell viability under high salinity. Planta, 2011, 233 (1): 189–200. DOI:10.1007/s00425-010-1293-8 |
| [53] | Zhao CR, Ikka T, Sawaki Y, et al. Comparative transcriptomic characterization of aluminum, sodium chloride, cadmium and copper rhizotoxicities in Arabidopsis thaliana. BMC Plant Biol, 2009, 9 : 32. DOI:10.1186/1471-2229-9-32 |
| [54] | Lauter ANM, Peiffer GA, Yin T, et al. Identification of candidate genes involved in early iron deficiency chlorosis signaling in soybean (Glycine max) roots and leaves. BMC Genomics, 2014, 15 (1): 702. DOI:10.1186/1471-2164-15-702 |
| [55] | Lopes MS, Araus JL. Comparative genomic and physiological analysis of nutrient response to NH4+, NH4+: NO3- and NO3- in barley seedlings. Physiol Plantarum, 2008, 134 (1): 134–150. DOI:10.1111/ppl.2008.134.issue-1 |
| [56] | Redondo-Nieto M, Maunoury N, Mergaert P, et al. Boron and calcium induce major changes in gene expression during legume nodule organogenesis. Does boron have a role in signalling?[J]New Phytol, 2012, 195 (1): 14–19. |
| [57] | Yang B, White FF. Diverse members of the AvrBs3/PthA family of type Ⅲ effectors are major virulence determinants in bacterial blight disease of rice. Mol Plant Microbe In, 2004, 17 (11): 1192–1200. DOI:10.1094/MPMI.2004.17.11.1192 |
| [58] | Antony G, Zhou J, Huang S, et al. Rice xa13 recessive resistance to bacterial blight is defeated by induction of the disease susceptibility gene Os-11N3. Plant Cell, 2010, 22 (11): 3864–3876. DOI:10.1105/tpc.110.078964 |
| [59] | Römer P, Recht S, Strauβ T, et al. Promoter elements of rice susceptibility genes are bound and activated by specific TAL effectors from the bacterial blight pathogen, Xanthomonas oryzae pv. oryzae. New Phytol, 2010, 187 (4): 1048–1057. DOI:10.1111/j.1469-8137.2010.03217.x |
| [60] | Liu Q, Yuan M, Zhou Y, et al. A paralog of the MtN3/saliva family recessively confers race-specific resistance to Xanthomonas oryzae in rice. Plant Cell Environ, 2011, 34 (11): 1958–1969. DOI:10.1111/j.1365-3040.2011.02391.x |
| [61] | Yu Y, Streubel J, Balzergue S, et al. Colonization of rice leaf blades by an African strain of Xanthomonas oryzae pv. oryzae depends on a new TAL effector that induces the rice nodulin-3 Os11N3 gene. Mol Plant Microbe In, 2011, 24 (9): 1102–1113. DOI:10.1094/MPMI-11-10-0254 |
| [62] | Li T, Huang S, Zhou J, et al. Designer TAL effectors induce disease susceptibility and resistance to Xanthomonas oryzae pv. oryzae in rice. Mol Plant, 2013, 6 (3): 781–789. DOI:10.1093/mp/sst034 |
| [63] | Streubel J, Pesce C, Hutin M, et al. Five phylogenetically close rice SWEET genes confer TAL effector-mediated susceptibility to Xanthomonas oryzae pv. oryzae. New Phytol, 2013, 200 (3): 808–819. DOI:10.1111/nph.12411 |
| [64] | Zhou J, Peng Z, Long J, et al. Gene targeting by the TAL effector PthXo2 reveals cryptic resistance gene for bacterial blight of rice. Plant J, 2015, 82 (4): 632–643. DOI:10.1111/tpj.12838 |
| [65] | Cohn M, Bart RS, Shybut M, et al. Xanthomonas axonopodis virulence is promoted by a transcription activator-like effector-mediated induction of a SWEET sugar transporter in cassava. Mol Plant Microbe In, 2014, 27 (11): 1186–1198. DOI:10.1094/MPMI-06-14-0161-R |
| [66] | Hu Y, Zhang J, Jia H, et al. Lateral organ boundaries 1 is a disease susceptibility gene for citrus bacterial canker disease. PNAS, 2014, 111 (4): E521–E529. DOI:10.1073/pnas.1313271111 |
| [67] | Siemens J, Keller IJ, Sarx J, et al. Transcriptome analysis of Arabidopsis clubroots indicate a key role for cytokinins in disease development. Mol Plant Microbe In, 2006, 19 (5): 480–494. DOI:10.1094/MPMI-19-0480 |
| [68] | Kay S, Hahn S, Marois E, et al. Detailed analysis of the DNA recognition motifs of the Xanthomonas type Ⅲ effectors AvrBs3 and AvrBs3Δrep16. Plant J, 2009, 59 (6): 859–871. DOI:10.1111/tpj.2009.59.issue-6 |
| [69] | Yu X, Wang X, Wang C, et al. Wheat defense genes in fungal (Puccinia striiformis) infection. Funct Integr Genomic, 2010, 10 (2): 227–239. DOI:10.1007/s10142-010-0161-8 |
| [70] | Kryvoruchko IS, Sinharoy S, Torres-Jerez I, et al. MtSWEET11, a nodule-specific sucrose transporter of Medicago truncatula. Plant Physiol, 2016, 171 (1): 554–565. DOI:10.1104/pp.15.01910 |
| [71] | Yamada K, Osakabe Y, Mizoi J, et al. Functional analysis of an Arabidopsis thaliana abiotic stress-inducible facilitated diffusion transporter for monosaccharides. J Biol Chem, 2010, 285 (2): 1138–1146. DOI:10.1074/jbc.M109.054288 |
| [72] | Yue C, Cao HL, Wang L, et al. Effects of cold acclimation on sugar metabolism and sugar-related gene expression in tea plant during the winter season. Plant Mol Biol, 2015, 88 (6): 591–608. DOI:10.1007/s11103-015-0345-7 |
| [73] | Chardon F, Bedu M, Calenge F, et al. Leaf fructose content is controlled by the vacuolar transporter SWEET17 in Arabidopsis. Curr Biol, 2013, 23 (8): 697–702. DOI:10.1016/j.cub.2013.03.021 |
| [74] | He F, Kang J, Zhou X, et al. Variation at the transcriptional level among Chinese natural populations of Arabidopsis thaliana in response to cold stress. Chinese Sci Bull, 2008, 53 (19): 2989–2999. |
| [75] | Durand M, Porcheron B, Hennion N, et al. Water deficit enhances C export to the roots in Arabidopsis thaliana plants with contribution of sucrose transporters in both shoot and roots. Plant Physiol, 2016, 170 (3): 1460–1479. |