2. 吉林大学中日联谊医院,长春 130033
2. China-Japan Union Hospital of Jilin University, Changchun 130033
结肠癌是人类高发恶性肿瘤之一,其发病率一直呈上升趋势,全球每年患结肠癌的病例超过100万人[1]。目前,结肠癌的治疗手段以手术治疗为主,辅以化疗、放疗等治疗手段,针对结肠癌的常用抗肿瘤药物包括5-Fu(5-氟尿嘧啶)、伊立替康、奥沙利铂、卡培他滨等[2],但术后肿瘤易复发,且副作用不容忽视。近年来,基因治疗药物、免疫治疗药物等靶向治疗药物得到了快速发展[3],为结肠癌的治疗开辟了新途径。
分子靶向治疗是以肿瘤细胞过度表达的分子作为靶位,选择针对性的阻断剂,能够作用于肿瘤细胞生长、运动等的信号传导通路或诱导免疫因子识别并消灭肿瘤细胞等途径,从而使肿瘤细胞生长变慢或者发展停止[4, 5]。研究发现,在胃肠道肿瘤发生发展的过程中,胆囊收缩素2型受体(CCK2R)在肿瘤细胞中的表达显著高于正常细胞,在部分结肠癌、大肠癌、胃癌细胞系中的过表达更加突出[6-9],是结直肠癌诊断和治疗的理想靶点。
本研究根据结肠癌与正常组织表面CCK2R数量与亲和力的巨大差异,利用基因工程技术构建新型重组毒素rCCK96-104PE38,即截取全长CCK的第96-104号氨基酸,反向重组后作为导向单元与具有高效细胞毒性的PE38(绿脓杆菌外毒素)结合,获得可以靶向高效杀伤结肠癌细胞的分子药物,并通过结肠癌体内体外实验探索其靶向特性,为临床前试验奠定基础。
1 材料与方法 1.1 材料 1.1.1 主要试剂Ex Taq DNA聚合酶、限制性内切酶Nhe Ⅰ和BamH Ⅰ、低分子量蛋白Marker、DL2000核酸Marker、pMD-18T Kit、T4连接酶均购自日本TaKaRa公司;胶回收Kit、质粒小提Kit购自美国Axygen公司;卡那霉素、氨苄青霉素、IPTG购自北京鼎国公司;Ni-NTA亲和层析介质、Tricorn 10/150玻璃柱购自瑞典GE公司;rTEV酶购自北京索莱宝公司;胎牛血清、RPMI1640培养基购自美国Gibco公司;PVDF膜购自美国Millipore公司;荧光染料Dylight 488,HRP标记羊抗鼠IgG抗体购自上海艾博抗公司;PE38单克隆抗体3B9为本实验室制备;其他化学试剂均为国产分析纯。
1.1.2 质粒、菌株、细胞、裸鼠pET-28a质粒购自德国Novagen公司;pET-rG17PE38重组质粒、感受态BL21(DE3)PLysS、感受态DH5α、人肝细胞LO2、大肠癌细胞系SW116、结肠癌细胞系HCT8、SW620、SW480均为本实验室保存,裸鼠购自上海斯莱克实验动物有限公司。
1.2 方法 1.2.1 rCCK96-104PE38原核表达菌株的构建 1.2.1.1 引物以本实验室构建并保存到pET-rG17PE38为模板,利用PCR方法将反向的CCK96-104片段基因与PE38基因进行融合,并引入了rTEV酶特异性切割位点,人工合成引物为:
F1:5' -TTCGACATGTGGGGCATGTATGACCATATGGCCGAAGAGGGC-3' ,
F2:5' -GCTAGC GAAAACCTGTATTTTCAGGGCTTCGACATGTGGGGCATG-3' ,
R:5' -GGATCCTTACAGCTCGTCCTTCGGCG-3' ,其中,下划线分别为Nhe Ⅰ和BamH Ⅰ酶切位点。
1.2.1.2 原核表达载体的构建将PCR产物与pET-28a质粒分别进行双酶切,然后通过1%琼脂糖凝胶电泳鉴定双酶切效果,并使用胶回收试剂盒回收目的基因和载体片段,使用T4连接酶水浴16℃过夜连接,连接产物转化到BL21(DE3)PLysS感受态细胞中。
1.2.2 重组毒素rCCK96-104PE38的表达与鉴定 1.2.2.1 低温诱导表达将重组菌按1:100的比例接入LB培养基(Kana 50 ng/mL)中,于37℃ 7,1.5 h后,将培养箱温度降至16℃ 6将培养箱温度IPTG至终浓度0.1 mmol/L,摇培18 h。
1.2.2.2 Western blot鉴定将表达的rCCK96-104PE38重组蛋白进行SDS-PAGE凝胶电泳,再通过电转仪转移到PVDF膜上,使用5%脱脂奶粉4℃封闭过夜后,先后加入PE38的单克隆抗体3B9(本实验室制备),和HRP标记羊抗鼠IgG二抗。最后加入ECL化学发光显色液显色呈像。
1.2.3 重组毒素rCCK96-104PE38的纯化 1.2.3.1 Ni-NTA亲和层析使用ÄKTA蛋白纯化仪进行纯化。首先用5-10个柱体积的Ni-NTA亲和层析平衡缓冲液Buffer A(50 mmol/L Tris-HCl,0.5 mol/L NaCl,10 mmol/L咪唑,10%甘油,pH7.0)充分平衡Ni-NTA亲和层析柱;将超声上清注入缓慢注入层析柱,再用洗脱缓冲液Buffer B(50 mmol/L Tris-HCl,0.5 mol/L NaCl,500 mmol/L咪唑,10%甘油,pH7.0)调节混合液咪唑浓度按梯度洗脱下目的蛋白。
1.2.3.2 rTEV酶切除组氨酸标签加入rTEV酶对组氨酸标签切割,再通过Ni-NTA亲和层析获得切割标签后的目的蛋白。
1.2.4 重组毒素rCCK96-104PE38体外抑瘤实验 1.2.4.1 rCCK96-104PE38体外肿瘤细胞杀伤活性检测将对数生长期的HCT116细胞以及人肝细胞LO2分别经胰酶消化后,以5×103个细胞/孔铺在96孔细胞培养板中,待细胞贴壁后加入终浓度为2 000 ng/mL的rCCK96-104PE38,用CCK-8试剂盒测定不同时间点重组毒素对肿瘤细胞的抑制率。
1.2.4.2 受体免疫荧光检测在培养好的HCT116细胞中加入4%多聚甲醛固定30 min;5%胎牛血清封闭30 min;加入终浓度为2 000 ng/mL rCCK96-104PE38KDEL重组蛋白,37℃孵育10 min,再先后孵育PE38单抗和荧光二抗,通过荧光显微镜观察。
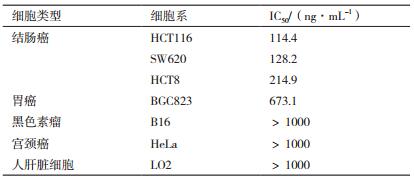
1.2.4.3 肿瘤抑制率测定在对数生长期的人正常肝细胞、结肠癌细胞系HCT116、HCT8、SW620、胃癌细胞系BGC823、黑色素瘤B16、宫颈癌细胞系HeLa中,加入不同浓度的rCCK96-104PE38重组蛋白,孵育48 h后,使用CCK-8试剂盒测定肿瘤抑制率及IC50值。
1.2.5 重组毒素rCCK96-104PE38动物体内抑瘤实验 1.2.5.1 免疫缺陷鼠肿瘤模型的建立取1×107个HCT116细胞溶于200 μL生理盐水中,用注射器注入裸鼠右前肢腋下。7 d后观察小鼠注射部位是否出现肿块。
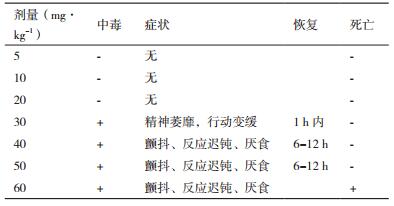
1.2.5.2 rCCK96-104PE38治疗肿瘤模型选取肿瘤体积达到50-100 mm3的肿瘤模型小鼠30只,平均分成6组,G1组:每日每只注射200 μL生理盐水;G2组:每日每只注射5 mg/kg rCCK96-104PE38;G3组:每日每只注射10 mg/kg rCCK96-104PE38;G4组:每日每只注射20 mg/kg rCCK96-104PE38;G5组:每日每只注射10 mg/kg奥沙利铂;G6组:每日每只注射10 mg/kg奥沙利铂和10 mg/kg rCCK96-104PE38。注射方式为尾静脉注射,连续注射14 d,治疗结束后将小鼠处死,记录瘤重、瘤体积,体重等指标。
2 结果 2.1 rCCK96-104PE38重组毒素的表达与鉴定结果如图 1所示,经10% SDS-PAGE电泳分析,诱导后的重组菌株在40 kD附近表达重组蛋白,与设计的rCCK96-104PE38大小相符。Western blot结果表明,该重组蛋白能与PE38抗体特异性结合。
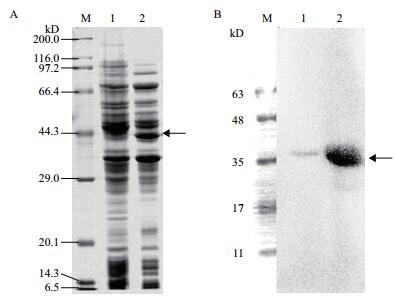
|
| 图 1 重组蛋白rCCK96-104PE38的SDS-PAGE重组蛋白表达(A)与Western-blot鉴定结果(B) M:蛋白Marker;1:pET28a空载体诱导蛋白;2:pET28a-rCCK96-104PE38诱导蛋白 |
经10% SDS-PAGE凝胶电泳分析,结果(图 2)显示,在300-450 mmol/L咪唑浓度下,重组蛋白rCCK96-104PE38被洗脱下来。
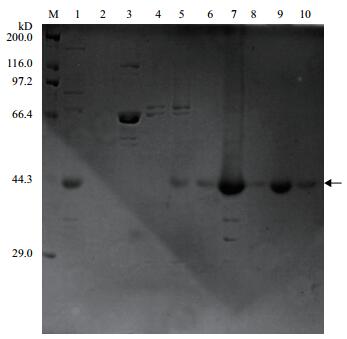
|
| 图 2 Ni-NTA金属螯合亲和层析纯化(梯度洗脱) M:即用型蛋白分子量标准(宽);1:流穿;2-11:50、100、150、200、250、300、350、400、450和500 mmol/L咪唑浓度洗脱收集液 |
如图 3所示,在培养基中加入rCCK96-104PE38后,结肠癌细胞HCT116迅速凋亡,其致凋亡速率与PE毒素相近,而对人正常肝细胞没有显著影响;而PE毒素不仅能杀死肿瘤细胞,也能够致死正常的肝细胞,显示出对真核细胞的广谱杀伤性。

|
| 图 3 抑制曲线 A:结肠癌细胞系HCT116;B:人肝细胞LO2 |
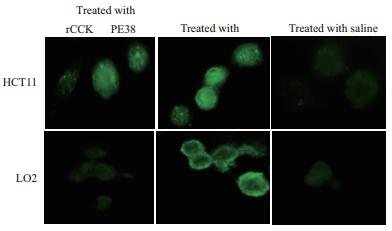
通过间接免疫荧光实验,发现rCCK96-104PE38重组蛋白能够特异性的吸附在结肠癌细胞HCT116表面,而在肝细胞LO2上检测不到强的绿色荧光;PE毒素在HCT116及LO2细胞上均有结合,见图 4。
|
| 图 4 间接免疫荧光检测rCCK96-104PE38在靶细胞上的定位 |
通过CCK8法测定不同浓度的重组蛋白对不同细胞的抑制率,并使用SPSS统计分析软件计算获得相应的IC50值(半抑制浓度)。如表 1所示,rCCK96-104PE38对结肠癌细胞系的抑制效果最好,对胃癌细胞BGC823也有一定的作用,而对黑色素瘤B16、宫颈癌HeLa、人肝脏细胞LO2均没有显著抑制效果,与预期相符。
裸鼠模型在单次注射30 mg/kg时即出现中毒现象,当剂量增加到60 mg/kg时有小鼠出现死亡(表 2)。
以不同剂量的重组毒素和常规药物对结肠癌裸鼠模型进行治疗发现,20 mg/kg的rCCK96-104PE38能够显著抑制肿瘤的生长,与常规化疗药物奥沙利铂联合给药的抑瘤效果最好,见图 5。

|
| 图 5 体内抑瘤效果 A:肿瘤体积变化曲线;B:不同给药的肿瘤抑制率比较;G1:生理盐水;G2:5 mg/kg rCCK96-104PE38;G3:10 mg/kg rCCK96-104PE38;G4:20 mg/kg rCCK96-104PE38;G5:10 mg/kg奥沙利铂;G6:10 mg/kg奥沙利铂+10 mg/kg rCCK96-104PE38 |
重组免疫毒素是一种融合了靶向分子和毒素的人造蛋白,根据靶向分子的不同主要分为两类,一类是融合了靶向某种特异性受体的天然配体,一类是融合的抗体或单链抗体[10, 11],本研究的rCCK96-104PE38重组免疫毒素就属于第一类重组免疫毒素,具有特异性靶向杀伤结肠癌肿瘤细胞的能力。
PE毒素,即绿脓杆菌外毒素,由638个氨基酸构成的一个单链多肽,属于双组分AB毒素家族[12]。PE毒素的优势在于,普通人体内没有PE毒素的预存抗体,而且PE毒素不仅毒性强,而且毒性机理研究已经很清楚,便于进行编辑改造及活性表达[12, 13]。通过将PE分子非特异结构域1-252位和365-380位的氨基酸残基去除,得到了38 kD大小的PE38,具有更低的免疫原性,同时,将PE38羧基端的REDLK突变为KDEL,能够使细胞毒性提升6-10倍[14, 15]。
胆囊收缩素(CCK)是由十二指肠和近端盲肠的Ⅰ型肠内分泌细胞和大脑神经元合成分泌,其主要生理功能是刺激胰腺分泌、胆囊收缩、抑制胃酸分泌,产生饱腹感等[16]。CCK发挥作用均与CCK2R(胆囊收缩素2型受体)相关,而CCK2R在肿瘤细胞中过表达,因此可以将CCK作为重组免疫毒素特异性识别肿瘤细胞的识别元件[17]。CCK在人体内以多种长短不同的分子形式存在,均为含115个氨基酸的CCK原加工剪切形成的多肽[18],本研究最终选择了能发挥CCK2R亲和作用的第96-104位的Asp-Tyr-Met-Gly-Trp-Met-Asp-Phe-Gly九个氨基酸作为重组毒素的导向元件。
在测定rCCK96-104PE38重组免疫毒素对不同细胞的抑制效果时发现,其对胃癌细胞系BGC823也有明显的致凋亡作用,原因是CCK2R不仅在结肠癌细胞上高表达,在部分胃癌细胞、部分胰腺癌中也高表达[19-21],进一步证实了rCCK96-104PE38是通对CCK2R进行定位并发挥细胞毒作用。
4 结论本实验室成功构建rCCK96-104PE38的原核表达载体,低温诱导表达出可溶性重组毒素蛋白,并通过Western blotting验证。重组蛋白经Ni-NTA亲和层析纯化。通过体外细胞实验和结肠癌裸鼠模型体内实验证实,rCCK96-104PE38具有靶向杀伤结肠癌的功能。
| [1] | Cunningham D, Atkin W, Lenz HJ, et al. Colorectal cancer. Lancet, 2010, 375 : 1030–1047. DOI:10.1016/S0140-6736(10)60353-4 |
| [2] | 宫媛, 吴本俨. 循证医学评价结肠癌辅助化疗药物及新进展. 中国新药杂志, 2007, 16(10): 757–761. DOI:10.3321/j.issn:1003-3734.2007.10.006 |
| [3] | 刘静, 黄红. 结肠癌发病机制中原癌基因与抑癌基因研究及相关药物治疗进展. 中国药房, 2014, 25(45): 4302–4304. DOI:10.6039/j.issn.1001-0408.2014.45.25 |
| [4] | Shan L, Liu Y, Wang P. Recombinant immunotoxin therapy of solid tumors:Challenges and strategies. Journal of Basic and Clinical Medicine, 2013, 2 (2): 1–6. |
| [5] | Mazor R, Eberle JA, Hu XB, et al. Recombinant immunotoxin for cancer treatment with low immunogenicity by identification and silencing of human T-cell epitopes. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111 (23): 8571–8576. DOI:10.1073/pnas.1405153111 |
| [6] | Feng XL, Liu ZS, Liu XL, et al. Establishment of a three-step purification scheme for a recombinant protein rG17PE38 and its characteristics identification. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2015, 981-982 : 48–56. DOI:10.1016/j.jchromb.2015.01.008 |
| [7] | Quattrone A, Dewaele B, Wozniak A, et al. Promoting role of cholecystokinin 2 receptor (CCK2R) in gastrointestinal stromal tumour pathogenesis. The Journal of Pathology, 2012, 228 (4): 565–574. DOI:10.1002/path.4071 |
| [8] | Hayakawa Y, Jin G, Wang H, et al. CCK2R identifies and regulates gastric antral stem cell states and carcinogenesis. Gut, 2015, 64 (4): 544–553. DOI:10.1136/gutjnl-2014-307190 |
| [9] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA:A Cancer Journal for Clinicians, 2016, 66 (2): 115–132. DOI:10.3322/caac.21338 |
| [10] | Kaplan G, Lee F, Onda M, et al. Protection of the furin cleavage site in low-toxicity immunotoxins based on Pseudomonas Exotoxin A[J]. Toxins (Basel), 2016, 8(8):pii:E217. |
| [11] | Liu XF, Xiang LM, Zhou Q, et al. Actinomycin D enhances killing of cancer cells by immunotoxin RG7787 through activation of the extrinsic pathway of Apoptosis. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113 (38): 10666–10671. DOI:10.1073/pnas.1611481113 |
| [12] | Michalska M, Wolf P. Pseudomonas Exotoxin A:optimized by evolution for effective killing. Frontiers in Microbiology, 2015, 6 : 963. |
| [13] | 祁志荣, 李虹. PE类重组免疫毒素的研究进展. 微生物学免疫学进展, 2006, 34(1): 50–53. |
| [14] | 杜世彧. 绿脓杆菌外毒素A的结构、功能及其重组毒素. 生物化学与生物物理进展, 1995, 22(2): 112–117. |
| [15] | Hui Q, Ma J, Song J, et al. In vitro and in vivo studies of antitumor effects of the recombinant immunotoxin MSH-PE38KDEL on melanoma. Neoplasma, 2014, 61 (4): 392–400. DOI:10.4149/neo_2014_048 |
| [16] | 杜静, 张连峰, 秦川. 胆囊收缩素作用的研究进展. 中国比较医学杂志, 2007, 17(4): 233–236. |
| [17] | Sherman PJ, Separovic F, Bowie JH. The investigation of membrane binding by amphibian peptide agonists of CCK2R using (31) P and (2) H solid-state NMR. Peptides, 2014, 55 : 98–102. DOI:10.1016/j.peptides.2014.02.007 |
| [18] | Kossatz S, Behe M, Mansi R, et al. Multifactorial diagnostic NIR imaging of CCK2R expressing tumors. Biomaterials, 2013, 34 (21): 5172–5180. DOI:10.1016/j.biomaterials.2013.03.073 |
| [19] | Reubi JC. Targeting CCK receptors in human cancers. Curr Top Med Chem, 2007, 7 : 3. DOI:10.2174/156802607779318343 |
| [20] | Roy J, Putt KS, Oppola DS, et al. Assessment of cholecystokinin 2 receptor (CCK2R) in neoplastic tissue. Oncotarget, 2016, 7 (12): 14605–14615. |
| [21] | Gao S, Song J, Chen F, et al. A novel immunotoxin-rCCK8PE38 targeting of CCK-R overexpressed colon cancers. J Drug Target, 2015, 23 (5): 462–468. DOI:10.3109/1061186X.2015.1009073 |