多烯紫杉醇是经结构修饰的紫杉烷类抗肿瘤药物的典型代表,具有高效广谱的抗肿瘤活性,目前已经成为卵巢癌、乳腺癌等肿瘤治疗的一线药物[1]。10-脱乙酰基巴卡亭Ⅲ(10-DAB)是合成该药物的重要前体(图 1)。

|
| 图 1 多烯紫杉醇的化学结构式 |
目前报道的10-脱乙酰基巴卡亭Ⅲ的制备方法主要包括:(1)杉科植物中提取:10-DAB在不同种植物中的含量差异较大,但总体含量偏低,一般在0.00513%-0.175%左右。此过程需要多次层析、梯度洗脱、多次重结晶后才能获得精制品,不仅造成10-DAB的大量损失,降低了收率,而且纯化过程中大量的使用乙腈和石油醚等对环境不友好的有机溶剂[2];(2)化学合成:利用紫杉醇生产过程中的废料化学合成10-DAB。但此过程步骤繁琐,条件苛刻,反应中使用各种对环境不友好的有机溶剂[3];(3)微生物转化:微生物转化是指某一微生物将一种物质(底物)转化成为另一种物质(产物)的过程,其本质是利用生物体所产生的酶对外源化合物进行酶催化反应,它具有反应选择性强(位置选择性、立体选择性)、反应条件温和、副产物少和不造成环境污染等优点[4, 5]。目前,文献报道的能利用微生物转化生成10-DAB的底物有巴卡亭Ⅲ[6]、紫杉醇[7]和7-表-10-去乙酰巴卡亭Ⅲ[8]等。其中,利用巴卡亭Ⅲ作为底物,通过转化反应生成10-DAB的微生物主要有白色类诺卡氏菌(Nocardioides albus)[6]、藤黄类诺卡氏菌(Nocardioides luteus)[9]、稻草假单胞菌(Pseudomonas straminea)[10]和成团泛菌(Pantoea agglomerans)[11]等。
Hanson等[9]以巴卡亭Ⅲ为底物,从土壤中分离得到一株能将巴卡亭Ⅲ转化生成10-DAB的菌株藤黄类诺氏杆菌(Nocardioides luteus)SC 13912,确定了该酶的最适反应温度为37℃,最佳pH为8.0,酶活性在10%甲醇中较高。
王晓鹏[6]选取课题组前期保存的白色类诺卡氏菌4.1334为研究对象,对该菌株的发酵培养条件进行了初步优化发现,最佳发酵培养时间为8 d,且采用甲苯破碎法可以有效地使该菌的胞内酶释放。在此破碎条件下该菌株转化巴卡亭Ⅲ生成10-DAB的生成率在转化时间为96 h时达到最大值,为9%。转化反应体系中的最适有机溶剂甲醇比例在10%-20%之间。
目前,该领域的工作多集中在转化菌株筛选和鉴定、催化酶分离纯化及其酶学性质研究等方面,关于转化工艺的系统优化还少见报道。转化工艺条件的优化是提高目的产物生成效率的重要方式。常规的单因素水平试验方法是针对某一因素的不同取值采用多次实验,对于获得最优参数所需的试验次数较多,耗时较长,且不能考虑因素之间的相互作用。而响应面法[12, 13]是一种统计技术的合称。它试图用最少试验次数对因素的主效果进行尽可能精确的估计,能在设计合理的有限实验次数下,评价各因子对生物过程的影响,探清其交互作用的程度,最后求得最优条件。其中Box-Behnken中心组合设计是较常用的方法[14]。微生物转化效率的高低受到多个因素的影响,如菌体生理状态、菌体浓度、底物浓度、转化温度、转化时间等,且这些因素之间存在着明显的交互作用[15],目前,利用响应面法优化巴卡亭Ⅲ生成10-DAB的转化工艺的报道还比较少。
本研究以课题组前期从泰达污水处理厂污泥中已分离得到的能转化巴卡亭Ⅲ生成10-DAB的成团泛菌P2-A-8为对象,以巴卡亭Ⅲ为底物,以10-DAB生成率为指标,运用响应面法分析中的因素筛选实验、最陡爬坡实验以及中心组合设计实验,对该菌株的转化工艺进行统计学优化,旨在为进一步提高10-DAB的生成量,以及多烯紫杉醇生物合成提供参考。
1 材料与方法 1.1 材料 1.1.1 菌种成团泛菌P2-A-8,来源于泰达污水处理厂污泥,保藏于天津科技大学生物工程学院微生物制药研究室。
1.1.2 主要试剂巴卡亭Ⅲ,纯度≥98%,购自上海源叶生物科技有限公司;10-脱乙酰巴卡亭Ⅲ(10-DAB),纯度99%,购自天津希恩思生化科技有限公司。乙腈为天津市风船化学试剂科技有限公司产品;甲醇为天津市康科德科技有限公司产品。
1.1.3 培养基LB液体培养基(L-1):酵母提取物10 g,蛋白胨5 g,氯化钠10 g,pH 7.2,121℃灭菌20 min。
1.2 方法 1.2.1 成团泛菌P2-A-8的生长特性分析从甘油管中取20 μL菌株P2-A-8的保存液接种到装有50 mL LB液体培养基的250 mL三角瓶中,30℃,200 r/min振荡培养12 h。以0.5%接种量将上述培养液转接到装有50 mL LB液体培养基的250 mL三角瓶中,30℃,200 r/min振荡培养。每隔一段时间取样测定OD600,绘制生长曲线。实验中设定3个平行。
1.2.2 成团泛菌P2-A-8转化巴卡亭Ⅲ生成10-DAB的初始工艺条件从甘油管中取20 μL菌株P2-A-8的保存液接种于含有50 mL LB液体培养基的250 mL三角瓶中,30℃,200 r/min培养12 h。以0.5%的接种量将上述培养液转接到含有50 mL LB液体培养基的250 mL三角瓶中,30℃,200 r/min振荡培养到一定时期(此时OD600达到3.5左右),此时,加入溶解于甲醇的巴卡亭Ⅲ溶液,使其终浓度为0.006 mg/mL,37℃,200 r/min转化3 d。实验中以不投加底物只加入菌体的LB培养液作为菌体对照组,以只加入底物不加入菌体的LB培养基作为底物对照组。
1.2.3 成团泛菌P2-A-8转化巴卡亭Ⅲ生成10-DAB工艺的响应面优化按照1.2.2的方法进行菌株P2-A-8的一级培养和二级培养,收集二级培养到不同时期的菌体,并将其分别转接到含有50 mL新鲜LB液体培养基的250 mL三角瓶中,将菌液初始OD600值调整为不同的水平后,加入不同浓度的溶解于甲醇的巴卡亭Ⅲ溶液,200 r/min,在不同的条件下进行转化。以10-DAB生成率为指标,运用响应面法分析中的因素筛选实验、最陡爬坡实验以及中心组合设计实验,对菌株的转化工艺进行统计学优化。
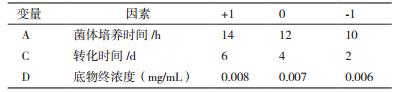
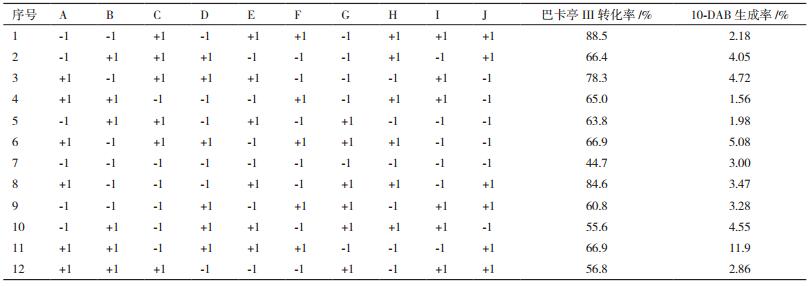
1.2.3.1 Plackett-Burman实验设计选用N=12的Plackett-Burman实验设计进行关键因素的筛选。选择的因素和水平见表 1。由表 1可知,5个影响因素(菌体培养时间、菌体浓度、底物终浓度、转化时间、转化温度)分别设为自变量A、B、C、D、E,每个影响因素取高低两个水平。巴卡亭Ⅲ的转化率和10-DAB生成率为因变量,并预留5个空项作为误差分析。利用Design Expert软件对实验结果进行分析,根据各因素的F值进行显著性排名,选择Prob>F值小于0.30的因素作为关键因素用于后续的最陡爬坡试验。
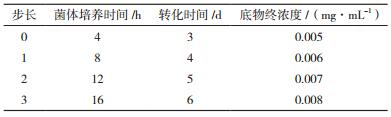
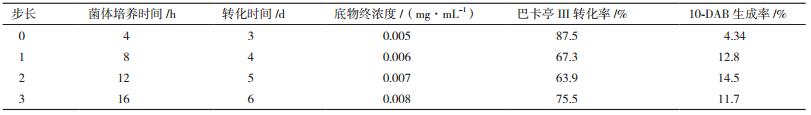
通过最陡爬坡试验对Plackett-Burman试验筛选得到的关键因素的水平展开进一步优化,并根据实际情况确定合适的步长,以快速逼近最大响应区域(表 2)。每组实验设计3个平行。
以最陡爬坡试验得到的最高点作为中心组合实验(Box-Behnken)的中心点,设计了三因素三水平共12个实验点的响应面分析(表 3)。实验结果用Design Expert软件分析,根据拟合得到的回归方程,在一定水平范围内求取最佳值。
在求得的最佳条件下进行转化实验,将得到的实验值与理论预测值进行对比,以确定模型的可靠性。
1.2.4 底物转化率和产物生成率的检测转化结束后向转化液中加入等体积的氯仿,37℃,200 r/min萃取1.5 h,然后经5 000 r/min离心5 min,得到氯仿萃取液。相同的方法萃取3次,合并收集萃取液,旋蒸去掉有机溶剂。蒸干后的样品用1 mL甲醇溶解,用0.22 μm滤膜进行过滤,滤液分别用于薄层层析法(TLC)和高效液相色谱法(HPLC)进行分析。
薄层层析分析(TLC)展开剂采用丙酮:石油醚=2:3(V/V),显色剂采用硫酸:乙醇=1:9(V/V),105℃下烘烤显色1-3 min,观察斑点的颜色和对应的比移值。
高效液相色谱的条件:液相色谱仪:Agilent Technologies 1260 Infinity Series;紫外检测器:Agilent Technologies 1200 Infinity Series;色谱柱:Agela C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇:乙腈:水=24:37:39(V/V/V);检测波长:227 nm;流速:0.8 mL/min;柱温:室温;进样体积:10 μL。根据谱图中的保留时间和标准曲线,确定转化液中底物巴卡亭Ⅲ和目标产物10-DAB的含量。
1.2.5底物转化率和目标产物生成率的计算10-DAB生成率(%)=转化液中产物质量/投加的底物质量×100;巴卡亭Ⅲ转化率(%)=(1-转化液中残余的底物质量/投加的底物质量)×100。
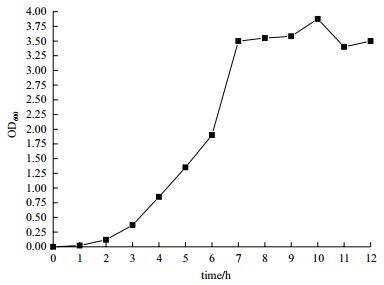
2 结果 2.1 成团泛菌P2-A-8的生长特性分析由图 2可知,成团泛菌P2-A-8的延滞期为0-2 h,对数期为2-7 h,此时菌体的OD600值由0.12迅速增大到3.50,之后菌体生长进入稳定期。
|
| 图 2 菌株P2-A-8的生长曲线 |
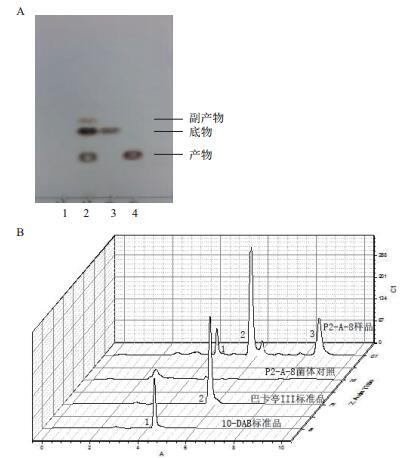
根据图 2,选择了生长达到稳定期(培养12 h,菌体OD600约为3.5)的菌体进行转化。菌体P2-A-8转化巴卡亭Ⅲ生成10-DAB的转化液的TLC和HPLC结果如图 3-A所示。菌株P2-A-8的转化液样品在TLC板上出现了3个明显的斑点,其中,按照距离点样位置由近到远的顺序观察到的斑点的比移值Rf分别和10-DAB、巴卡亭Ⅲ标准品的Rf值相同,分别为0.12和0.25。另外,还有一个副产物的斑点,其Rf值为0.24。对转化液样品进行HPLC分析(图 3-B),标准品巴卡亭Ⅲ和10-DAB分离峰的保留时间分别为5.708 min和4.281 min。菌株P2-A-8转化巴卡亭Ⅲ的转化液样品在保留时间4.281 min左右均出现了一个明显的分离峰,表明转化液中含有10-DAB。这一结果与TLC的结果相符。认为菌株P2-A-8具有将巴卡亭Ⅲ转化生成10-DAB的转化能力。且当菌体P2-A-8二级培养12 h(此时OD600为3.5左右)时直接加入溶解于甲醇的巴卡亭Ⅲ溶液,使其终浓度为0.006 mg/mL,37℃、200 r/min继续转化3 d,10-DAB的生成率为4.48%,底物的转化率为47.8%。
|
| 图 3 菌株P2-A-8转化巴卡亭Ⅲ的TLC(A)和HPLC(B)结果 |
经过之前单因素考察等预实验确定的各个因素的水平,采用Plackett-Burman设计从5个影响因素中筛选出具有显著影响的因素。利用Design Expert软件对实验进行设计,并按设计表进行实验,实验设计及结果见表 4。
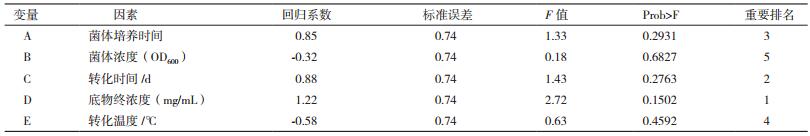
以10-DAB生成率为判断指标,根据Plackett-Burman实验设计及结果对10-DAB生成率影响因素进行效应分析,各因素效应分析见表 5,根据各因素的F值进行显著性排名,菌体培养时间、底物终浓度、转化时间这3个因素对10-DAB生成率率的影响较大,而这3个因素对10-DAB生成率的影响均为正效应。因而确定这3个因素作为下一步实验的关键因素。而菌体浓度和转化温度对巴卡亭Ⅲ转化效率的影响较小,根据其系数的符号,选择二者的低水平用于后续的转化实验,即菌体浓度为3.0,转化温度为32℃。
响应面拟合方程只有在考察的邻近区域里才能充分近似真实情况,所以应先逼近最大影响区域后再建立有效的拟合方程。根据Plackett-Burman实验,正效应明显的因素(菌体培养时间、底物终浓度、转化时间)取其较高值,最陡爬坡实验设计及结果(表 6)显示,随着菌体培养时间、转化时间和底物终浓度的变化,10-DAB的生成率呈现先上升后下降的趋势,当菌体培养时间为12 h、转化时间为5 d和底物终浓度为0.007 mg/mL时,所得到的转化液中的10-DAB生成率最高。因此,以这组条件为中心点,进行下一步优化实验。
根据菌体培养时间、转化时间和底物终浓度的变化点,采用Box-Behnken设计,设计响应面试验,各因素水平选择及其结果如表 7所示。
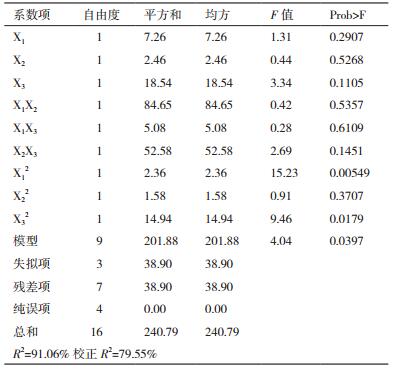
运用Design-Expert软件对表 7试验数据进行回归分析,得出回归方程:Y=15.40+0.95X1+0.56X2+1.52X3+0.77X1X2+0.63X1X3-1.93X2X3-4.48X12-1.10X22-3.53X23。方程中Y为10-DAB的生成率,X1为菌体培养时间,X2为转化时间,X3为底物终浓度(表 8)。方差分析显著性检验表明,R2=91.06%,方程回归性显著。预测模型的使用条件为菌体培养时间10-14 h、转化时间2-6 d、底物终浓度0.006-0.008 mg/mL,在此条件下可以用该模型对转化液中的10-DAB生成率进行预测。
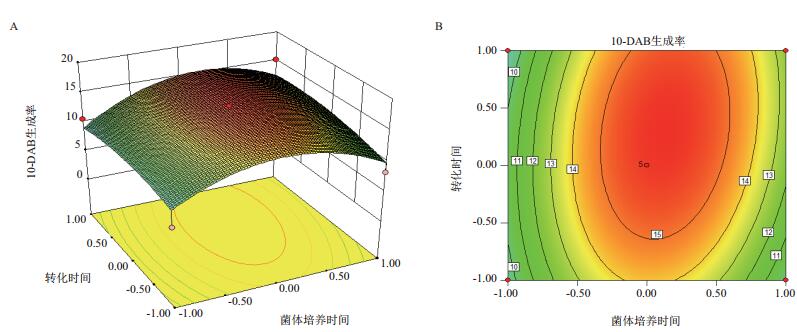
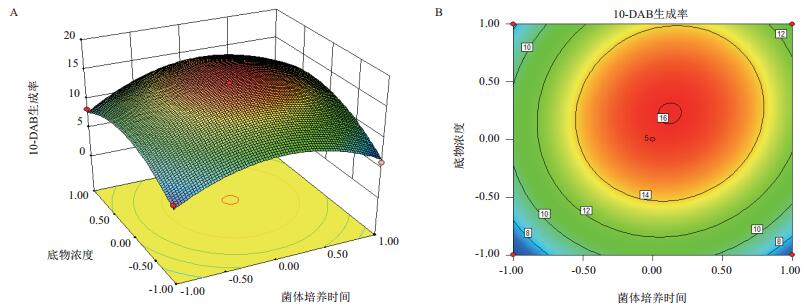
通过对回归模型进行响应面分析,可以得到3个响应面立体分析图(图 4、图 5、图 6),对回归方程求解,得模型极值点,即回归模型Y值最大估计值为25.2%,极值点分别对应A、C、D因素的值为12、4、0.007,即菌体培养时间12 h,转化时间4 d,底物终浓度0.007 mg/mL。
|
| 图 4 转化时间和菌体培养时间对10-DAB生成率交互影响的三维曲面图(A)和等高线图(B) |
|
| 图 5 底物终浓度和菌体培养时间对10-DAB生成率交互影响的三维曲面图(A)和等高线图(B) |

|
| 图 6 转化时间和底物终浓度对10-DAB生成率交互影响的三维曲面图(A)和等高线图(B) |
根据模型预测得到的最佳转化条件进行了3次实验,得到10-DAB平均生成率为24.5%,与预测值25.2%接近,说明该模型能较好的预测底物实际转化生成10-DAB的情况。
2.7 优化前后的工艺和10-DAB生成率的比较如表 10所示,转化工艺优化后菌株P2-A-8对巴卡亭Ⅲ转化液中10-DAB的生成率为24.5%。与优化前相比,提高了446.8%。
2010年,李松等[11]以甲苯破碎菌体得到的粗酶液进行巴卡亭Ⅲ的转化实验,结合TLC、HPLC、LC-MS等检测手段,从采集自昆明市区周围和大理云龙县等地的肉类市场、屠宰厂、饭馆、食堂、油坊等的土样中,筛选得到1株巴卡亭Ⅲ C10-脱乙酰酶产生菌,即能将巴卡亭Ⅲ转化生成10-DAB的菌株,通过形态特征、生理生化特征、16S rDNA序列分析等手段,将该菌株鉴定为成团泛菌(Pantoea agglomerans)。但研究者只是对该菌株转化巴卡亭Ⅲ生成10-DAB的能力进行了定性验证,并未对菌株生产10-DAB的能力进行定量分析。本研究以课题组前期以从泰达污水处理厂污泥中分离得到的成团泛菌P2-A-8为对象,利用Box-Behnken试验和方差分析相结合的方法对其转化巴卡亭Ⅲ生成10-DAB的工艺条件进行系统优化,明确了该菌株具有较高的生产10-DAB的能力。由表 10可知,转化时间和底物终浓度是影响菌株转化巴卡亭Ⅲ生成10-DAB的主要影响因素。而文献大多研究的是催化巴卡亭Ⅲ生成10-DAB的酶的最佳pH、酶的最适温度等,如研究者将藤黄类诺氏杆菌(Nocardioides luteus SC 13912)催化巴卡亭Ⅲ生成10-DAB的C10-脱乙酰基酶进行分离纯化,发现纯酶分子量大小为40 kD,最佳pH为8.0,在10%甲醇中酶活性较高,最适反应温度为37℃[9];以白色类诺卡氏菌(Nocardioides albus 4.1334)的粗酶液为对象,发现该菌株中酶的最适反应温度为37℃[16]。而本研究中成团泛菌P2-A-8转化巴卡亭Ⅲ生成10-DAB的相关酶的酶学性质还有待于深入研究。
通过实验证明,PB、最陡爬坡实验和Box-Behnken设计的结合是一种很好的实验设计组合,能在最短时间内,快速优化转化条件的关键参数,响应值较单因素实验或正交实验有明显的提高。
4 结论本实验以巴卡亭Ⅲ为底物,以10-DAB生成率为指标,运用响应面法分析中的因素筛选实验、最陡爬坡实验以及中心组合设计实验,对成团泛菌P2-A-8转化巴卡亭Ⅲ生成10-DAB的工艺进行统计学优化。确定得到的最优转化工艺:菌体分别经过一级和二级培养,离心收集二级培养12 h后的菌体,转接到新鲜的LB液体培养基中并使其初始OD600为3.0,此时,加入溶解于甲醇的巴卡亭Ⅲ溶液,使其终浓度为0.007 mg/mL,32℃,200 r/min下转化4 d,此时10-DAB的生成率达到24.5%,比优化前提高了446.8%。该研究成果对于多烯紫杉醇生物合成具有重要的应用价值。
| [1] | Liang JY, Shen YC, Long H. Synthesis and biological evaluation of deoxypaclitaxel analogues. The Journal of Organic Chemistry, 1999, 64 (6): 1814–1822. DOI:10.1021/jo981406l |
| [2] | Takayama H. Distribution of concanavalin A binding sites on normal human urinary bladder mucosa and bladder tumors by transmission and scanning electron microscopy and X-ray microanalysis. Urological Research, 1984, 12 (2): 135–141. |
| [3] | 杨陶, 李明, 陈建民. 红豆杉中紫杉烷类化合物制备10-去乙酰基巴卡亭Ⅲ. 复旦学报, 2004, 43(6): 1088–1097. |
| [4] | 朱宏莉. 微生物转化法合成天麻素等天然活性成分的研究[D]. 西安: 西北大学, 2007. |
| [5] | 吕斯琦, 马琳, 孙静, 等. 中药微生物转化的现状及前景. 药物评价研究, 2010, 33(6): 447–451. |
| [6] | 薛宝金, 蒋德伟, 刘姮, 等. 一种由白色类诺卡放线菌产生的新的巴卡亭Ⅲ C-10脱乙酰酶. 天然产物研究与开发, 2010, 8: 1–4. DOI:10.3969/j.issn.1001-6880.2010.01.001 |
| [7] | 占纪勋, 张元兴, 宁黎丽, 等. 铜绿假单孢菌AS1. 860对紫杉醇的微生物转化. 应用与环境生物学报, 2003, 9(4): 429–432. |
| [8] | Feng X, Sun LZ, Fu SB, et al. Microbial transformation of 7-epi-10-deacetylbaccatinⅢ to 10-deacetylbaccatinⅢ. Journal of Molecular Catalysis B:Enzymatic, 2010, 64 : 45–47. DOI:10.1016/j.molcatb.2010.01.030 |
| [9] | Hanson RL, Wasylyk JM, Nanduri VB, et al. Site-specific enzymatic hydrolysis of taxanes at C-10 and C-13. Biol Chem, 1994, 269 : 22145–22149. |
| [10] | 刘宝, 孙成逊, 江立, 等. 巴卡亭Ⅲ C-10位乙酰基水解酶产生菌的筛选和鉴定. 天然产物研究与开发, 2009, 21: 16–20. DOI:10.3969/j.issn.1001-6880.2009.01.005 |
| [11] | 李松, 张煜, 周继蓉, 等. 一株能水解巴卡亭Ⅲ C-10位乙酰基的成团泛菌的筛选和鉴定. 天然产物研究与开发, 2010, 22: 72–76. DOI:10.3969/j.issn.1001-6880.2010.01.018 |
| [12] | 李梅青, 张瑜, 代蕾莉, 等. Plackett-Burman试验设计及响应面法优化超声辅助提取明绿豆SOD工艺. 食品科学, 2015, 36(2): 69–74. DOI:10.7506/spkx1002-6630-201502013 |
| [13] | 李妍, 吴庆红, 陈义伦, 等. 一株纳豆芽孢杆菌的产酶条件优化. 食品科学, 2013, 34(3): 179–183. |
| [14] | 熊建华, 吴琴, 林丽萍, 等. 响应面分析法优化超声提取樟树籽油的工艺. 中国粮油学报, 2013, 28(3): 65–69. |
| [15] | 孙婉菊. 雄烯二酮耐底物突变株选育及转化条件的优化[D]. 南昌: 江西师范大学, 2014. |
| [16] | 王晓鹏. 巴卡亭Ⅲ C-10位酶法脱乙酰基的研究[D]. 昆明: 云南大学, 2008. |