群体感应(Quorum sensing,QS)是指细菌能自发产生、释放一些特定的信号分子,细菌通过感知其浓度变化来调节群体行为的现象[1]。微生物QS介导的过程常伴随有植物和动物宿主的参与,在生物进化过程中有些高等生物已进化出一定的机制来干扰细菌的QS。卤化呋喃酮,最早是在澳大利亚大型藻红色海藻Delisea pulchra发现的,它可以干扰多种革兰氏阴性菌QS调控的性状[2]。在已知的卤化呋喃酮化合物中有研究表明,溴化呋喃酮不但能降低铜绿假单胞菌(Pseudomonas aeruginosa)QS相关基因的表达,且能抑制铜绿假单胞菌QS系统介导的胞外毒力因子的表达。研究认为,溴化呋喃酮对QS抑制机理是与信号分子竞争结合受体,从而阻断QS系统通路[3, 4]。
鳗弧菌为有鞭毛的革兰氏阴性细菌,无荚膜,不形成芽孢,能运动,具有典型的弧菌属细菌特征。当水产养殖动物在不良的环境条件下,遭遇不利刺激或是受伤时会诱发疾病的产生。已报道的鳗弧菌毒力因子有pJM1铁离子转运系统、脂多糖、生物膜胞外酶等[5]。
QS系统不仅调控病原菌致病初期阶段的侵袭定殖以及毒力基因的表达,还调控其耐药性的产生,这就为人们提供了一条新的病原菌防控思路--从干扰群体感应系统入手预防和治疗微生物疾病[6]。我们前期研究发现鳗弧菌VA能够产生多种类型信号分子[7],但是溴化呋喃酮对鳗弧菌的QS影响尚无报道。因此,本研究以合成的溴化呋喃酮(图 1)为研究对象,探讨其对鳗弧菌VA QS系统相关基因及其毒力因子表达的影响,这将为弧菌病的预防和治理提供新的思路。

|
| 图 1 (Z)-5-(溴亚甲基)-2(5H)-呋喃酮 |
本研究中使用的菌株质粒如表 1所示。所有菌株均保存于30%甘油中,置于-20℃下冻藏。使用前,将储存的菌液按1:100的比例接种于AB液体培养基过夜活化。所有菌株的培养条件均为温度30℃,转速160 r/min。细菌的生长密度用OD600表示。蛋白酶培养基:LB琼脂基础培养基中添加2%脱脂奶粉,明胶酶培养基为LB培养基添加2%的明胶,卵磷脂酶培养基为LB基础培养基含1%生鸡蛋蛋黄。
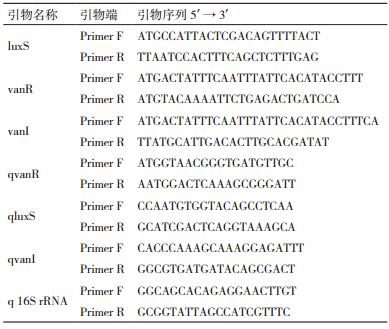
(Z)-5-(溴亚甲基)-2(5H)-呋喃酮购自Sigma公司(美国);引物由上海生工合成(表 2),使用时溶解于无水乙醇中。酶标仪Synergy 2(美国Bio-Tek公司),荧光定量PCR仪(FQD-96A杭州博日科技有限公司)。
参考文献[10],挑取鳗弧菌VA单菌落至AB液体培养基,过夜活化后,按1%的比例接种于新鲜AB培养基。在48孔透明酶标板中分别加入10 μL不同浓度的溴化呋喃酮溶液和990 μL稀释后的鳗弧菌液,使溴化呋喃酮的终浓度分别为30 mg/L、15 mg/L、7.5 mg/L、5 mg/L、2.5 mg/L、1 mg/L;空白对照组加入10 μL无水乙醇和990 μL稀释后的菌液,30℃培养24 h,检测其OD600值。
1.2.2 实时荧光定量PCR查阅基因库中鳗弧菌QS系统相关基因vanI/R,以鳗弧菌16S rRNA为管家基因,先以全序列引物扩增目的条带,再通过qRT-PCR测定相关基因在转录水平上相对表达量。鳗弧菌过夜活化,按1%比例稀释到新鲜的AB液体培养基中,添加不同浓度溴化呋喃酮使其最终浓度为1 mg/L、2.5 mg/L、5 mg/L,以加入相同体积的无水乙醇为对照组,置于28℃,160 r/min培养24 h。取菌液离心,上清过无菌0.22 μm滤器,用报告菌株哈维式弧菌JMH597测定无菌上清中AI-2信号分子活性,离心后的菌体根据TransZol法提取RNA,保存于RNA溶解液中,琼脂糖凝胶电泳检测RNA提取的完整性。
以提取的RNA为模板反转录得到cDNA,体系为20 μL:模板2 μL,随机引物(0.1 μg/μL)1 μL,2×TS Reaction Mix 10 μL,TransScrit RT/RI Enzyme Mix 1 μL,gDNA Remover 1 μL,RNase-free Water 5 μL。反应条件:25℃孵育10 min后42℃反转录15min,85℃加热5 s失活TransScrit RT/RI和gDNA Remover。qRT-PCR体系为20 μL:模板1 μL,前后引物各0.4 μL,2×TransStart TOP/Tip Green qPCR SuperMix 10 μL,ddH2O 8.2 μL,qPCR反应程序:94℃预变性3 min,94℃变性5 s,60℃退火延伸30 s,40个循环,在每个循环的退火延伸阶段收集荧光信号,以不加模板的体系为阴性对照。
1.2.3 溴化呋喃酮对鳗弧菌VA分泌胞外酶的影响挑取鳗弧菌VA单菌落接种到AB液体培养基,30℃过夜培养。按1%比例稀释到新鲜培养基中,加入不同浓度溴化呋喃酮,使最终浓度为0 mg/L(对照组)、1 mg/L、2.5 mg/L、5 mg/L,培养24 h,取菌液测定OD600,离心,获得上清液过无菌滤膜。蛋白酶培养基,明胶酶培养基和卵磷脂酶培养基平板在无菌风中吹干,打孔,加入60 μL上述无菌上清液,置于28℃培养24 h,测量透明圈大小。测得的数据用SPSS18.0进行统计学分析处理。抑制率(%)=(对照组透明圈直径-实验组透明圈直径)/对照组菌落直径*100%。
1.2.4 溴化呋喃酮对鳗弧菌VA运动细菌泳动培养基:0.3%琼脂,1%胰蛋白胨,1%NaCl;细菌群集运动培养基:0.5%琼脂,0.8%胰蛋白胨1% NaCl,0.5%葡萄糖。将每种培养基冷却至50℃左右,混入不用浓度溴化呋喃酮,终浓度为0 mg/L、1 mg/L、2.5 mg/L,倾倒平板,无菌风吹干,将活化好的菌液取1 μL悬滴到平板中央。待菌液吸收后放置28℃培养36 h。每个浓度做3个平行,游标卡值测量菌落迁移的直径。
1.2.5 溴化呋喃酮对鳗弧菌VA生物膜及鞭毛生长的影响鳗弧菌VA过夜活化后按1%的比例接种于新鲜培养基。取2 970 μL菌液加入直径为2 cm底部放置无菌盖玻片的6孔板,再加入30 μL溴化呋喃酮,使溴化呋喃酮的终浓度为2.5 mg/L,对照组以30 μL无水乙醇代替溴化呋喃酮,30℃下静置培养24 h。小心吸除培养基,蒸馏水轻轻漂洗3次,待晾干后取出盖玻片放置于洁净的载玻片上放在显微镜下观察生物膜形态。
挑取0 mg/L与2.5 mg/L细菌泳动培养基平板上的迁移菌落边缘涂布在载玻片的生理盐水中,用刘荣氏鞭毛染色液染色5 min,用蒸馏缓缓冲洗1 min,晾干在显微镜下放大1 000倍油镜观察,观察鳗弧菌鞭毛形态。
2 结果 2.1 溴化呋喃酮对鳗弧菌VA群体感应系统的影响溴化呋喃酮对鳗弧菌VA的最小抑菌浓度为15 mg/L,为了保证细菌致病因子表达量不同不是由细菌生长差异引起的,选取低于7.5 mg/L的浓度做后续实验。
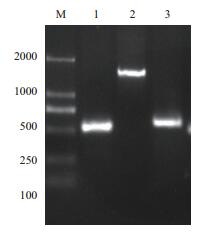
鳗弧菌VA vanR,vanI以及luxS基因扩增片段的电泳图谱如图 2所示,预期片段大小为1 308 bp、582 bp、519 bp,实测片段长度为1 282 bp、536 bp、487 bp。将得到的序列在NCBI中进行比对显示,鳗弧菌的vanR,vanI,luxS基因与已上传的鳗弧菌NB10对应的基因相似度都高达99%,说明该鳗弧菌中存在vanR、vanI和luxS,且扩增比较完整。
|
| 图 2 鳗弧菌VA luxS,vanR,vanI基因电泳图 1:luxS;2:vanR;3:vanI;M:DNA marker DL2000 |
前期研究发现,该鳗弧菌能够产生3种类型的QS信号分子,其中高丝氨酸内脂类信号分子和AI-2类型的信号分子是鳗弧菌产生的主要信号分子[7],鳗弧菌vanR/I系统存在与费氏弧菌的luxR/I系统相似的QS系统,该系统是以高丝氨酸内脂(OH-C6-HLs)介导的QS系统[11]。
鳗弧菌VA提取后的RNA电泳图(图 3-A),呈现3条典型条带28S、18S、5S,说明RNA提取完整,可以继续进行反转录和qPCR。经过溴化呋喃酮处理,鳗弧菌VA vanI/R介导的QS系统中分泌基因vanI的表达受到明显的抑制(图 3-B),随着溴化呋喃酮浓度升高抑制效果越显著,而vanR受体蛋白基因表达量呈现先升高后降低的趋势。这时可能因为低浓度溴化呋喃酮能够加速VanR蛋白的消耗,从而促进vanR基因的过度表达,当浓度提高至5 mg/l时,VanR基因表达出现下降趋势。鳗弧菌VA中luxS基因的表达量随着溴化呋喃酮浓度的升高而降低,AI-2与luxS基因表达量活性基本一致(图 3-C)。

|
| 图 3 溴化呋喃酮对鳗弧菌VA vanR/I和luxS/AI-2系统的影响 |
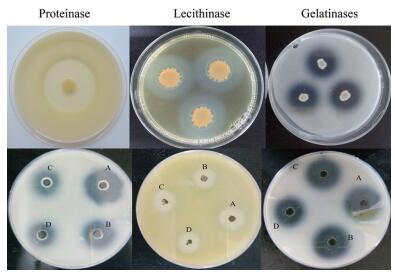
鳗弧菌VA能产生多种胞外酶,分泌较强的胞外酶有蛋白酶、卵磷脂酶和明胶酶,不产生脂肪酶和DNA酶。不同浓度溴化呋喃酮对鳗弧菌蛋白酶、卵磷脂酶和明胶酶活性的抑制效果如图 4。与对照组A相比,鳗弧菌VA分泌蛋白酶和明胶酶酶解圈直径随着溴化呋喃酮浓度的升高均逐渐变小,说明亚抑菌浓度溴化呋喃酮能够抑制鳗弧菌VA蛋白酶和明胶酶的分泌。根据抑制率公式计算,当溴化呋喃酮浓度为5 mg/L时,溴化呋喃酮对鳗弧菌VA蛋白酶的和明胶酶抑制率分别为36.48%和27.72%。测定培养后菌体密度(OD600),细菌密度没有显著性差异,说明溴化呋喃酮对鳗弧菌分泌蛋白酶和明胶酶的抑制效果不是抑菌作用引起的。溴化呋喃酮对鳗弧菌VA分泌卵磷脂酶没有显著抑制作用。
|
| 图 4 平板扩散法检测溴化呋喃酮对VA胞外酶的影响 A:0 mg/L(无水乙醇对照);B:1 mg/L;C:2.5 mg/L;D:5 mg/L |
溴化呋喃酮对鳗弧菌泳动和群集运动的抑制作用如图 5所示,细菌泳动和群集运动分别反应细菌在液体环境和固体环境中的运动能力,这种运动是以鞭毛为导向的运动行为,细菌的运动能力与致病菌的侵袭致病阶段具有重要的作用[12]。溴化呋喃酮对鳗弧菌泳动能力有抑制作用,而对鳗弧菌的群集运动无明显抑制作用,经测量鳗弧菌VA泳动半径分别为:(A)34.42±0.28 mm、(B)24.08±0.31 mm、(C)23.96±0.56 mm。2.5 mg/L的溴化呋喃酮对鳗弧菌的泳动直径抑制约30%。这可能是由于溴化呋喃酮抑制了鳗弧菌鞭毛的生长从而抑制了其泳动能力,因此,选取2.5 mg/L溴化呋喃酮浓度检测其对鳗弧菌鞭毛和生物膜形成的影响。

|
| 图 5 溴化呋喃酮对鳗弧菌运动的影响 A:0 mg/L;B:2.5 mg/L;C:5 mg/L |
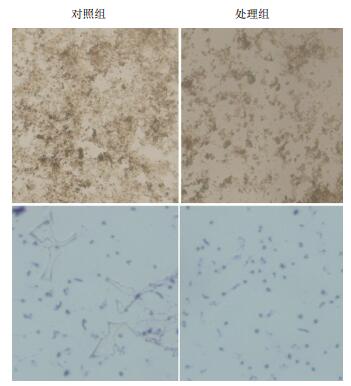
溴化呋喃酮对鳗弧菌生物膜形成的抑制作用如图 5与对照组(无水乙醇)相比,2.5 mg/L的溴化呋喃酮能有效抑制鳗弧菌生物膜的产生。经过溴化呋喃酮处理,生物膜由密集变稀疏,分散。生物膜的形成量逐渐减少,生物膜的形成逐渐受到抑制。
经鞭毛染色显微镜下观察鳗弧菌鞭毛形态,与对照组相比,溴化呋喃酮实验组中鳗弧菌中含有鞭毛的细菌数量明显减少,部分鞭毛变的短小甚至消失。对照组中,通过视野可以观察到细菌鞭毛细长弯曲。这说明溴化呋喃酮对鳗弧菌的鞭毛形成具有抑制作用。
|
| 图 6 溴化呋喃酮对鳗弧菌生物膜和鞭毛形成的抑制作用 |
溴化呋喃酮作为QS通路抑制剂可以与细菌分泌的信号分子竞争性结合受体,通过作用于细菌的QS系统影响细菌生物膜的形成,其对AHLs和AI-2均有抑制作用[13]。溴化呋喃酮对AI-2信号分子有抑制作用,可能是因为溴化呋喃酮能使LuxS酶失活或者抑制luxS基因的表达[14]。因此本研究通过荧光定量PCR,探讨溴化呋喃酮在体外环境下对于鳗弧菌QS系统相关基因影响,低于5 mg/L溴化呋喃酮浓度不影响鳗弧菌生长密度,但够显著抑制鳗弧菌QS分泌基因vanI和luxS的表达量,该两段基因分别调控AHLs和AI-2信号分子的合成。鳗弧菌VA群体感应系统感受基因vanR随着溴化呋喃酮浓度的升高,呈现先升高后降低的趋势,这与已报道的溴化呋喃酮能抑制铜绿假单胞菌(Pseudomonas aeruginosa)QS系统感受基因PlasB-gfp的表达研究结果不同,这可能因为铜绿假单胞菌与鳗弧菌群体感应系统的差异性大,鳗弧菌的群体感应系统复杂,目前发现鳗弧菌VA至少能分泌3种不同类型的信号分子。
溴化呋喃酮对鳗弧菌luxS/AI-2 QS系统也具有抑制作用,溴化呋喃酮可能通过抑制信号分子的活性影响鳗弧菌致病因子的表达。最近研究表明溴化呋喃酮可以通过抑制AI-2活性影响希瓦氏菌属(Shewanella.sp)致腐败相关特性[15]。这进一步说明溴化呋喃酮可以通过调控QS系统影响细菌的代谢特征。
鳗弧菌的致病过程包括粘附、侵袭、体内增殖及产生毒素等一系列过程,而这些过程又与细菌产生的各种致病因子有关[16]。鳗弧菌的致病因子主要包括侵染力和产毒力两方面。侵染力的产生主要来自于鞭毛蛋白对鱼粘液的化学趋向性驱动,产毒力主要包括铁摄取系统、外膜蛋白、胞外蛋白酶、脂多糖和溶血素等[17]。而研究表明鳗弧菌生物膜和胞外蛋白酶受其QS系统调控[11]。细菌形成生物膜可以降低外界环境的干扰,增强自身耐药性。本研究表明溴化呋喃酮在抑制QS系统相关基因表达的同时降低鳗弧菌生物膜的形成量和胞外蛋白酶活性,这进一步说明鳗弧菌的生物膜和胞外蛋白酶与其QS系统存在相关性。Vestby等[18]研究表明,溴化呋喃酮可明显降低多种肠道沙门氏菌生物膜的形成,这与本研究中溴化呋喃酮抑制鳗弧菌生物膜形成的研究结果基本一致。
细菌的运动主要依赖于鞭毛的主动性运动。溴化呋喃酮通过干扰鳗弧菌鞭毛形态减弱其运动能力。但在群集运动培养基中,溴化呋喃酮没有显著干扰效果。这是因为在不同环境中,鳗弧菌对溴化呋喃酮的敏感性不同。
溴化呋喃酮是目前研究较多的一类QS抑制剂的影响,期望在不干扰鳗弧菌生长的前提下,通过对细菌QS系统途径降低毒力因子的生成,当生物膜、鞭毛、胞外蛋白酶受到抑制后的致病菌更容易被宿主机体免疫系统清除,可以降低水产养殖疾病爆发几率,而对于溴化呋喃酮在水产养殖中的应用安全性还有待于深入研究。
4 结论本实验研究了QS抑制剂溴化呋喃酮在非抑菌浓度下对水产养殖致病菌鳗弧菌QS系统和毒力因子表达的影响。研究显示亚抑菌浓度溴化呋喃酮不但能显著抑制鳗弧菌QS相关基因表达,减少AI-2信号分子的分泌,且对鳗弧菌生物膜、胞外酶、运动能力有抑制效果。
| [1] | Miller MB, Bassler BL. Quorum sensing in bacteria. Annu Rev Microbiol, 2001, 55 (1): 165–199. DOI:10.1146/annurev.micro.55.1.165 |
| [2] | Ren D, Wood TK. (5Z)-4-bromo-5-(bromomethylene)-3-butyl-2(5H)-furanone reduces corrosion from Desulfotomaculum orientis. Environmental Microbiology, 2004, 6 (5): 535–540. DOI:10.1111/emi.2004.6.issue-5 |
| [3] | Hentzer M, Riedel K, Rasmussen TB, et al. Inhibition of quorum sen-sing in Pseudomonas aeruginosa biofilm bacteria by a halogenated furanone compound. Microbiology, 2002, 148 (Pt1): 87–102. |
| [4] | Hentzer M, Wu H, Andersen JB, et al. Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors. The EMBO Journal, 2003, 22 (15): 3803–3815. DOI:10.1093/emboj/cdg366 |
| [5] | 郝彬. 鳗弧菌Ⅵ型分泌系统 (T6SS) 的功能及调控研究[D]. 北京: 中国科学院研究生院, 2012. |
| [6] | 汪映. 副溶血弧菌群体感应与调控的初步研究[D]. 青岛: 中国海洋大学, 2014. |
| [7] | 潘玉荣, 张彩丽, 朱素芹, 孙秀娇, 曾名湧. 一株凡纳滨对虾源鳗弧菌群体感应信号分子的检测. 生物技术通报, 2016(3): 142–147. |
| [8] | Mok KC, Wingreen NS, Bassler BL. Vibrio harveyi quorum sensing:a coincidence detector for two autoinducers controls gene expression. The EMBO Journal, 2003, 22 (4): 870–881. DOI:10.1093/emboj/cdg085 |
| [9] | Bassler BL, Greenberg EP, Stevens AM. Cross-species induction of luminescence in the quorum-sensing bacterium Vibrio harveyi. J Bacteriol, 1997, 179 (12): 4043–4045. DOI:10.1128/jb.179.12.4043-4045.1997 |
| [10] | 张利平, 王爽, 周向葛, 徐屹. 群体感应抑制剂溴化呋喃酮对牙龈卟啉单胞菌生物膜形成影响的研究. 华西口腔医学杂志, 2011, 05: 469–472. DOI:10.3969/j.issn.1000-1182.2011.05.005 |
| [11] | Kastbjerg VG, Nielsen K, Dalsgaard I, et al. Profiling acylated homoserine lactones in Yersinia ruckeri and influence of exogenous acyl homoserine lactones and known quorum-sensing inhibitors on protease production. Journal of Applied Microbiology, 2007, 102 (2): 363–374. |
| [12] | Gutierrezbarranquero JA, Reen F, Mccarthy R, et al. Deciphering the role of coumarin as a novel quorum sensing inhibitor suppressing virulence phenotypes in bacterial pathogens. Applied Microbiology and Biotechnology, 2015, 99 (6): 2923–2923. DOI:10.1007/s00253-015-6465-9 |
| [13] | Defoirdt T, Crab R, Wood TK, et al. Quorum sensing-disrupting brominated furanones protect the gnotobiotic brine shrimp artemia franciscana from pathogenic Vibrio harveyi, Vibrio campbellii, and Vibrio parahaemolyticus Isolates. Applied and Environmental Microbiology, 2006, 72 (9): 6419–6423. DOI:10.1128/AEM.00753-06 |
| [14] | Manefield M, Rasmussen TB, Henzter M, et al. Halogenated furanones inhibit quorum sensing through accelerated LuxR turnover. Microbiology, 2002, 148 (4): 1119–1127. DOI:10.1099/00221287-148-4-1119 |
| [15] | Zhu S, Wu H, Zeng M, et al. Regulation of spoilage-related Activi-ties of Shewanella putrefaciens and Shewanella baltica by an Autoi-nducer-2 Analogue, (Z)-5-(Bromomethylene) furan-2(5H)-One. Journal of Food Processing and Preservation, 2015, 39 (6): 719–728. DOI:10.1111/jfpp.12281 |
| [16] | Frans I, Michiels CW, Bossier P, et al. Vibrio anguillarum as a fish pathogen:virulence factors, diagnosis and prevention. Journal of Fish Diseases, 2011, 34 (9): 643–661. DOI:10.1111/jfd.2011.34.issue-9 |
| [17] | Naka H, Dias GM, Thompson CC, et al. Complete genome sequence of the marine fish pathogen Vibrio anguillarum harboring the pJM1 virulence plasmid and genomic comparison with other virulent strains of V. anguillarum and V. ordalii. Infection and Immunit, 2011, 79 (7): 2889–2900. DOI:10.1128/IAI.05138-11 |
| [18] | Vestby LK, Lonnstensrud J, Moretro T, et al. A synthetic furanone potentiates the effect of disinfectants on Salmonella in biofilm. Journal of Applied Microbiology, 2010, 108 (3): 771–778. DOI:10.1111/jam.2010.108.issue-3 |