2. 中国农业科学院植物保护研究所,北京 100193
2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193
表面活性素(surfactin)是一种由芽胞杆菌产生的环脂肽类生物表面活性剂,由亲水的肽链和亲油的脂肪烃链两部分组成。作为表面活性素,surfactin在环境保护、食品、化妆品、微生物采油及植物病害防治等领域展现出重要的应用潜力。表面活性素具有很好的抗菌功能[1-4],其作用机理不同于抗生素,主要通过作用于微生物的脂膜抑制微生物的生长,不易使微生物产生抗药性,被认为是可替代抗生素的新型抗菌剂,因而在医药和农业领域具有更大的应用前景。但目前surfactin的生产成本较高、产量较低而阻碍了其广泛应用。通过发酵配方及发酵条件的优化,降低surfactin的生产成本,成为提高其产率的重要手段。
发酵培养过程中的通气量、pH、温度等培养条件影响surfactin的产量[5, 6]。氧气传递和营养物的传质过程明显影响surfactin产量[7],而温度不仅影响脂肽类抗生素的产量,还影响其成分组成。Ohno等[8]研究发现,25℃培养有利于枯草芽胞杆菌RB14产生伊枯草菌素iturin,而30℃培养时surfactin的产量最高。培养基中的营养物质对surfactin的产生影响更大。Yeh等[9]研究表明葡萄糖是影响ATCC 21332 surfactin产生的重要因素;孙立军等[10]研究表明,枯草芽胞杆菌ES-2的最佳碳源为葡萄糖,最佳氮源为谷氨酸钠;贡国鸿等[11]研究发现碳源为可溶性淀粉,氮源为硝酸钠时最利于E8菌株产surfactin;刘桂萍等[12]发现以豆油和废油为碳源、尿素为氮源时,菌株LH3的surfactin产量最高,以葡萄糖为碳源时最差;Davis等[13]研究了培养基中碳氮源对B. subtilis ATCC 21332产surfactin的影响,结果表明以硝酸铵为氮源时,surfactin的产量最高;另外Mg2+、Mn2+和Fe2+等无机盐离子对surfactin的产生也至关重要[14, 15]。上述结果表明,不同菌株对营养物质的需求不同,适合的培养条件也有所不同[16, 17]。
Surfactin是由多组分组成的同系物,虽然有研究报道有机酸[18]、氨基酸等影响其组分[16],但有关工业化发酵生产碳氮源对surfactin组分的研究较少。芽胞杆菌B006是一株高效生防芽胞杆菌,对黄瓜枯萎病、辣椒疫霉病等病害具有较好的防治效果[19, 20]。该菌主要通过营养竞争和产生脂肽类抗生素拮抗病原菌的侵染和繁殖,其中表面活性素surfactin是其产生的重要的脂肽类抗生素。前期研究表明,菌株B006在肉汤培养液中和植物根际可产生surfactin[19],在以琥珀酸作为单一有机酸的根分泌物培养液中产生的surfactin同系物的组分比例发生改变,10 μmol/L时即可促进芽孢杆菌B168生物膜的产生,而来源于肉汤培养液中的surfactin需要50 μmol/L才能达到同等效果[21],因此获得长链组分的surfactin更具有实际意义。本研究通过碳源、氮源和无机盐等营养物质的单因素和正交实验,获得了适合的培养基和培养条件,不仅提高了B006菌株发酵液中surfactin产量,而且surfactin同系物中C16、C17组分含量也明显升高,该结果为芽胞杆菌产生表面活性素的代谢调控研究和surfactin的工业化生产奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试菌种枯草芽胞杆菌B. subtilis B006,中国农业科学院植物保护研究所分离、保存。
1.1.2 培养基斜面培养基(NA):葡萄糖10 g、蛋白胨10 g、酵母浸粉1 g、牛肉浸膏3 g、琼脂粉20 g、水1 000 mL,pH7.0。种子液培养基:葡萄糖10 g、蛋白胨10 g、酵母浸膏3 g、牛肉浸膏3 g、水1 000 mL,pH7.0。
1.2 方法 1.2.1 发酵液中表面活性素含量的测定方法采用排油圈法[22]测定。取发酵液10 mL,10 000 r/min离心10 min,保留上清液。另取一直径9 cm的培养皿,加30 mL蒸馏水,在水面上滴入4 mL经苏丹Ⅲ染色的液体石蜡,在油膜中央滴加20 μL发酵液,观察是否有排油圈产生,游标卡尺测量排油圈的直径。重复测定3次,取平均值。
1.2.2 发酵培养条件对B006菌株产生表面活性素的影响 1.2.2.1 接种量对B006产表面活性素的影响将B006菌株在NA培养基上活化24 h,挑取一环菌体接种到装有100 mL种子液的500 mL三角瓶中,30℃,180 r/min振荡培养16 h;调整菌液浓度为108 CFU/mL,作为下一步发酵用种子液。分别按照1%、2%、5%和10%的接种量将种子液转接到发酵液中(葡萄糖10 g、蛋白胨10 g、酵母浸膏3 g、牛肉浸膏3 g、水1 L),30℃,180 r/min振荡培养72 h,测定发酵液的排油圈直径。
1.2.2.2 培养时间对B006产表面活性素的影响接种方法和培养条件同1.2.2.1。在发酵72 h内,从接种开始,每隔8 h取样一次,测定不同生长时间时,发酵液的排油圈直径。每个时间点设3个重复,取平均值。
1.2.2.3 装液量对B006产表面活性素的影响在上述实验基础上,测定装液量(供氧量)对B006菌株产生表面活性素的影响。在250 mL三角瓶中分别加入60、80、100、120和140 mL的培养液,每处理设3个重复,30℃、180 r/min震荡培养64 h,测定发酵液的排油圈直径,取平均值。
1.2.2.4 初始pH值对B006产表面活性素的影响在上述实验基础上,使用1 mol/L HCl和1 mol/L NaOH溶液调节发酵液的pH值到6.0、6.5、7.0、7.5和8.0,测定不同pH值对B006菌株产生表面活性素的影响,每处理设3个重复。培养条件和表面活性素的测定方法同1.2.2.3。
1.2.3 营养物质对B006菌株产表面活性素的影响通过单因素和正交实验,测定摇瓶培养条件下,不同营养物质对B006菌株产生表面活性素的影响。接种量为10%(V/V),装液量为100 mL/500 mL,30℃、180 r/min振荡培养64 h。
1.2.3.1 有机氮源对B006产表面活性素的影响以5 g/L葡萄糖和10 g/L玉米淀粉为固定碳源,分别测定10 g/L蛋白胨、牛肉膏、豆饼粉、酵母浸粉、玉米浆干粉、棉籽饼粉、花生饼粉等有机氮源对B006产生表面活性素的影响。
1.2.3.2 碳源对B006产表面活性素的影响以10 g/L牛肉膏为固定氮源,分别测定15 g/L葡萄糖、蔗糖、玉米淀粉、玉米粉、糖蜜等碳源对B006产生表面活性素的影响。
1.2.3.3 无机氮源对B006产表面活性素的影响以15 g/L玉米粉为固定碳源,以10 g/L牛肉膏为固定氮源,分别测定5 g/L硝酸铵、氯化铵、硫酸铵和硝酸钠等无机氮源对菌株B006产生表面活性素的影响。
1.2.3.4 无机盐对B006产表面活性素的影响在上述研究基础上,分别添加3 g/L氯化钠、3 g/L磷酸二氢钾、3 g/L碳酸钙、0.2 g/L硫酸镁、0.2 g/L硫酸锰等无机盐[23-25],测定不同无机盐对B006产生表面活性素的影响。
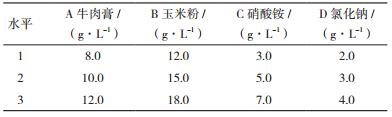
1.2.3.5 正交优化实验根据1.2.3.1-1.2.3.4的实验结果,选择玉米粉为碳源,牛肉膏和硝酸铵为氮源,氯化钠为无机盐设计四因素三水平的正交实验,如表 1。测定不同因素对B006产生表面活性素的影响。
将B006菌株接种到装有80 mL筛选培养基的500 mL三角瓶中,每处理3次重复。30℃、180 r/min振荡培养72 h,离心获得发酵液,以优化前的培养基为对照。用HCl调节pH到2.0后放入4℃冰箱,酸沉淀。再次离心收集沉淀物。冷冻干燥得到粗提物。
1.2.4.2 HPLC-ESI-MS分析方法将粗提物干物质用色谱级甲醇溶解,过0.22 µm滤膜,用Waters液质联用仪进行检测,MassLynx软件分析检测结果。检测条件参照杨琦瑶等[18]的方法,流动相中三氟乙酸的含量为0.01%,检测波长为214 nm。
1.2.4.3 数据处理和分析以1 mg/mL的表面活性素surfactin标准品为参照,根据出峰时间和MS图谱数据,采用MasslynxV4.1软件对发酵液中surfactin各组分的峰面积进行积分,计算B006菌株产生的surfactin各组分含量及总量,并进行统计分析。
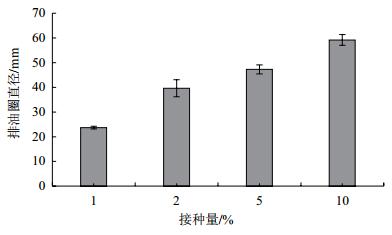
2 结果 2.1 发酵培养条件对B006菌株产生表面活性素的影响 2.1.1 接种量对B006产表面活性素的影响接种量的大小明显影响B006发酵终点表面活性素的含量(图 1)。接种量为1%时,发酵液的排油圈直径较小,仅为23.70±0.57 mm。随着接种量的增加,排油圈直径逐步增大。当接种量增加到10%时,排油圈直径达到59.20±2.17 mm。
|
| 图 1 接种量对B006发酵液中表面活性素含量的影响 |
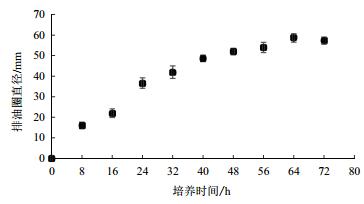
随着发酵时间的延长,发酵液的排油圈直径逐渐增大(图 2),发酵培养至64 h时,排油圈直径达最大,为58.66±2.08 mm。此后,随着发酵时间的延长,排油圈直径不再增大。因此最佳发酵时间为64 h。
|
| 图 2 培养时间对菌株B006产表面活性素的影响 |
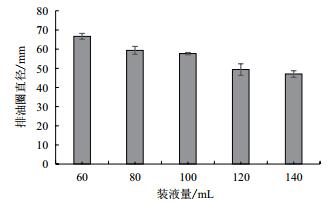
摇瓶装量对菌株B006产表面活性素有显著的影响。结果(图 3)表明,减少装液量有利于发酵液中表面活性素的产生。当装液量为60 mL/500 mL时,发酵液排油圈直径最大,为66.67±1.53 mm。随着装液量增多,排油圈直径变小,当装液量增大到140 mL/500 mL时,发酵液排油圈直径为47.00±1.73 mm。
|
| 图 3 摇瓶装液量对菌株B006产表面活性素的影响 |
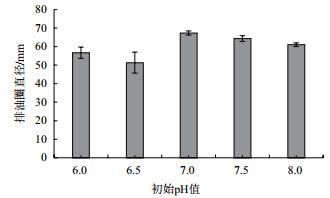
培养基初始pH明显影响B006菌株的表面活性素产量。结果(图 4)表明,中性和微碱性条件有利于菌株B006表面活性剂的产生,适宜的初始pH值为7.0-7.5。pH为7.0时其发酵液的排油圈直径最大,为67.33±1.15 mm。
|
| 图 4 初始pH值对菌株B006产表面活性素的影响 |
不同有机氮源对菌株B006产生表面活性素有明显的影响。添加有机氮源牛肉膏、豆饼粉、酵母浸粉和花生饼粉可以明显促进表面活性素的产生,添加牛肉膏时表面活性素产量最高,排油圈直径为60.67±3.06 mm(图 5)。

|
| 图 5 有机氮源对B006产生表面活性素的影响 |
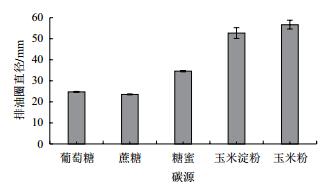
不同碳源对菌株B006产表面活性素有显著的影响(图 6),以玉米淀粉和玉米粉为有机碳源,有利于菌株B006产生表面活性素;其中玉米粉作为碳源时,排油圈直径最大,为56.67±2.08 mm,表明以玉米粉为碳源时产生的表面活性素的量最高。
|
| 图 6 碳源对B006产生表面活性素的影响 |
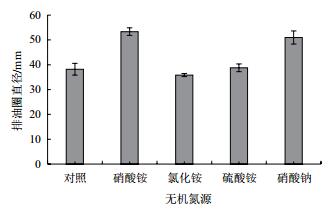
从不同无机氮源对菌株B006产表面活性素的影响结果(图 7)可以看出,添加5 g/L的无机氮源对B006产表面活性素有显著影响,添加硝酸铵和硝酸钠可明显促进表面活性素的产生。
|
| 图 7 无机氮源对B006产表面活性素的影响 |
添加无机盐对菌株B006产表面活性素有明显影响(图 8)。添加3 g/L氯化钠明显促进表面活性素的产生,排油圈直径最大,为62.00±0.56 mm;而添加硫酸镁、碳酸钙、磷酸二氢钾和硫酸锰明显抑制了表面活性素的产生,其中添加硫酸锰时的抑制作用最明显。
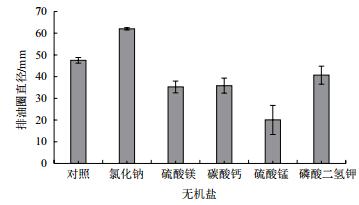
|
| 图 8 无机盐对B006产表面活性素的影响 |
碳、氮源及无机盐正交优化试验结果如表 2和表 3。从表 3的方差分析结果可以看出,牛肉膏、玉米粉、硝酸铵和氯化钠这4个因素对芽胞杆菌B006产表面活性素的影响都极为显著(P < 0.05),但其影响程度的大小有较大的差异。这四个因素对芽胞杆菌B006产表面活性素的影响作用的大小依次为:C>A>D>B,即硝酸铵>牛肉膏>氯化钠>玉米粉。
根据方差分析及统计分析考察A、B、C和D四因素在3个水平上的变化,得到芽胞杆菌B006产表面活性素的最佳培养基为:A2B2C1D2,即牛肉膏10 g/L、玉米粉15 g/L、硝酸铵3 g/L和氯化钠3 g/L。
由于优选的最佳培养基组成未包括在正交设计表的9次试验中,故对其进行验证。按A2B2C1D2配方进行发酵实验,排油圈直径为77.00±1.73 mm。可见,该优化培养基产表面活性素量最高,可作为芽胞杆菌B006产表面活性素的最佳培养基。
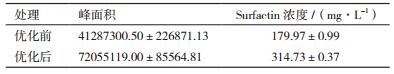
2.3 培养基优化前后发酵液中表面活性素的含量和组分采用HPLC-MS方法对培养基配方优化前后发酵液中表面活性素surfactin的含量进行了测定,优化前后surfactin的相对出峰时间分别为14.23-16.43 min和14.87-18.03 min(图 9),对其峰面积进行积分,并与标准品的峰面积进行比较,可知培养基组分优化后发酵液中surfactin的平均含量约为314.73 mg/L,比优化前产量提高了74.88%(表 4);对质谱图中m/z分别为994、1008、1022、1036、1050和1064的surfactin各单一组分(C12-C17)所对应的HPLC色谱图中的峰面积进行积分,计算各组分相对含量,用excel对数据进行整理和作图。结果(图 10)表明,surfactin同系物的组分构成发生了变化,C14和C15组分减少,而C16和C17含量增加,C16和C17含量为优化前的1.64倍和8.34倍。
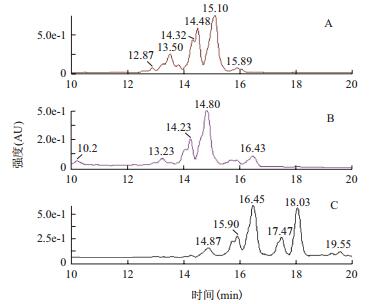
|
| 图 9 Surfactin标准品(A)和优化前后(B、C)发酵液提取物的HPLC图谱 |
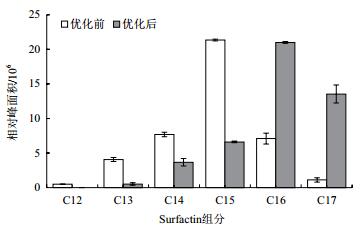
|
| 图 10 培养基组分优化前后发酵液中surfactin各组分含量 |
培养条件、营养物质供给对芽胞杆菌表面活性素的产生具有明显影响,但不同学者对不同菌株的研究结果不同[11-13]。获得适合生防芽胞杆菌B006高产表面活性素的发酵条件和营养物质配比对提高其表面活性素产量具有重要实际意义。表面活性素surfactin由多种同系物组成,组分中碳链越长,与细胞脂双层膜的结合能力越强,抗菌作用也更强[26]。而且surfactin C16组分比例升高后,在10 μmol/L时对芽胞杆菌生物膜形成的促进作用与50 μmol/L正常组分比例的surfactin的促进作用相当[21]。通过优化培养基,获得长链surfactin组分具有更重要的意义。
本研究通过碳源、氮源和无机盐等营养物质的单因素和正交筛选实验,获得适合芽胞杆菌B006摇瓶发酵产生表面活性素的培养基和培养条件。HPLC-MS分析发现,培养基优化后,不仅surfactin的产量比优化前提高了74.88%,而且surfactin C16和C17组分比例明显提高。Surfactin含量和长链组分含量的增加不仅增强了其表面活性张力,使排油圈直径增大,而且可能有利于促进芽胞杆菌生物膜的形成和芽胞杆菌的定殖[21, 26],对提高芽胞杆菌防病效果具有重要意义。关于碳源、氮源对surfactin组分含量的影响,前人研究报道,琥珀酸可提高surfactin C12、C14和C16组分的比例[18, 21],而氨基酸对surfactin的组分构成也有一定影响[16, 27]。本研究发现添加玉米粉并提高牛肉膏的含量利于surfactin C16和C17组分的产生,推测与玉米粉分解后糖类以及牛肉膏分解后氨基酸含量有关,相关影响机理有待于进一步研究。
关于无机氮源对芽胞杆菌表面活性素产生的影响,本研究所得实验结果与前人研究结果基本一致,都发现硝酸钠[11]和硝酸铵[13]为氮源时,芽胞杆菌产生表面活性素的量较高。硝酸铵相对于其他无机氮源更有利于脂肽类表面活性素的产生的原因,可能是由于培养环境缺氧时,菌体利用硝酸盐,通过其他途径合成surfactin[13],有效延长了菌体合成脂肽类生物表面活性素的时间,从而增加了表面活性素的产量。
Deshpande等[29]发现Mn2+是生物体内同化无机氮最关键的一种酶--谷氨酰胺合成酶最主要的辅因子,能够与Mg2+协同作用,提高Bacillus subtilis胞内谷氨酰胺合成酶的活性,促进微生物对氮源的利用,进而影响脂肽的产量。但不同学者关于无机盐对芽胞杆菌表面活性素产生的影响的研究结果不尽相同。朱玲燕等[16]在研究培养基组分对枯草芽胞杆菌BS-37产表面活性素的影响时发现添加Mg2+能促进表面活性素总产量,而添加Ca2+和Mn2+会抑制表面活性素surfactin的产生;但也有其他研究报道添加硫酸锰能明显促进表面活性素的产生[14, 28]。本研究中NaCl明显促进表面活性素的产生,碳酸钙和硫酸锰抑制表面活性素的产生,与朱玲燕研究结果一致,而与Wei等[14]和Huang等[28]研究结果相反;关于硫酸镁的研究结果与朱玲燕研究结果相反。研究结果的差异可能与菌株本身特性以及培养基组分中无机氮源的种类和含量有关,有关硫酸镁和硫酸锰对不同菌株产生表面活性素的影响差异机制有待进一步研究。
本研究获得了适合芽胞杆菌B006菌株在摇瓶发酵产生表面活性素的培养基和培养条件,并发现玉米粉和牛肉膏可促进surfactin C16和C17组分的产生,为提高菌株B006表面活性素的产量以及开展芽胞杆菌B006产生表面活性素的代谢调控研究提供了基础,对指导工业化生产具有更高抗菌活性的surfactin具有重要实际意义。
4 结论表面活性素surfactin是由芽胞杆菌产生的重要的环脂肽类生物表面活性剂,牛肉膏、玉米粉、硝酸铵、氯化钠以及装液量明显促进芽胞杆菌B006表面活性素surfactin的产生,提高surfactin产量和长链组分C16和C17的含量。
| [1] | Das P, Mukherjee S, Sen R. Antimicrobial potential of a lipopeptide biosurfactant derived from a marine Bacillus circulans. Journal of Applied Microbiology, 2008, 104 (6): 1675–1684. DOI:10.1111/j.1365-2672.2007.03701.x |
| [2] | Lee JH, Nam SH, Seo WT, et al. The production of surfactin during the fermentation of eheonggukjang by potential probiotic Bacillus subtilis CSYl91 and the resultant growth suppression of MCF-7 human breast cancer cells. Food Chemistry, 2012, 131 (4): 1347–1354. DOI:10.1016/j.foodchem.2011.09.133 |
| [3] | Ongena M, Jourdan E, Adam A, et al. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants. Environmental Microbiology, 2007, 9 (4): 1084–1090. DOI:10.1111/emi.2007.9.issue-4 |
| [4] | Deravel J, Lemiere S, Coutte F, et al. Mycosubtilin and surfactin are efficient, low ecotoxicity molecules for the biocontrol of lettuce downy mildew. Applied Microbiology and Biotechnology, 2014, 98 (14): 6255–6264. DOI:10.1007/s00253-014-5663-1 |
| [5] | Yeh MS, Wei YH, Chang JS. Bioreactor design for enhanced carrier-assisted surfactin production with Bacillus subtilis. Process Biochem, 2006, 41 : 1799–1805. DOI:10.1016/j.procbio.2006.03.027 |
| [6] | Sameh F, Krasimir D, Frederique G, et al. Impact of energy supply and oxygen transfer on selective lipopeptide production by Bacillus subtilis BBG21. Bioresource Technol, 2012, 126 : 1–6. DOI:10.1016/j.biortech.2012.09.019 |
| [7] | 罗星荣, 陈小龙. Surfactin发酵生产及应用研究进展. 发酵科技通讯, 2014, 43(8): 14–18. |
| [8] | Ohno A, Aao T, Shoda M. Effect of temperature on production of lipopeptide antibiotics, iturin A and surfactin by a dual producer, Bacillus subtilis RB14, in solid-state fermentation. Journal of Fermentation and Bioengineering, 1995, 80 : 517–519. DOI:10.1016/0922-338X(96)80930-5 |
| [9] | Yeh MS, Wei YH, Chang JS. Enhanced production of surfactin from Bacillus subtilis by addition of solid carriers. Biotechnology Progress, 2005, 21 (4): 1329–1334. |
| [10] | 孙力军, 陆兆新, 别小妹, 等. 培养基对解淀粉芽孢杆菌ES-2菌株产抗菌脂肽的影响. 中国农业科学, 2008, 41(10): 3389–3398. DOI:10.3864/j.issn.0578-1752.2008.10.063 |
| [11] | 贡国鸿, 刘清梅, 袁成凌, 等. 生物表面活性剂surfactin菌株选育及发酵调控. 中国工程院化工冶金与材料工程学部第六届学术会议[A]. 2007, 311-319. |
| [12] | 刘桂萍, 刘巍巍, 刘文杰, 等. 生物表面活性剂产生菌的筛选及培养条件优化. 环境保护科学, 2011, 37(6): 12–15. |
| [13] | Davis DA, Lynch HC, Varley J. The production of surfactin in batch culture by Bacillus subtilis ATCC 21332 is strongly influenced by the conditions of nitrogen metabolism. Enzyme and Microbial Technology, 1999, 25 (3). |
| [14] | Wei YH, Chu IM. Mn2+ improves surfactin production by Bacillus subtilis. Biotechnology Letters, 2002, 24 (6): 479–482. DOI:10.1023/A:1014534021276 |
| [15] | Wei YH, Wang LF, Chang J S. Optimizing iron supplement strategies for enhanced surfactin production with Bacillus subtilis. Biotechnol Progess, 2004, 20 (3): 979–983. DOI:10.1021/bp030051a |
| [16] | 朱玲燕, 刘强, 刘洋, 等. 培养基组分对枯草芽胞杆菌产表面活性素的影响. 生物加工过程, 2015, 13(5): 8–13. |
| [17] | 张卉, 郝国良, 徐俊斌. 生物表面活性剂产生菌的筛选及培养条件优化. 沈阳师范大学学报:自然科学版, 2011, 29(2): 293–296. |
| [18] | Nihorimbere V, Cawoy H, Seyer A, et al. Impact of rhizosphere factors on cyclic lipopeptide signature from the plant beneficial strain Bacillus amyloliquefaciens S499. FEMS Microbiology Ecology, 2012, 79 : 176–191. DOI:10.1111/j.1574-6941.2011.01208.x |
| [19] | 杨琦瑶, 索雅丽, 郭荣君, 等. 枯草芽孢杆菌B006对黄瓜枯萎病菌和辣椒疫霉病菌的抑制作用及其抗菌组分分析. 中国生物防治学报, 2012, 02: 235–242. DOI:10.3969/j.issn.2095-039X.2012.02.014 |
| [20] | 贾珂, 李世东, 刘桂君, 等. 枯草芽孢杆菌B006产surfactin突变株特性及其对黄瓜枯萎病的抑制能力. 中国生物防治学报, 2013, 04: 538–546. |
| [21] | 高毓晗. 产surfactin枯草芽胞杆菌B168重组菌株构建及其对黄瓜枯萎病的控制作用[D]. 北京: 中国农业科学院研究生院, 2015. |
| [22] | 张凡, 佘跃惠. 排油圈法对生物表面活性剂的定性与定量. 化学工程师, 2005, 19(1): 14–15. |
| [23] | 洪鹏, 安国栋, 胡美英, 等. 解淀粉芽孢杆菌HF-01发酵条件优化. 中国生物防治学报, 2013, 04: 569–578. |
| [24] | 张丽霞. 枯草芽孢杆菌B908发酵工艺优化研究[D]. 呼和浩特: 内蒙古农业大学, 2006. |
| [25] | 尹望, 杜志琳. 猪源枯草芽孢杆菌HEW-B113的鉴定及发酵工艺优化. 饲料研究, 2014, 23: 20–24. |
| [26] | Henry G, Deleu M, Jourdan E, et al. The bacterial lipopeptide surfactin targets the lipid fraction of the plant plasma membrane to trigger immune-related defence responses. Cellular Microbiology, 2011, 13 (11): 1824–1837. DOI:10.1111/cmi.2011.13.issue-11 |
| [27] | Liu JF, Yang J, Yang SZ, et al. Effects of different amino acids in culture media on surfactin variants produced by Bacillus subtilis TD7. Applied Biochemistry and Biotechnology, 2012, 166 (8): 2091–2100. DOI:10.1007/s12010-012-9636-5 |
| [28] | Huang XF, Liu JN, Wang YH, et al. The positive effects of Mn2+ on nitrogen use and surfactin production by Bacillus subtilis ATCC 21332. Biotechnology and Biotechnological Equipment, 2015, 29 (2): 381–389. DOI:10.1080/13102818.2015.1006905 |
| [29] | Deshpande KL, Katze J, Kane J F. Effect of glutamine on enzymes of nitrogen metabolism in Bacillus subtilis. Journal of Bacteriology, 1981, 145 (2): 768–774. |