2. 固体废物处理与资源化教育部重点实验室,绵阳621010
2. Key Laboratory of Waste Solid Treatment and Resource Recycle of Ministry of Education, Mianyang 621010
长期以来,人们将微生物按能量代谢的途径分为两大类:光能营养微生物和化能营养微生物,并且认为非光合型的微生物只能利用无机物、无机成因或者生物成因的有机物来获得能量,不能直接利用太阳光能。但是随着矿物和微生物交互作用研究的发展,发现了地表广泛存在的半导体矿物吸收太阳光能后分离的光电子-空穴对,亦可对微生物产生作用。例如,微生物可通过细胞外膜上的一些分子(如血红素)与铁锰矿物晶体结构中的变价元素Fe、Mn进行价电子交换以此获取能量[1-4];半导体矿物光催化作用可以显著降低红壤微生物群落多样性,改变红壤微生物群落结构[5]。天然闪锌矿产生的光电子促进嗜酸性氧化亚铁硫杆菌生长[6];一定范围内的光电子能量可促进粪产碱杆菌生长[7];半导体矿物CdS光催化产生的光电子能够作用于从异养产碱杆菌菌体中提取的NAD辅酶,使其还原为NADH[8]。这意味着半导体矿物光电子可以作为部分微生物生长代谢所需的重要能量来源,揭示了一种在自然界中可能广泛存在的非光合微生物利用太阳能的新途径[1]。自然界土壤中广泛存在的还原性物质(腐殖酸、抗坏血酸、还原态硫等)[9-12],能够捕获半导体产生光电子的空穴,并担当电子穿梭体参与微生物在地表过程中的物质循环与能量代谢[13-15]。综上所述,半导体矿物光生电子作为土壤微生物的外源电子来源之一,理应对土壤微生物的生长代谢行为产生一定的影响[1]。
半导体材料纳米TiN作为催化及材料领域的一类重要的半导体化合物[16, 17],与TiO2相比,氮掺杂晶格结构中,电荷密度分布改变形成缺陷或改变晶格类型,其能带结构改变,光催化性能改善[18-20],可见光响应能力强,是一种优良的可见光催化剂[14, 15],所以研究采用TiN作为提供光电子的半导体材料。本研究利用半导体材料纳米TiN提供光电子从某铀尾矿区土壤里直接筛选出能够较强响应半导体矿物光电子的微生物,探讨该微生物响应光电子过程中代谢产物的变化规律,旨为阐明微生物与矿物光电子相互作用微观机制奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 材料与试剂土壤样品采集于某铀尾矿区。TiN悬液:称取0.003 g TiN将其倒入600 mL的超纯水,超声振荡30 min使其均匀分散后,121℃灭菌20 min,保存备用。培养基:酵母粉5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂20.0 g,抗坏血酸12 g(空穴捕获剂),蒸馏水1 000 mL,pH7.0-7.2(除NaCl以外的成分按1:2、1:4等比例稀释,配制相应的1/2、1/4培养基)。马斯亮蓝G-250染料试剂:称取10 mg考马斯亮蓝G-250,加入95%乙醇5 mL和85%磷酸10 mL,定容至100 mL。
1.1.2 主要仪器CHI660E电化学工作站(上海辰华仪器有限公司),实验用三电极系统:钛片作为工作电极、饱和甘汞电极(Saturated Calomel Electrode,SCE)为参比电极、铂丝为对电极(上海越磁电子科技有限公司)、F-7000荧光光度计(Hitachi,JPN)、U-3900紫外-可见分光光度计(Hitachi,JPN)、HY-4A数显调速多用振荡器(常州普天仪器制造公司)等。
1.2 方法 1.2.1 钠灯照射TiN材料光电子性能分析取5 mg/L的50 mL TiN悬液混匀至石英电解池,插入钛片工作电极、饱和甘汞参比电极、铂丝对电极,在钠灯光照100 s、无光照100 s、光照200 s和无光照200 s交替作用条件下,设置电压0 V测定样品电流。
1.2.2 光电子响应微生物的筛选分别取上述土壤样品5 g,加入100 mL浓度为5 mg/L TiN的1/2液体培养基,放在钠灯照射下的振荡培养箱培养2-d(条件:转速120 r/min,温度30℃),取1 mL培养液至新鲜的浓度为5 mg/L TiN的1/4液体培养基,钠灯照射下培养2-3 d。取0.5 mL涂布在1/8固体培养基(TiN浓度为5 mg/L),钠灯照射下培养2-3 d。接种到1/50固体培养基(TiN浓度为5 mg/L)反复划线分离纯化,得到较强响应光电子的Y-5菌株,接种在1/100和1/1 000固体培养基平板(TiN浓度分别为5 mg/L和0 mg/L),并观察菌落生长状况。
1.2.3 菌株Y-5的鉴定 1.2.3.1 形态学鉴定将筛选到的菌株划线接种于固体培养基平板上,30℃培养2-3 d,观察菌落形态;取稳定期菌夜涂布至盖玻片,自然风干,用2.5%戊二醛固定8 h后倒掉戊二醛,分别用30%、50%、70%、90%和100%乙醇梯度洗脱(每次15-20 min),自然风干后电子显微镜扫描菌体形态。参照《伯杰氏细菌鉴定手册(第9版)》[21]与《常见细菌系统鉴定手册》[22]对获得的菌株进行革兰氏染色、氧化酶等生理生化实验。确定菌株类型。
1.2.3.2 系统发育学分析用生工生物工程股份有限公司提供的Ezup柱式细菌基因组DNA抽提试剂盒提取出该菌株的DNA,以7F 1540R和27F 1492R为引物,利用PCR技术扩增出16S r DNA区段,并将扩增片段用1%的琼脂糖凝胶进行电泳[23],纯化PCR产物在上海生工生物工程有限公司测序,通过Blast比对分析所得序列与GenBank数据库中已有的细菌16S rRNA序列的相似性,运用MEGA 5.1软件构建系统发育树。
1.2.4 菌株Y-5生长对光电子的响应分别配制5 mg/L TiN的1/10、1/50、1/100液体培养基(按照每个浓度设置光照组和锡箔纸包裹的黑暗组即无光电子组),然后加入稳定期的菌种1 mL,放在钠灯照射下的振荡培养箱培养(条件:转速180 r/min,温度30℃),利用紫外-可见分光光度计在0 h、6 h、10 h、12 h、16 h、24 h、36 h、48 h、60 h和72 h时段取菌液3 mL于波长600 nm下测OD值,每组处理设置3个重复。收集培养72 h的菌体,生理盐水清洗菌体后,置于0.2 mol/L NaOH中沸水浴10 min,得到微生物蛋白液,取待测蛋白液用0.9%生理盐水按一定比例稀释至2.4 mL,加入0.6 mL G-250(100 mg/L)于比色管中混合摇匀。使用紫外分光光度计于峰位595 nm,以生理盐水作参比,测定吸光度,通过制作标准曲线,计算总蛋白的量[6, 24, 25]。
1.2.5 菌株Y-5代谢对光电子响应按照1.2.4方法和条件将培养到稳定期的菌液在4℃、10 000 r/min条件下冷冻离心,收集上清液,利用F-7000荧光光度计进行三维荧光分析。仪器参数:激发和发射波长是从200 nm开始扫描,到800 nm结束;扫描速度为12 000 nm/min;狭缝10 nm,步径10 nm,PMT电压为700 V[26]。
2 结果 2.1 钠灯照射TiN材料光电子性能分析为验证半导体材料TiN产生光电子性能,测定了TiN在钠灯照射下恒电位时间-电流(I-t)曲线。结果(图 1)表明在有光照时TiN悬液电流值大约在1.0 uA,在无光照时电流值大约在0 uA,光照时段电流大于无光照时段电流。说明该浓度TiN,在钠灯下可以产生一定量的光电子。
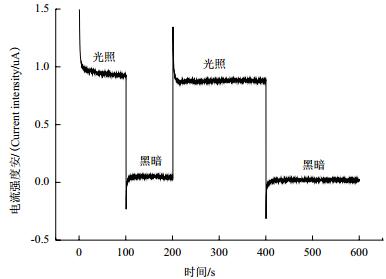
|
| 图 1 TiN恒电位I-t曲线 |
经初步富集、筛选分离得到光电子响应微生物Y-5菌株。如图 2所示,菌株在5 mg/L TiN的1/100固体培养基上出现生长现象,在无TiN的1/100固体培养基和5 mg/L TiN的1/1 000固体培养基上无生长现象,光电子对该菌的生长产生了一定的促进作用。
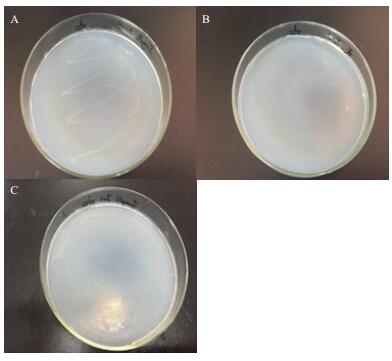
|
| 图 2 光电子响应微生物筛选结果 A、B、C:5 mg/L TiN的1/100培养基、0 mg/L TiN的1/100培养基、5 mg/L TiN的1/1 000培养基 |
在完全营养成分的固体培养基上,Y-5菌株颜色为半透明到不透明,形态为扁平或略凸起,光滑(有时为模糊或粗糙)和边缘完整,大多数菌株可蔓延成不规则边缘(图 3,图 4)。通过扫描电镜发现菌株大小约为0.7-2 μm,为杆状。菌株Y-5常规生理生化特征分析结果见表 1,结果表明菌株Y-5为革兰氏阴性细菌,不能利用糖类物质,可以利用柠檬酸盐,在肉汤培养基中pH值上升到8.6左右,与产碱杆菌属粪产碱杆菌相似。
|
| 图 3 Y-5菌落形态 |

|
| 图 4 Y-5 SEM图像 |
将菌株Y-5的16S rRNA序列(扩增长度为1 415 bp),通过GenBank进行序列分析和同源性比对。结果(图 5)表明,菌株Y-5序列与粪产碱杆菌(Alcaligenes faecalis)的16S rRNA序列同源性为98%。

|
| 图 5 Y-5菌株和相似属的一些种基于16S rDNA序列构建的系统发育树 括号中的序号代表GenBank中的序列号 |
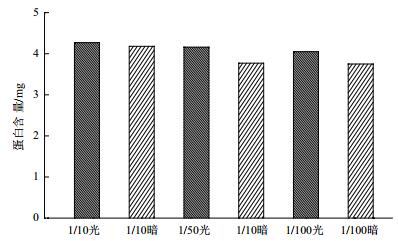
为了突出不同条件下实验效果差别,给细菌一定的生长压力,在生长代谢实验中分别采用稀释10倍、50倍和100倍的培养基培养。如图 6所示,分别为菌株Y-5在5 mg/L TiN的1/10、1/50和1/100液体培养基的生长曲线,在接种培养初期(即最初约5 h),细菌生长处于迟缓期,光照实验组与黑暗对照组无差别;5 h后,开始进入对数生长期,细菌大量繁殖,细胞浓度大幅增加。在1/10培养基中,对数期光照实验组细胞浓度与黑暗对照组几乎无差别,在1/50和1/100培养基中生长速率和生长数量均大于相应浓度的黑暗对照组,表明光催化提高了细菌生长速率和数量。随后细菌生长进入衰亡期,在1/10培养基中,光照实验组衰亡速率与黑暗对照组衰亡速率差别不明显;在1/50和1/100培养基中光照实验组衰亡速率明显小于黑暗对照组,表明光催化延长了细菌的衰亡时间。定量蛋白测试结果(图 7)显示1/10、1/50和1/100培养基有光电子菌体总蛋白含量大于无光电子对照组综上所述1/50和1/100液体培养基中TiN产生的光电子促进了菌株Y-5生长。
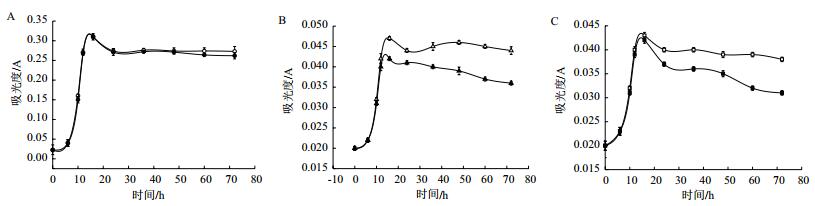
|
| 图 6 Y-5菌株生长曲线图 A、B、C:Y-5菌株在5 mg/L TiN的1 /10、1/50、1/100的培养基中作用,图中实心图形和空心图形分别黑暗和光照两种实验条件 |
|
| 图 7 Y-5菌株与5 mg/L TiN的1/10、1/50、1/100培养基作用后总蛋白测定结果 |
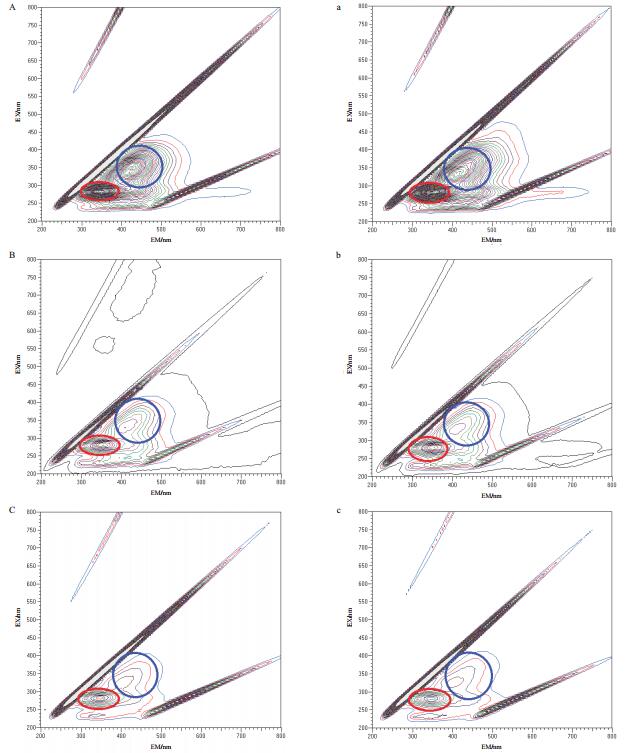
通过三维荧光技术测定有无光电子作用下Y-5菌株的代谢产物变化。如图 8所示,荧光图谱主要在激发波长200-400 nm和发射波长200-500 nm范围内,该区域主要在蛋白质荧光峰(激发波长位于260-290 nm,发射波长发射波长位于340-380 nm)和腐殖酸荧光峰(激发波长位于320-390 nm,发射波长位于400-480 nm)。读取该区域内蛋白质荧光峰值(1/10、1/50和1/100培养基光照组和黑暗组分别是4 029和3 987、2 689和2 574、1 241和1 130)和腐殖酸荧光峰值(1/10、1/50和1/100培养基光照组和黑暗组分别是2 792和2 779、893和841、453和402)表明Y-5菌株在5 mg/L TiN的1/10、1/50和1/100培养基中光照实验组的蛋白质荧光峰和腐殖酸荧光峰变化较明显。
|
| 图 8 三维荧光图谱 (A、a)、(B、b)、(C、c):Y-5菌株在5 mg/L TiN的1/10(光照、黑暗)、1/50(光照、黑暗)、1/100(光照、黑暗)培养基的作用结果,图中红色圈区域表蛋白质,蓝色圈区域代表腐殖酸 |
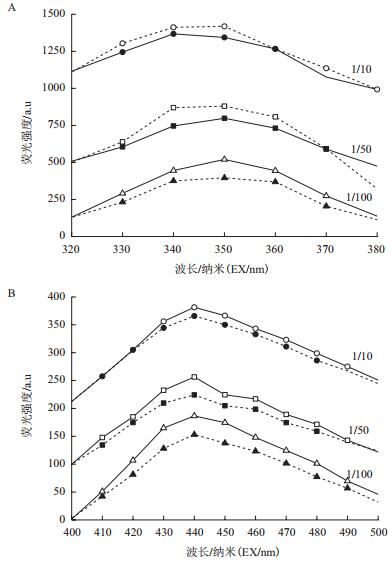
分析蛋白质和腐殖酸结果如图 9所示,Y-5菌株在1/10培养基中的蛋白质和腐殖酸荧光峰光照实验组与黑暗对照组差别较小,在1/50和1/100培养基中蛋白质和腐殖酸荧光峰光照实验组与黑暗对照组差别较大,即在该条件下光照实验组蛋白质和腐殖酸含量大于黑暗对照组。说明在1/50和1/100培养基中光电子作用下Y-5菌株代谢加快。结合生长曲线分析,Y-5菌株在低浓度底物下利用光电子效率更高。
|
| 图 9 Y-5菌株与5 mg/L TiN的1/10、1/50、1/100培养基作用后蛋白质(A)和腐殖酸(B)的荧光强度变化分析图 图中空心图形和实心图形分别光照和黑暗两种实验条件 |
土壤里的微生物是土壤生态系统结构和维持生态系统稳定性的重要构成[27],不仅可以代谢土壤中的动植物残体、调节土壤有机质、土壤结构形成[28],而且与无机矿物的交互作用影响着地球表层物质循环与环境演化,包括矿物的形成与演化、养分循环与污染物的环境行为等[29-32]。随着矿物与微生物交互作用研究领域的发展,微生物与矿物之间电子转移和能量流动逐渐受到关注。近年来,国内外关于这方面研究也取得一些进展,不仅发现一些微生物可以利用光电子为自身提供能量[1],还探索了微生物利用光电子途径受到光波长(光子能量)与光强(光子数量)两方面的因素调控、氧化亚铁硫杆菌利用光电子的机理以及利用效率等[2, 33]。
大量研究表明[1, 34],半导体光电子能够延长铁细菌的电子传递链,作为新陈代谢的能量,实现光能-电能-化学能-生物能的转换,但转换效率远远低于植物转换效率的10%;在外加电压下光电子作用使氧化亚铁硫杆菌细胞浓度由2.5×105/mL上升到到3.25×106/mL,增加12倍。曾翠萍等[35]加偏压证实外来电流可促进粪产碱杆菌菌体在电极表面上的生长和附着;鲁安怀等[2]利用光燃料电子双室装置体系模拟日光下矿物光电子证实光电子降低土壤里微生物群落多样性,影响微生物群落结构。本研究利用半导体材料光生电子与土壤里微生物直接作用,筛选获得Y-5菌株,经形态生理生化系统发育学鉴定为粪产碱杆菌。底物浓度的限制改变了微生物对底物利用效率[36],该菌在1/10底物浓度中光电子作用不明显,在1/50,1/100较低底物浓度中光电子作用使总蛋白含量增加,菌体生长加速。说明粪产碱杆菌是土壤微生物中光电子响应较强的微生物,能够利用光电子作为自身能量来源。
生物地球化学的观点认为,腐殖质能够担当电子穿梭体的角色,参与微生物在地表过程中的物质循环与能量代谢[37-40];微生物能够分泌腐殖质物质进行电子穿梭,参与能量代谢[41];余萍等[7]通过模拟天然半导体矿物所产生的光生电子证实,该模拟光电子作用下,粪产碱杆菌形成了大量具有电化学活性的代谢产物。本研究结果表明,光电子作用下粪产碱杆菌代谢产物蛋白质和腐殖酸增加较多,说明光电子作用下该菌生长代谢加快,增加的腐殖质可能参与电子传递。在后续的研究中将利用代谢组学手段对代谢产物进行分析,结合蛋白组学和转录组学[42]研究半导体矿物光电子在矿物和粪产碱杆菌活动界面上的传递过程与其生长代谢的微观机制[43]。
4 结论本研究主要利用含半导体材料TiN的1/2、1/4、1/8、1/10、1/50和1/100培养基分离纯化得到一株对光电子较强响应的Y-5菌株,依据形态特征、生理生化和16S rRNA序列系统发育学分析,鉴定其为产碱杆菌属的粪产碱杆菌(Alcaligenes faecalis)。菌株在不同浓度底物条件下,生长曲线不同;其不仅能够在5 mg/LTiN光催化下的1/50,1/100低营养成分的培养基中稳定生长,且生长速率和代谢速率也相应的加快,表明该菌株具有响应光电子的能力,是一株“光电能微生物”。同时表明该筛选光电子响应微生物的方法具有可行性,可应用于进一步发现和丰富“光电能微生物”资源方面的研究。
| [1] | 鲁安怀, 李艳, 王鑫, 等. 半导体矿物介导非光合微生物利用光电子新途径. 微生物学通报, 2013, 40(1): 190–202. |
| [2] | Lu A, Li Y, Jin S, et al. Growth of non-phototrophic micro-organisms using solar energy through minernal photocatalysis. Nature Communication, 2012, 3 (4): 768–775. |
| [3] | Marsili E, Baron DB, Shikhare ID, et al. Shewanella secretes flavins that mediate extracellular electron transfer. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105 (10): 3968–3973. DOI:10.1073/pnas.0710525105 |
| [4] | 王项. 微生物表征水体污染状况及还原解毒高铁离子的应用初探[D]. 长沙: 中南大学, 2012. |
| [5] | Zeng CP, Lu A, Li Y, et al. Response of microbial community to sunlight catalysis of semiconductor minerals in red soil. Geological Journal of China Universities, 2011, 17 (1): 101–106. |
| [6] | 王鑫, 李艳, 鲁安怀, 等. 不同光波长下天然闪锌矿光催化作用对Acidithiobacillus ferrooxidans生长的影响. 矿物学报, 2012(s1): 175–176. |
| [7] | 余萍, 李艳, 鲁安怀, 等. 光电子作用下土壤微生物粪产碱杆菌反硝化性能研究. 岩石矿物学杂志, 2013, 32(6): 761–766. |
| [8] | Shumilin IA, Nikandrov VV, Popov VO. Photogeneration of NADH under coupled action of CdS semiconductor and hydrogenase from Alcaligenes eutrophus, without exogenous mediators. Febs Letters, 1992, 306 (2-3): 125–128. DOI:10.1016/0014-5793(92)80982-M |
| [9] | Smirnoff N, Wheeler GL. Ascorbic acid in plants:biosynthesis and function. Critical Reviews in Biochemistry and Molecular Biology, 2004, 35 (4): 291–314. |
| [10] | Hayase K, Tsubota H. Sedimentary humic acid and fulvic acid as surface active substances. Geochimica et Cosmochimica Acta, 1983, 47 (5): 947–952. DOI:10.1016/0016-7037(83)90160-6 |
| [11] | 杨凌, 李松. 水稻土中异化铁还原对Cr (Ⅵ) 还原的环境化学效应[D]. 杨凌: 西北农林科技大学, 2006. |
| [12] | 刘邓. 不同厌氧微生物功能群对粘土矿物结构Fe (Ⅲ) 的还原作用及其矿物转变[D]. 武汉: 中国地质大学, 2012. |
| [13] | Lovley DR, Coates JD, Blunt-Harris EL, et al. Humic substances as electron acceptors for microbial respiration. Nature, 1996, 382 (6590): 445–448. DOI:10.1038/382445a0 |
| [14] | Klüpfel L, Piepenbrock A, Kappler A, et al. Humic substances as fully regenerable electron acceptors in recurrently anoxic environments. Nature Geoscience, 2014, 7 (3): 195–200. DOI:10.1038/ngeo2084 |
| [15] | 张亚萍. 腐殖质对U (Ⅵ) 的吸附与腐殖质/腐败希瓦氏菌还原U (Ⅵ) 的试验研究[D]. 衡阳: 南华大学, 2012. |
| [16] | 王佳. 水热法制备氧化钛纳米棒阵列结构及其光电性能研究[D]. 杭州: 浙江大学, 2014. |
| [17] | 尹诗衡, 雷淑梅, 匡同春. 非金属掺杂改性二氧化钛光催化剂研究进展. 广东化工, 2007, 34(5): 37–39. |
| [18] | 尹佳音, 李艳红, 周婉媛, 等. 纳米TiN制备可见光活性TiO2光催化剂的研究. 环境科学与技术, 2014(s1): 104–107. |
| [19] | Randorn C, Irvine JTS. Synthesis and visible light photoactivity of a high temperature stable yellow TiO2 photocatalyst. Journal of Materials Chemistry, 2010, 20 (39): 8700–8704. DOI:10.1039/c0jm01370f |
| [20] | 王金淑, 刑朋飞, 李莉莉, 等. 机械化学法N掺杂纳米TiO2的制备与表征. 北京工业大学学报, 2006, 32(7): 633–637. |
| [21] | 布坎南RE, 吉本斯NE. 伯杰细菌鉴定手册[M]. 第8版. 北京: 科学出版社, 1984. |
| [22] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [23] | 陈士华, 孙强, 孙莉云, 等. 一株高产油脂微生物菌种的筛选与鉴定. 河南工业大学学报:自然科学版, 2013, 34(6): 65–68. |
| [24] | 丁健. 铁还原菌Sphingomonas sp. DJ的分离及其降解特性的研究[D]. 大连: 大连理工大学, 2014. |
| [25] | 陈聪聪. 金属还原地杆菌对偶氮染料的还原研究[D]. 大连: 大连理工大学, 2012. |
| [26] | 傅平青, 刘丛强, 吴丰昌. 溶解有机质的三维荧光光谱特征研究. 光谱学与光谱分析, 2005, 25(12): 2024–2028. DOI:10.3321/j.issn:1000-0593.2005.12.031 |
| [27] | 滕应, 黄昌勇. 重金属污染土壤的微生物生态效应及修复研究进展. 土壤与环境, 2002, 11(1): 85–89. |
| [28] | 赵李宁. 污染土壤生态修复技术研究. 资源节约与环保, 2015, 4: 149–150. DOI:10.3969/j.issn.1673-2251.2015.06.123 |
| [29] | O'Loughlin EJ, Gorski CA, Scherer MM, et al. Effects of oxyanions, natural organic matter, and bacterial cell numbers on the bioreduction of lepidocrocite (gamma-Fe OOH) and the formation of secondary mineralization products. Environmental Science & Technology, 2010, 44 (12): 4570–4576. |
| [30] | Lovley DR. Dissimilatory metal reduction. Annual Review of Microbiology, 1993, 47 (3): 263–290. |
| [31] | O'Loughlin EJ, Boyanov MI, Flynn TM, et al. Effects of bound phosphate on the bioreduction of lepidocrocite (γ-Fe OOH) and maghemite (γ-Fe2O3) and formation of secondary minerals. Environmental Science & Technology, 2013, 47 (16): 9157–9166. |
| [32] | 陈铭. Fe (Ⅲ)/腐殖质还原菌的分离鉴定及其还原特性研究[D]. 长沙: 湖南农业大学, 2013. |
| [33] | 吕明, 鲁安怀, 郝瑞霞, 等. 铁细菌利用天然金红石光生电子能量研究. 岩石矿物学杂志, 2008, 27(3): 212–220. |
| [34] | 颜云花, 李艳, 鲁安怀, 等. 天然褐铁矿的光电化学响应及对嗜酸性氧化亚铁硫杆菌生长的影响. 岩石矿物学杂志, 2009, 28(6): 535–540. |
| [35] | Zeng CP, Li Y, Lu A, et al. Electrochemical interaction of a heterot-rophic bacteria Alcaligenes faecalis, with a graphite cathode. Geomicrobiology, 2012, 29 (3): 244–249. DOI:10.1080/01490451.2011.589488 |
| [36] | Zheng Z Y, Jin W L, Zhan X B, et al. Effect of metabolic structures and energy requirements on curdlan production by Alcaligenes faecalis. Biotechnology and Bioprocess Engineering, 2007, 12 (4): 359–365. DOI:10.1007/BF02931057 |
| [37] | Lovley DR, Coates JD, Blunt-Harris EL, et al. Humic substances as electron acceptors for microbial respiration. Nature, 1996, 382 (6590): 445–448. DOI:10.1038/382445a0 |
| [38] | Klüpfel L, Piepenbrock A, Kappler A, et al. Humic substances as fully regenerable electron acceptors in recurrently anoxic environments. Nature Geoscience, 2014, 7 (3): 195–200. DOI:10.1038/ngeo2084 |
| [39] | Lovley DR, Fraga JL, Blunt-Harris EL, et al. Humic substances as a mediator for microbially catalyzed metal reduction. Acta Hydrochimica et Hydrobiologica, 1998, 26 (3): 152–157. DOI:10.1002/(ISSN)1521-401X |
| [40] | 王秀娟. 腐殖质类物质对Se/Te及偶氮染料的介导还原研究[D]. 大连: 大连理工大学, 2011. |
| [41] | Nevin KP, Lovley DR. Mechanisms for accessing insoluble Fe (Ⅲ) oxide during dissimilatory Fe (Ⅲ) reduction by Geothrix fermentans. Applied and Environmental Microbiology, 2002, 68 (5): 2294–2299. DOI:10.1128/AEM.68.5.2294-2299.2002 |
| [42] | 吴云当, 李芳柏, 刘同旭, 等. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展. 土壤学报, 2016, 53(2): 278–291. |
| [43] | 史其峰. 微生物多糖热凝胶在CSTR反应器中的发酵与代谢特性研究[D]. 无锡: 江南大学, 2008. |





