2. 广西科学院生物物理实验室,南宁 530007;
3. 广西职业技术学院,南宁 530226
2. Biophysics Laboratory of Guangxi Academy, Nanning 530007;
3. Guangxi Vocational and Technical College, Nanning 530226
从第一次工业革命开始,支撑着世界经济发展和进步的主要能源是石油和煤炭等化石燃料资源。随着经济规模变大,全球对于能源的需求量也在不断增加,化石燃料枯竭的问题日益凸显。按照已发现的矿产储量计算,如若保持当今的开采量,煤炭将在约100-150年、天然气在50-60年、石油在30-40年消耗完[1]。
“可持续发展”是世界经济发展的主题,大力发展可再生能源是达成这一目标的主要保障。以乙醇为代表的可再生生物质能源能有效缓解能源危机,具有较好的应用前景。近年来,以丰富的海洋藻类资源作为原材料迅速发展的第三代生物乙醇技术,引起了能源领域的广泛关注[2]。据理论推测,仅需利用我国海洋面积的1%种植大型海藻就能生产1.3亿t乙醇,能代替市场20%的石油需求,二氧化碳排放量可降低5.5%[3]。我国生物质能源的开发政策是“不与人争粮,不与粮争地”[4],利用大型藻类发展生物质能源,符合我国国情,应用潜力大,可以较好地满足我国能源可持续发展的需求。
在地球上的大分子多糖中,褐藻胶的总量仅次于纤维素,是海藻最主要的组成成分。褐藻胶是一种高分子聚合物,通过1-4糖苷键连接β-D甘露糖醛酸(β-D-mannuronic)和α-L古罗糖醛酸(α-L-guluronic)单体而成,褐藻细胞壁是其主要存在部位[5]。利用褐藻胶裂解酶处理海藻酸可得到单糖,通过特定微生物进行发酵可将单糖转化为生物乙醇。因此,利用微生物技术高效地将海藻酸转化为燃料乙醇,是得到生物质能源的一条重要途径,而如何获得高活性褐藻胶裂解酶,将海藻酸高效转化为燃料乙醇是该途径的关键[2]。褐藻胶裂解酶的主要海洋或者陆地微生物来源包括假交替单胞(Pseudoalteromonas)[6]、弧菌(Vibrio)[7]、黄杆菌(Flavobacterium)[8]、芽胞杆菌(Bacillus)[9]、链霉菌(Streptomyces)[10]等。
本研究利用海藻酸钠作为筛选培养基的唯一碳源,经过多次富集和纯化,从腐烂的马尾藻中筛选得到一株高产褐藻胶裂解酶的菌株X511,通过形态观察、生理生化指标考察和16S rDNA基因序列分析对菌种进行鉴定,并研究其生长特性、盐耐受性及底物特异,旨为丰富对褐藻胶裂解酶产生菌菌株的研究提供借鉴。
1 材料与方法 1.1 材料 1.1.1 样品采集分离菌种的样本采自广西北海涠洲岛周边海域生长的马尾藻。
1.1.2 主要试剂及仪器台式冷冻离心机购自德国Hitachi科学仪器公司;双光束紫外可见分光光度仪(TU-1901)购自北京普析通用仪器有限公司;PCR仪购自德国Biometra公司;超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;细菌总DNA提取试剂盒购自杭州博日科技有限公司;Silica gel 60 TLC铝板购自德国merk集团;海藻酸钠购自阿拉丁试剂公司;硫酸镁、甘露糖等购自天津博迪化工股份有限公司;氯代十六烷基吡啶购自天津光复精细化工研究所;聚甘露糖醛酸、聚古罗糖醛酸等由国家海洋药物工程技术研究中心赠送。
1.1.3 培养基富集和筛选培养基:海藻酸钠6 g,NaCl 15 g,硫酸铵5 g,磷酸氢二钾1 g,硫酸镁1 g,硫酸亚铁0.001 g,加水定容到1 L,pH7.5,121℃灭菌20 min。
盐耐受性培养基:在筛选培养基中加入终浓度为0%、1%、2%、3%、4%、5%、6%、7%、8%和9%,10% NaCl(W/V)配制,pH 7.5,121℃灭菌20 min。
固体平板筛选培养基在富集和筛选培养基的基础上加1.5%琼脂,发酵培养基与筛选培养基相同。
1.2 方法 1.2.1 菌株筛选与纯化将马尾藻样品与2%(W/V)的NaCl水溶液混合均匀,室温(20℃左右)放置至样品发生腐烂。取10 mL腐烂样品上清于90 mL 2%(W/V)的NaCl溶液中混匀,吸2 mL接种于富集培养基中,30℃摇瓶富集培养3 d,摇床转速200 r/min。将富集的菌液梯度稀释涂平板,30℃恒温培养2 d,观察平板上的菌落形态,挑取生长状况较好的单菌落平板划线,进一步纯化,利用10%(W/V)氯代十六烷基吡啶对已纯化的菌落染色,挑取水解圈与菌落直径比最大的菌株,低温保存备用。
1.2.2 菌株生长曲线和酶活力测定生长曲线的绘制:用接种环挑取一环菌种接至培养基中过夜活化后转至50 mL/250 mL富集培养基,30℃条件下摇瓶培养,摇床转速200 r/min,每隔4 h取样一次,稀释至合适浓度,测600 nm光吸收值,作生长曲线;8 000 r/min离心30 min,收集菌体,破胞,测定胞内酶酶活力曲线。酶活测定:胞内酶粗酶。根据产酶曲线,取5 mL培养24 h的菌液,8 000 r/min离心30 min,收集菌体,加入10 mL 0.02 mol/L的PBS缓冲液重悬浮,8 000 r/min离心15 min,重复3次洗净培养基,超声细胞粉碎机破胞20 min,将破胞液8 000 r/min离心20 min,取上清,用于胞内酶活测定,上述操作均在4℃条件下进行。相对酶活力测定:参照Preiss法[11],取0.5 mL胞内粗酶加入到1.5 mL 0.2%(W/V)海藻酸钠底物中,30℃水浴酶解30 min,沸水浴5 min终止反应,冷却至室温,测定235 nm光吸收值。定义光吸收值每分钟增加0.01为1个酶活力单位(U)。
1.2.3 菌株鉴定菌株X511的菌落形态观察。将已纯化的菌株划线至筛选培养基,恒温(30℃)培养48 h,观察单菌落的形态特征,采用革兰氏法染色,在光学显微镜下观察单个菌体细胞形态并拍照。
生理生化相关、糖类发酵指标以及产酶能力指标送科标技术(青岛)研发中心测试。
耐盐性生长特性测定。按2%(V/V)的接种量将培养至对数期的种子液接种至不同浓度的盐耐受性培养基中,30℃,200 r/min条件下震荡培养24 h,测定生物量和酶活性。
菌株的16S rDNA基因鉴定。挑取纯化的菌株培养至对数期,使用细菌基因组DNA提取试剂盒提取基因组DNA。16S rDNA引物为27 f(5' -AGAGTTTGATCMTGGCTCAG-3' )和1 492r(5' -GGTTAC-CTTGTTACGACTT-3' )。回收PCR产物,将扩增片段送至北京奥科鼎盛生物科技有限公司测序。测序结果的16S rDNA基因序列输入美国国立生物技术信息中心(NCBI)核酸数据库进行BLAST在线分析,下载同属代表种的16S rDNA序列,将结果输入MEGA6.0软件中,进行完全序列比对切割后,以Neighbor-Joining方法构建系统发育树。
1.2.4 菌株X511胞内酶底物特异性分析底物专一性。分别取0.5 mL胞内粗酶至1.5 mL 1%海藻酸钠、1.5 mL 1%聚甘露糖醛酸和1.5 mL 1%聚古罗糖醛酸溶液中,30℃水浴酶解0.5 h,沸水浴5 min终止反应,测定235 nm光吸收值。薄层层析法(TLC)分析胞内酶酶解产物。用pH为7.5的Tris-HCl缓冲液配制10 mg/mL海藻酸钠底物溶液,取0.5 mL胞内酶粗酶加至1.5 mL的海藻酸钠底物溶液中,30℃水浴1 h,沸水浴5 min终止反应,冷却至室温,12 000 r/min离心5 min后取3 μL上清,作为酶解上样液,分两次点样于TLC铝板上,80℃烘干后,在4℃条件下进行Silica gel 60 TLC分析。展开剂各成分的比例为正丁醇:乙酸:水= 3:2:2;取10 mL浓硫酸加入到90 mL无水乙醇中,混匀,作为显色剂。待样品展开后,晾干硅胶铝板,用显色剂喷雾染色,110℃烘10 min显色。
1.2.5 菌株X511的多糖利用能力按2%(V/V)的接种量将培养至对数期的种子液分别接至50 mL以海藻酸钠、海带粉、可溶性淀粉、D-木糖、褐藻胶、昆布多糖等多糖为唯一碳源的液体培养基中震荡培养(4℃,200 r/min),每隔1 d取样,测OD600值。
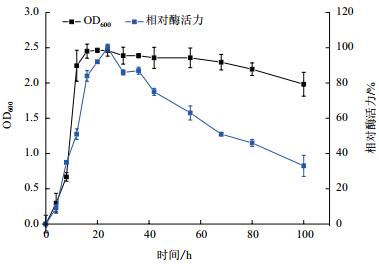
2 结果 2.1 褐藻胶裂解酶产生菌的筛选经富集培养、筛选和纯化,自腐烂的马尾藻中共筛选得到15株具有褐藻胶降解能力且能在平板上形成水解圈的菌株。将筛选到的菌株进行平板复筛,用10%(W/V)的氯代十六烷基吡啶染色。结果表明,菌株X511周围出现大于菌落自身直径3倍的水解圈。经过5代遗传稳定性培养,选择产酶能力稳定的菌株作为出发菌株进一步研究。菌株X511能同时产生胞内酶和胞外酶,其中胞外酶活力为5.037±0.15 U/mL,胞内酶活力为12.68±0.13 U/mL,故选用该菌株所产生的胞内酶作进一步研究。菌株X511在以海藻酸钠为唯一碳源的液体培养基中的生长曲线和产胞内酶曲线,如图 1。该菌株生长具有明显的3个时期,即延缓期(0-4 h),对数期(5-16 h),稳定期(16-100 h),在接种至新鲜培养基的前24 h,其胞内酶活随着时间的增加而上升,在培养至24 h时,该菌株的胞内酶活达到最大,随后发生较明显的下降,推测与培养基营养成分的消耗和菌株自身的老化有关。
|
| 图 1 菌株X511在液体发酵培养基中的生长曲线和产胞内酶曲线 |
菌株X511菌落形态以及细胞形态特征如图 2-A所示,菌株在固体筛选平板上能形成规则的圆形菌落,生长时间超过48 h后,菌落由乳白色变为淡黄色,中间凸起,表面光滑湿润,边缘整齐,易挑取。菌株经革兰氏染色后光学显微镜观察,该菌株为革兰氏阴性菌,菌体呈弧形,未发现芽孢存在(图 2-B)。

|
| 图 2 菌株X511的菌落及菌体形态观察和革兰氏染色结果 A:菌株X511在筛选培养基上点样培养3 d后的10%氯代十六烷基吡啶染色出现的透明圈;B:菌株革兰氏染色后镜检结果 |
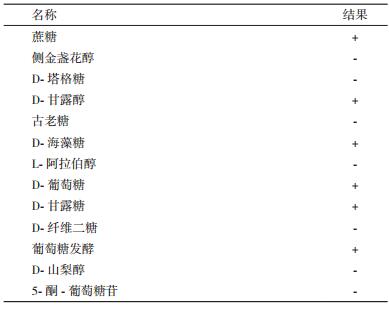
菌株X511能利用蔗糖、D-海藻糖、D-葡萄糖、D-甘露醇、甘露糖,葡萄糖作为碳源生长,不能利用D-塔格糖、古老糖、D-纤维二糖、D-山梨醇和侧金盏花醇、L-阿拉伯醇和5-酮-葡萄糖苷(表 1)。在菌株的生长过程中,能检出β-N-乙酰葡萄糖苷酶、氨基乙酸芳胺酶、L-脯氨酸芳胺酶、吡咯烷基芳胺酶和酪氨酸芳胺酶等5种酶的活性(表 2)。
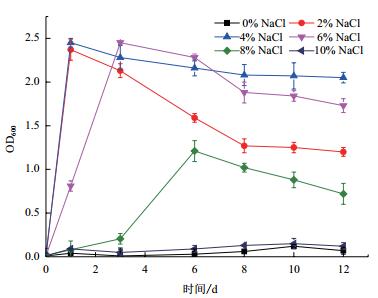
耐盐性结果(图 3)显示,菌株X511无法在不含NaCl的培养基中生长;当培养液中的NaCl浓度为2%(W/V)和4%(W/V)时,菌株在不到1 h内达到最大生物量;当培养基中的NaCl浓度为6%(W/V)和8%(W/V)时,菌株生长达到稳定期的时间延后,生物量积累速度相对缓慢,随着NaCl浓度加大,菌株达到稳定期时间越长,总生物量越低;当培养液中的NaCl浓度为10%(W/V)时,菌株基本不能生长。
|
| 图 3 NaCl浓度对菌株X511生长的影响 |
利用16S rDNA通用引物对菌株X511扩增,得到的目的片段长度为1 570 bp,其中(G+C)含量为56%。利用NCBI上的BLAST程序进行序列同源性比对,菌株X511与弧菌属的多种菌株相似性为99%,同时结合菌株的形态特征和生理生化特征,鉴定其为弧菌属菌株,并命名为Vibrio sp. X511,系统发育树,见图 4。

|
| 图 4 基于16S rDNA基因序列用Neighbor-Joining方法构建的菌株X511与相关菌种的系统发育树 分支节点上的数值表示分支的置信度百分数;标尺所示长度为0.2%核苷酸置换率 |
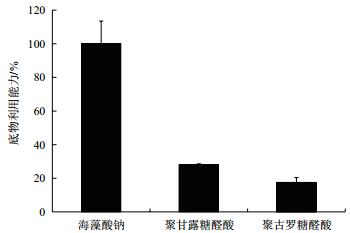
菌株X511胞内酶粗酶分别降解海藻酸钠、聚甘露糖醛酸和聚古罗糖醛酸,其对不同底物的利用能力如图 5所示。菌株X511中的胞内酶粗酶液能同时降解海藻酸钠、聚甘露糖醛酸和聚古罗糖醛酸,其中,该菌株利用海藻酸钠的能力最强,利用聚甘露糖醛酸能力次之,而利用聚古罗糖醛酸能力最弱。
|
| 图 5 菌株X511胞内粗酶对海藻酸钠、聚甘露糖醛酸和聚古罗糖醛酸利用能力 |
菌株X511胞内酶粗酶降解海藻酸钠,离心,取上清进行薄层层析(TLC),结果如图 6所示,该菌株胞内酶降解海藻酸钠后能得较高浓度的褐藻三糖产物。

|
| 图 6 TLC分析菌株X511降解海藻酸钠产物 1:单糖;2:双糖;3:三糖;4:海藻酸钠酶降解产物;5:海藻酸钠 |
菌株X511在不同多糖培养液中的菌体浓度,如图 7所示。菌株在以海藻酸钠、海带粉和昆布多糖为唯一碳源时,其生物量最高,可溶性淀粉次之。此外,菌株还能利用L-岩藻糖、褐藻胶、褐藻糖胶和海带多糖,以羧甲基纤维素钠和D-木糖为唯一碳源时,菌株不能生长。
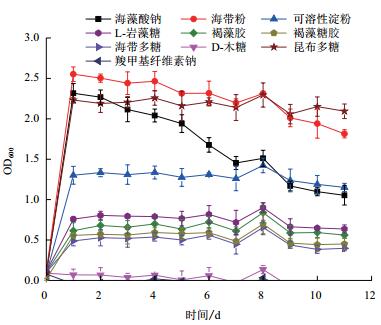
|
| 图 7 菌株X511在不同多糖培养基中的菌体浓度 |
近年来,对海洋环境来源的产褐藻胶裂解酶微生物的筛选屡有报道,筛选材料多为腐烂海带,海泥,海水以及海洋鱼类的内脏[12-15]等,本研究从腐烂的马尾藻中筛选得到了一株产褐。藻胶裂解酶菌株,其对数生长期为5-16 h,在培养24 h时相对酶活力达到最大;继续培养后菌株的生物总量没有明显变化,但随着菌株的老化以及培养基的消耗,酶活力下降趋势明显,菌株的总生物量未发生明显下降;该菌株的最大产褐藻胶裂解酶时间相对于达到最大生物量时间有一定的延迟,老化能迅速降低该菌株的产褐藻胶裂解酶能力。本研究从腐烂的马尾藻中筛选得到了一株产褐藻胶裂解酶的海洋弧菌X511。菌株X511的对数生长期为5-16 h,在培养24 h时相对酶活力达到最大,与已报道的菌株相比[16, 17],该菌株的生长速度快,达到酶活最大所需时间短。在耐盐性试验中,菌株X511在无氯化钠的培养液中不能生长,一定的盐浓度(2%-6%)能促进该菌株的生长,并能延长其稳定期;6%(W/V)的盐浓度能减缓该菌株的生长速度,但并不影响其最大生物量;当盐浓度大于6%(W/V)时,菌株的生长速度和最大生物量均明显降低;10%(W/V)的NaCl浓度能抑制该菌株的生长。与其他同类型产褐藻胶裂解酶的嗜盐菌株相比[15],该菌株的盐耐受性较强。
菌株X511能同时降解海藻酸钠、聚甘露糖醛酸和聚古罗糖醛酸,推测该菌株可能产生了能分别降解不同的底物多种酶,也可能产生了一种双功能酶,有待进一步研究。目前研究的大多数酶对聚甘露糖醛酸片段有偏好性,只有少数对聚古罗糖醛酸片段有偏好性[18]。薄层层析分析该菌株胞内酶水解海藻酸钠后的产物,发现其水解产物主要的为褐藻胶三糖。李恒等[13]筛选得到一株盐单胞菌halomonas sp.WF6,酶水解海藻酸钠后的薄层层析产物主要为聚合度为二和三的寡糖。Wang等[19]筛选的希瓦氏菌属Shewanella sp.Kz7能同时水解聚甘露糖醛酸和聚古罗糖醛酸得到单糖。据相关报道,以褐藻胶三糖为主要成分的褐藻胶寡糖能促进大鼠肠道内益生菌的增殖和抑制有害菌的生长,而且低分子量的褐藻胶寡糖具有很强的抗氧化活性,有望开发成一种新的食品添加剂和饲料添加剂[20]。
在多糖利用实验中,菌株X511能利用褐藻胶、海藻酸钠、昆布多糖、海带粉、可溶性淀粉、海带多糖、褐藻糖胶和L-岩藻糖,不能利用羧甲基纤维素钠和D-木糖。海带的主要多糖成分褐藻胶和昆布多糖[21],该菌株能分别利用这两种多糖,为海带的生物酶解提供了思路。此外,海带粉和昆布多糖还能延长该菌株的稳定期。
4 结论自广西涠洲岛海域马尾藻样本中分离纯化得到一株具有较强海藻酸钠降解能力的海洋细菌,属于革兰氏阴性菌,鉴定为弧菌属,编号X511。
菌株X511的生长速度快,16 h达到稳定期,液体发酵24 h酶活达到最大,能利用的单糖有葡萄糖、D-海藻糖、D-葡萄糖、D-甘露醇、甘露糖和蔗糖,还能以多种多糖为唯一碳源,如褐藻胶、海藻酸钠、昆布多糖、海带粉、可溶性淀粉、海带多糖、褐藻糖胶和L-岩藻糖,其中包括多种褐藻的多糖成分,对褐藻资源的开发和利用具有较高的价值。
菌株X511在无NaCl以及NaCl浓度大于10%(W/V)的培养液中不能生长,其适宜生长的盐浓度为2%-6%(W/V),且一定浓度的NaCl、海带粉和L-岩藻糖能延长该菌的平稳期,属于典型的海洋细菌。
菌株X511产生的酶同时对海藻酸钠、聚甘露糖醛酸和聚古罗糖醛酸有酶解活性,其海藻酸钠的酶降解产物主要为褐藻胶三糖。
| [1] | Campbell CJ, Laherrere JH. Preventing the next oil crunch-the end of cheap oil. Scientific American, 1998, 278 (3): 77–83. DOI:10.1038/scientificamerican0398-77 |
| [2] | 钱龙, 唐丽薇, 黄庶识, 伊日布斯. 海藻酸转化生物乙醇研究进展. 中国生物工程杂志, 2013, 33(1): 122–127. |
| [3] | 任小波, 吴园涛, 向文洲, 秦松. 海洋生物质能研究进展及其发展战略思考. 地球科学进展, 2009, 24(4): 403–410. |
| [4] | 于敏, 关春江, 那杰. 大型海藻发酵制取乙醇研究浅析. 水产学杂志, 2014, 27(1): 55–59. |
| [5] | Panikkar R, Brasch DJ. Composition and block structure of alginates from New Zealand brown seaweeds. Carbohydrate Research, 1996, 293 (1): 119–132. DOI:10.1016/0008-6215(96)00193-0 |
| [6] | Ma LY, Chi ZM, Li J, Wu LF. Overexpression of alginate lyase of Pseudoaltetmonas elyakovii in Escherichia coli, purification, and characterization of the recombinant alginate lyase. World J Microbiol Biotechnol, 2008, 24 (1): 89–96. DOI:10.1007/s11274-007-9443-2 |
| [7] | Kawamoto H, Horibe A, Miki Y, et al. Cloning and sequencing analysis of alginate lyase genes from the marine bacterium Vibrio sp. O2[J]Mar Biotechnol, 2006, 8 (5): 481–490. |
| [8] | An QD, Zhang GL, Wu HT, et al. Alginate-deriving oligosaccharide production by alginase from newly isolated Flavobacterium sp. LXA and its potential application in protection against pathogens. J Appl Microbiol, 2009, 106 (1): 161–170. DOI:10.1111/jam.2008.106.issue-1 |
| [9] | Nakagawa A, Ozaki T, Chubachi K, et al. An effective method for isolating alginate lyase-producing Bacillus sp. ATB-1015 strain and purification and characterization of the lyase. J Appl Microbiol, 1998, 84 (3): 328–335. DOI:10.1046/j.1365-2672.1998.00319.x |
| [10] | Cao L, Xie L, Xue X, et al. Purification and characterization of alginate lyase from Streptomyces species strain A5 isolated from banana rhizosphere. J Agric Food Chem, 2007, 55 (13): 5113–5117. DOI:10.1021/jf0704514 |
| [11] | Preiss J, Ashwell G. Alginic acid metabolism in bacteria. I. enzymatic formation of unsaturated oligosac-charides and 4-deoxy-L-erythro-5-hexoseulose uronic acid. The Journal of Biological Chemistry, 1962, 237 : 309–316. |
| [12] | 陈朋, 朱玥明, 韩文佳, 等. 产褐藻胶裂解酶菌种的筛选、鉴定及发酵条件优化. 食品科学, 2015, 36(15): 105–111. DOI:10.7506/spkx1002-6630-201515020 |
| [13] | 李恒, 朱思婷, 刘旭梅, 等. 褐藻胶裂解酶产生菌的分离鉴定及产酶发酵优化. 中国生物工程杂志, 2014, 34(9): 94–101. |
| [14] | 严芬, 连燕萍, 杨光, 等. 高产褐藻胶裂解酶菌株的筛选及发酵条件优化. 食品工业科技, 2015, 36(22): 287–292. |
| [15] | 郭恩文, 王亚, 于文功, 韩峰. 产双功能褐藻胶裂解酶菌株的筛选与初步研究. 现代生物医学进展, 2013, 13(29): 5606–5609. |
| [16] | 侯士昌, 温少红, 唐志红, 等. 一株高效褐藻酸降解菌的筛选、鉴定及其发酵条件的优化. 海洋科学, 2014, 7: 20–26. DOI:10.11759/hykx20140104 |
| [17] | 李永幸, 杨帆, 姜泽东, 等. 响应面优化微泡菌ALW1产褐藻胶裂解酶的发酵条件. 发酵科技通讯, 2016, 2: 75–80. DOI:10.3969/j.issn.1674-2214.2016.02.003 |
| [18] | 林清菁, 潘崇良, 蒋霞敏, 等. 一株海藻多糖降解菌的分离与鉴定. 微生物学通报, 2014, 41(11): 2208–2215. |
| [19] | Wang L, Li S, Yu W, Gong Q. Cloning, overexpression and characterization of a new oligoalginate lyase from a marine bacterium, Shewanella sp.. Biotechnol Lett, 2015, 37 (3): 665–671. DOI:10.1007/s10529-014-1706-z |
| [20] | 孙丽萍, 薛长湖, 许家超, 等. 褐藻胶寡糖体外清除自由基活性的研究. 中国海洋大学学报, 2005, 35(5): 811–814. |
| [21] | 仇哲, 孙跃春, 吴海歌. 酶解海带产物的营养成分分析. 黑龙江八一农垦大学学报, 2016, 28(2): 60–63. |