2. 中国科学院大连化学物理研究所天然产物与糖工程课题组 辽宁省碳水化合物重点实验室,大连 116023;
3. 大连海洋大学食品科学与工程学院,大连 116023
2. Natural Products and Glyco-Biotechnology, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023;
3. College of Food Science and Engineering, Dalian Ocean University, Dalian 116023
表面活性剂是一类素有“工业味精”之称的重要化工原料,在环境、石油、化妆品、纺织、食品等领域有着广泛的应用。传统的表面活性剂是以石油为原料合成的,有着原材料价格波动较大,易造成环境污染等缺陷。随着生物技术的飞速发展,生物来源的表面活性剂逐渐引起人们的重视,它是由一些微生物分泌产生的,集亲水基团和疏水基团于一身的两亲化合物[1]。
与传统化学合成的表面活性剂相比,生物表面活性剂具有的特性和优点有:(1)化学结构较为复杂和庞大,在表面拥有更多的活性基团,因此表面张力和界面张力较低,乳化活性较高[2];(2)具有一些化学方法难以合成的基团,结构更特殊,专一性更强,赋予了其具有一些化学表面活性剂不具有的性质和生理功能,如抗菌、抗病毒等[3];(3)稳定性较强,可以在较高的温度、盐度下保持特定的活性[4];(4)生物表面活性剂大多是以天然副产物为原料,产生的副产物毒性小,而且其性能较强,用量少,具有生物可降解性,所以在生产、使用的过程对环境的污染和破坏较小[5];(5)生物表面活性剂的生产原料来源方便、价格便宜、可再生,工艺简单,因此生产成本较低[6]。
生物表面活性剂依据其不同的化学结构可以分为糖脂、脂肤、磷脂、脂蛋白、中性脂肪酸酸脂以及脂多糖聚合物等[7]。目前,糖脂是最重要且品种最多的一类生物表面活性剂[8],在该类生物表面活性剂中,糖是以共价键的形式结合在脂肪酸上,其脂肪酸的烷基部分是亲油基团,糖环部分为亲水基团[7]。鼠李糖脂是最常见且应用最广泛的一类糖脂[8],其于1949年首次被报道由铜绿假单胞菌产生,是由一个或者两个鼠李糖以共价键的形式与一个或者两个β-羟基脂肪酸结合而成[9]。鼠李糖脂除了在石油、化工、环境等方面的用途外,还可以用来生产鼠李糖,生产的鼠李糖可以广泛应用到食品、医药工业中[10]。
石油是重要的能源物质,在世界的发展中有着不可替代的地位。我国石油的消耗量较大,储量相对较少,现在超过一半的石油需要进口,但是以目前的技术,原油的开采率较低[11],造成开采收率低的主要原因有:(1)常规开采后高粘稠原油比例的提高使得原油的流动性降低;(2)某些地方的油质本身的渗透性较低,难以流动;(3)油水间的表面张力很高使得毛细管力升高。正是由于这些原因,使得石油进一步开采的难度增加了。为了克服这些问题,在原油的开采过程中,往往会向地层中注入一些表面活性剂以改变岩石表面的憎水性,降低表面和界面的张力,促进原油的乳化,改善油水的流度比进而提高石油的采收率。传统的表面活性剂大多是化学合成品,如石油磺酸盐等,但是生产石油磺酸盐的原材料--石油在不同时期的价格、来源不稳定,在使用的过程中还会产生严重的环境污染,而鼠李糖脂这类生物表面活性剂可以有效解决这些问题。鼠李糖脂除了在降低表面张力,改变岩石的憎水性,促进原油的乳化方面的性能与磺酸盐相似外,在热稳定方面比磺酸盐更好,在地层水中的溶解性更强,能够更好的发挥作用。大庆油田将鼠李糖脂发酵液与磺酸盐混合使用,可以产生明显的协同效应,使得价格昂贵的磺酸盐用量大幅减少,有效的降低了成本,减轻了环境污染[12]。鼠李糖脂还可以用来帮助治理被石油污染的环境,它聚集在油水的界面,降低界面张力,促进乳化作用,从而增强油水的流动性,实现油相在水相的分散,使得石油可以快速的进入微生物细胞体内进而被分解掉,快速修复被石油污染的环境[8, 13]。
本研究从油田附近、沼气池旁的土壤中分离得到了几十株菌,经过硫酸-苯酚反应、乳化实验、排油性实验及薄层色谱实验证实了“其红”菌可以产生鼠李糖脂。通过分析其16S rDNA的序列,确定该菌属于希瓦氏菌属(Shewanella),与腐败希瓦菌(S.putrefaciens LMG 26268(T))相似度最高,旨在为进一步研究该类菌特性及其应用提供借鉴参考。
1 材料与方法 1.1 材料 1.1.1 菌株沼气池旁、油田附近、排水沟处的土壤样品共计9份。
1.1.2 培养基与溶液液体富集培养液:蛋白胨10 g/L,牛肉浸膏3 g/L,NaCl 5 g/L,(固体培养基还加入20 g/L的琼脂),调pH值7.0,121℃灭菌15 min,用于菌株的分离纯化。
发酵培养液:甘油20 g/L,葡萄糖20 g/L,蛋白胨10 g/L、酵母膏5 g/L、NaH2PO4 2 g/L、MgSO4·7H2O 0.5 g/L、调节pH 7.0,121℃灭菌15 min。用于发酵产鼠李糖脂。
硫酸苯酚溶液:1 mL 6%苯酚和5 mL浓硫酸后混匀。用于检测鼠李糖脂。
展开剂:氯仿:甲醇:水比例为65:15:2,100 mL体积再滴加2滴乙酸。用作薄层色谱实验。
染色剂组成:3 g苯酚和5 mL 98%的浓硫酸溶于95 mL无水乙醇中。用作薄层色谱后的染色。
1.2 方法 1.2.1 分离、纯化菌株将样品用无菌水稀释后取上清接于液体富集培养液中培养2 d,将菌液梯度稀释后取200 μL涂布于固体的富集培养基上面,28℃培养3 d,挑取形态、颜色不同的单菌落在固体富集培养基上面划线,分离纯化细菌,菌长起来以后再划五次确保获得的菌株是纯的。
1.2.2 乳化指数的测定[14]将分离的单菌落接入发酵培养液中培养48 h后,发酵液12 000 r/min离心10 min,留上清。取上清0.5 mL到一个密闭的小玻璃管中,再加入1 mL煤油,充分震荡,静置24 h,测量乳化层和整个混合物液面的高度,每个发酵液样品测3个平行。计算乳化指数。计算公式为:E1%=100%×乳化层高度/混合物高度。
1.2.3 排油圈的测定[14]取30 mL去离子水至干净的培养皿中,再添加200 μL柴油以形成油膜,将发酵液上清稀释10倍后取5 μL加到油膜的中央,测定排油圈的直径。每个发酵液上清样品测3个平行。
1.2.4 硫酸-苯酚反应[14]将发酵液上清和未接菌的发酵液稀释10倍后取0.2 mL到密闭试管中,液态的鼠李糖脂标准品稀释500倍后取0.2 mL至另外的密闭试管中,再加入0.6 mL硫酸苯酚溶液至试管中,沸水浴中煮15 min,冷却到室温以后,取200 μL到96孔板中,使用酶标仪在400 nm至700 nm间,以5 nm为间隔进行全波长扫描。
1.2.5 薄层色谱实验[14]根据前面测定的结果选择了5株可能产鼠李糖脂的菌株再接入发酵培养液中培养2 d,发酵液离心,用浓盐酸将上清的pH值调到2,4℃放置24 h后在4℃下12 000 r/min离心20 min,弃上清,沉淀用真空冷冻干燥机冻干。将制备的鼠李糖脂溶于0.05 mol/L的NaHCO3溶液中配成终浓度5.93 g/L的鼠李糖脂溶液。用毛细管取鼠李糖脂溶液在距薄层色谱板一端约1 cm处进行点样,并同时在另一点样处点上鼠李糖脂的标准品作为参照。将薄层色谱板置于盛有展开剂的展开槽中展开,待展开剂上升到距离色谱板顶端1 cm左右时取出色谱板,自然晾干后喷上染色剂100℃烘烤显色直至出现棕色斑点为止。测量点样点距离棕色斑点和展开剂边缘处的距离以计算迁移率。迁移率(%)=100%×待测物质迁移距离/溶剂展开距离。
1.2.6 菌种鉴定经过4个实验确定了一株命名为“其红”的菌株能产鼠李糖脂,挑取该菌的单菌落接入液体富集培养液中培养12 h,取菌液12 000 r/min离心10 min,用DNA提取试剂盒提取其全基因组。以提取的DNA为模板,以16S rDNA基因的通用引物[15]27F和1 492R扩增该菌的16S rDNA序列。扩增的片段经过胶回收后送华大基因科技服务有限公司测定序列,测得的序列提交到细菌鉴定专用数据库ezbiocloud(http://www.ezbiocloud.net/eztaxon)进行同源性检索,下载模式菌株的序列,利用MEGA6软件以Neighbor-Joining(NJ)法构建系统发育树[16]。
2 结果 2.1 菌株的分离与纯化依据菌落的形态、颜色等的不同,经过5次以上的划线最终分离得到了25株菌,它们被用作进一步的实验以筛选产鼠李糖脂的菌。
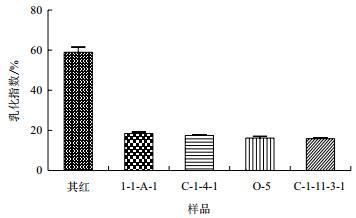
2.2 乳化指数的测定分离出来25株菌的发酵液测完乳化指数后,5株有明显乳化作用菌发酵液的乳化指数,见图 1。“其红”菌株乳化指数可达58.97%。
|
| 图 1 几株菌的乳化指数 |
发酵液上清稀释10倍取5 μL测定了排油圈直径,具有明显排油性菌株的排油圈直径如图 2。编号为C-1-4-1菌的排油性最好,直径可达3.53 cm。

|
| 图 2 几株菌的排油圈直径 |
发酵液上清进行硫酸-苯酚反应并以5 nm为间隔进行全波长扫描,结果(图 3)显示鼠李糖脂的标准品在475 nm处有吸收峰,未接菌的发酵液在485 nm处有吸收峰,编号为“其红”、1-1-A-1菌的吸收峰在475 nm处。

|
| 图 3 “其红”、1-1-A-1发酵液与鼠李糖脂标准品和未接菌发酵液的全波长扫描吸收峰图 |
层析染色后发现与鼠李糖脂标准品一样,“其红”这株菌在相对应的位置也有一个棕色斑点(图 4),其他菌未发现明显的棕色斑点。据Zhang等[17]报道,有棕色斑点的可认为是糖脂。测量了这2个图谱中溶剂与样品的迁移距离,“其红”样品的迁移距离是4.0 cm,溶剂的迁移距离是7.4 cm,所以“其红”样品的迁移率为4.0/7.4×100%=54%。鼠李糖脂标准品的迁移距离是3.9 cm,溶剂的迁移距离是7.4 cm,所以鼠李糖脂标准品的迁移率为3.9/7.4×100%=53%。

|
| 图 4 薄层色谱分析“其红”菌株的鼠李糖脂产物 左边为鼠李糖脂标准品,右边为“其红”菌样品 |
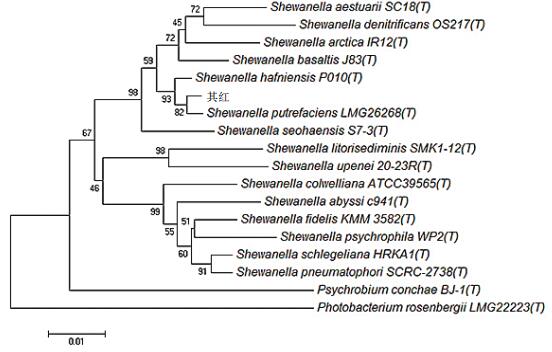
经过前面一系列的实验确定了“其红”这株菌可以产鼠李糖脂。使用通用引物扩增出1 500 bp左右的16S rDNA序列。该序列测序后共有1 430个有效碱基,将其提交到ezbiocloud数据库后下载与之相近的模式菌株并建构建系统发育树后发现该菌属于希瓦氏菌属,与腐败希瓦菌(S. putrefaciens LMG 26268(T))相似度最高,达到99.37%,与希瓦氏菌属内其他种以及相邻属的进化距离,见图 5,分支节点上的数值表示1 000次重复的步长值。
|
| 图 5 “其红”菌株16S rDNA序列NJ法构建的系统发育树 |
表面活性剂是一类重要的化工原料,在很多领域有着广泛的应用,而传统的化学表面活性剂是以石油为原料合成的,有诸多缺陷,因此需要找一些其他的表面活性剂替代传统的化学表面活性剂。随着近几十年生物技术的飞速发展,由微生物产生的一类生物表面活性剂具有很多优良的性能。例如,表面张力和界面张力低,乳化活性高,专一性强,具有特殊的生理功能,生产过程产生的有毒副产物少,具有生物可降解性,在生产、使用的过程对环境的污染和破坏很小等优良特性。鼠李糖脂是一种典型的生物表面活性剂,筛选可以产鼠李糖脂的微生物是一个重要研究方面。
各菌的发酵液上清和鼠李糖脂标准品经硫酸-苯酚反应后全波长扫描,根据Zhang等[14]报道,若在480 nm处有吸收峰则表明有糖脂,扫描结果显示鼠李糖脂标准品的吸收峰在475 nm处,未接菌发酵液在485 nm处有吸收峰,编号为“其红”、1-1-A-1菌的吸收峰也在475 nm处,故可初步判断这两株菌产鼠李糖脂。
样品和标准品薄层色谱实验结束后可以发现“其红”菌样品与鼠李糖脂标准品在相同的位置都有一个棕色斑点,其他菌样品没有发现明显的棕色斑点。据Zhang等报道[17],有棕色斑点的可认为是糖脂。在薄层色谱分析过程中,硅胶板和展开剂对不同结构物质的吸附能力不同,最终体现在样品迁移率的不同上,“其红”菌样品的迁移率为54%。鼠李糖脂标准品的迁移率为53%,两者的迁移率接近,仅差1%,表明两者的结构相似。而且在乳化实验和排油性实验中,“其红”这株菌均检测到了相应的特征。综合起来可以认为这两者属于同一类物质,即“其红”菌的发酵液中含有鼠李糖脂。
自1949年Jarvis和Johnson[9]首次发现铜绿假单胞菌(Pseudomonas aeruginosa)可以产鼠李糖脂以来,随着生物技术的不断发展,越来越多的微生物被报道可以产鼠李糖脂。在Pseudomonas属中有:P.fluorescens[18]、P.chlororaphis[19]、P.nitroreducens[20]等;在Burkholderia属中有B.pseudomallei[21]、B.pl-antarii[22]、B.thailandensis[23]等。除了在Pseudom-onas和Burkholderia这两大属中有较多种类的微生物可以产鼠李糖脂外,Enterobacter asburiae、Enteroba-cter hormaechei、Acinetobacter calcoaceticus、Pantoea stewartii[24]以及革兰氏阳性菌Renibacterium salmon-inarum[25]、Tetragenococcus koreensis[26]和真菌Aspe-rgillus sp MSF1[27]等微生物也可以产生鼠李糖脂。我们从沼气池和油田附近的土壤中筛选得到了一株与腐败希瓦菌[S. putrefaciens LMG 26268(T)]相似度最高的一株菌,该菌发酵液上清的乳化指数可以达到58.97%,与目前最典型、研究最深入铜绿假单胞菌的乳化指数(90%以上[28])还有一些差异,不过对碳源、温度等培养条件进行优化,应该能够提高它的乳化效果。据我们了解希瓦氏属中,几乎没有产鼠李糖脂菌的报道,所以本研究可能是首次报道希瓦氏菌属可以产生鼠李糖脂,增加了一种可以产鼠李糖脂的新菌属。
4 结论本研究从油田、沼气池旁的土壤中分离纯化出了25株菌,其中5株菌的发酵液具有明显的乳化效果,“其红”菌的乳化指数可达58.97%;6株菌具有明显的排油性,1株菌排油圈直径可达3.53 cm;硫酸-苯酚反应发现有2株菌产鼠李糖脂;薄层色谱实验证实了“其红”菌产鼠李糖脂。在4个实验中,“其红”这株菌都检测到了鼠李糖脂,故确认这株菌产鼠李糖脂。16S rDNA序列分析后发现这株菌属于希瓦氏菌属,与腐败希瓦菌相似性最高。
| [1] | Mulligan CN, Yong RN, Gibbs BF. Surfactant-enhanced remediation of contaminated soil:A review. Engineering Geology, 2001, 60 (1-4): 371–380. DOI:10.1016/S0013-7952(00)00117-4 |
| [2] | Desai JD, Banat IM. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews, 1997, 61 (1): 47–64. |
| [3] | Chen J, Song X, Zhang H, et al. Sophorolipid produced from the new yeast strain wickerhamiella domercqiae induces apoptosis in h7402 human liver cancer cells. Applied Microbiology and Biotechnology, 2006, 72 (1): 52–59. DOI:10.1007/s00253-005-0243-z |
| [4] | Rocha C, San-Blas F, San-Blas G, et al. Biosurfactant production by two isolates of Pseudomonas aeruginosa. World Journal of Microbiology and Biotechnology, 1992, 8 (2): 125–128. DOI:10.1007/BF01195830 |
| [5] | Edwards KR, Lepo JE, Lewis MA. Toxicity comparison of biosurfactants and synthetic surfactants used in oil spill remediation to two estuarine species. Marine Pollution Bulletin, 2003, 46 (10): 1309–1316. DOI:10.1016/S0025-326X(03)00238-8 |
| [6] | Mukherjee S, Das P, Sen R. Towards commercial production of micr-obial surfactants. TRENDS in Biotechnology, 2006, 24 (11): 509–515. DOI:10.1016/j.tibtech.2006.09.005 |
| [7] | Rodrigues L, Banat IM, Teixeira J, et al. Biosurfactants:Potential applications in medicine. Journal of Antimicrobial Chemotherapy, 2006, 57 (4): 609–618. DOI:10.1093/jac/dkl024 |
| [8] | Maier RM, Soberon-Chavez G. Pseudomonas aeruginosa rhamnolipids:Biosynthesis and potential applications. Appl Microbiol Biotechnol, 2000, 54 (5): 625–33. DOI:10.1007/s002530000443 |
| [9] | Jarvis FG, Johnson MJ. A glyco-lipide produced by Pseudomonas aeruginosa. Journal of the American Chemical Society, 1949, 71 (12): 4124–4126. DOI:10.1021/ja01180a073 |
| [10] | 范宗忠, 崔永星, 孙洪兴. 高产鼠李糖菌株的筛选及发酵条件的研究. 药物生物技术, 2003(1): 22–24. |
| [11] | 张晓刚, 刘颖, 金亚杰, 等. 提高采收率的挑战及策略. 国外油田工程, 2007(1): 4–9. |
| [12] | 李华斌, 杨振宇, 杨林, 等. 大庆油田鼠李糖脂生物表面活性剂提高采收率. 西南石油学院学报, 2001(1): 25–28. |
| [13] | Potvin E, Sanschagrin F, Levesque RC. Sigma factors in Pseudom-onas aeruginosa. FEMS Microbiol Rev, 2008, 32 (1): 38–55. DOI:10.1111/j.1574-6976.2007.00092.x |
| [14] | Zhang XS, Xu DJ, Yang GC, et al. Isolation and characterization of rhamnolipid producing Pseudomonas aeruginosa strains from waste edible oils. African Journal of Microbiology Research, 2012, 6 (7): 1466–1471. DOI:10.5897/AJMR |
| [15] | Sawant SS, Salunke BK, Kim BS. A laboratory case study of efficient polyhydoxyalkonates production by Bacillus cereus, a contaminant in saccharophagus degradans atcc 43961 in minimal sea salt media. Current Microbiology, 2014, 69 (6): 832–838. DOI:10.1007/s00284-014-0664-y |
| [16] | Yezza A, Fournier D, Halasz A, et al. Production of polyhydroxyalk-anoates from methanol by a new methylotrophic bacterium Methyl-obacterium sp. gw2. Applied Microbiology and Biotechnology, 2006, 73 (1): 211–218. DOI:10.1007/s00253-006-0458-7 |
| [17] | Zhang XS, Li M, Xiang TS. Genetic modification of meor bacterium Bacillus licheniformis h strain by low energy ion beam irradiation. Open Biotechnology Journal, 2010, 4 : 14–17. DOI:10.2174/1874070701004010014 |
| [18] | Evgenia VT, Galabova D, Stoimenova E, et al. Production and properties of biosurfactants from a newly isolated Pseudomonas fluorescens hw-6 growing on hexadecane. Zeitschrift Fur Naturforschung C-a Journal of Biosciences, 2006, 61 (7-8): 553–559. |
| [19] | Gunther NW, Nunez A, Fett W, et al. Production of rhamnolipids by Pseudomonas chlororaphis, a nonpathogenic bacterium. Applied and Environmental Microbiology, 2005, 71 (5): 2288–2293. DOI:10.1128/AEM.71.5.2288-2293.2005 |
| [20] | Onwosi CO, Odibo FJC. Effects of carbon and nitrogen sources on rhamnolipid biosurfactant production by Pseudomonas nitroreducens isolated from soil. World Journal of Microbiology & Biotechnology, 2012, 28 (3): 937–942. |
| [21] | Haussler S, Nimtz M, Domke T, et al. Purification and characteriza-tion of a cytotoxic exolipid of Burkholderia pseudomallei. Infection and Immunity, 1998, 66 (4): 1588–1593. |
| [22] | Hoermann B, Mueller MM, Syldatk Christoph, et al. Rhamnolipid production by Burkholderia plantarii dsm 9509(t). European Journal of Lipid Science and Technology, 2010, 112 (6): 674–680. DOI:10.1002/ejlt.v112:6 |
| [23] | Dubeau D, Deziel E, Woods DE, et al. Burkholderia thailandensis harbors two identical rhl gene clusters responsible for the biosynthesis of rhamnolipids. Bmc Microbiology, 2009, 9 : 263. DOI:10.1186/1471-2180-9-263 |
| [24] | Rooney AP, Price NPJ, Ray KJ, et al. Isolation and characterization of rhamnolipid-producing bacterial strains from a biodiesel facility. Fems Microbiology Letters, 2009, 295 (1): 82–87. DOI:10.1111/fml.2009.295.issue-1 |
| [25] | Christova N, Tuleva B, Lalchev Z, et al. Rhamnolipid biosurfactants produced by renibacterium salmoninarum 27bn during growth on n-hexadecane. Zeitschrift Fur Naturforschung C-a Journal of Biosciences, 2004, 59 (1-2): 70–74. |
| [26] | Lee M, Kim MK, Vancanneyt M, et al. Tetragenococcus koreensis sp nov., a novel rhamnolipid-producing bacterium. International Journal of Systematic and Evolutionary Microbiology, 2005, 55 : 1409–1413. DOI:10.1099/ijs.0.63448-0 |
| [27] | Kiran GS, Thajuddin N, Hema TA, et al. Optimization and characterization of rhamnolipid biosurfactant from sponge associated marine fungi Aspergillus sp msf1. Desalination and Water Treatment, 2010, 24 (1-3): 257–265. DOI:10.5004/dwt.2010.1569 |
| [28] | 张翠坤, 常冬妹, 杨洪江. 铜绿假单胞菌高产鼠李糖脂菌株的筛选. 生物技术通报, 2015(10): 177–183. |




