苏云金芽胞杆菌(Bacillus thuringiensis,Bt)是一种能够产生多种杀虫晶体蛋白(Cry)的土壤细菌[1, 2],其形成芽胞的过程中,形成一个或多个伴胞晶体(parasporal crystal)。大多数这种伴胞晶体具有杀虫活性,所以又称杀虫晶体蛋白(ICPs)或δ-内毒素(δ-endotoxin)。该菌具有高效、对人畜和环境安全且对标靶寄主特异性强的特点,是化学杀虫剂的重要替代品之一[3],已成为目前世界上开发产量最大、时间最长、应用最广的生物杀虫剂,总占生物杀虫剂量的90%以上,已有60多个国家登记了120多个品种,期间取得了巨大的经济、生态和社会效益[4]。Bt蛋白杀虫活性对非靶标生物无害,因此被制成生物杀虫剂广泛地应用于农业、林业以及卫生害虫的防治[5, 6]。Bt的cry基因已成功转入很多主要农作物包括玉米、棉花、番茄等,使它们具有抗虫特性[7-10]。原理是因为Cry晶体溶解后,原毒素由昆虫中肠蛋白酶降解成约60 kD、具有蛋白酶抗性的活性毒素[11],而多数鳞翅目昆虫中肠的蛋白酶为胰蛋白酶类[11]或胰凝乳蛋白酶类[12]。所以,原毒素的激活过程与杀虫特异性有一定的关系。如Cry1Ab7用鳞翅目昆虫的中肠液激活后对鳞翅目昆虫表现出活性;蚊子的中肠液激活,则对双翅目昆虫表现出杀虫活性[13]。有发现Cry1类杀虫晶体蛋白对鳞翅目害虫具有特异毒性,在微生物和植物基因工程中得到了广泛的应用,但其存在着杀虫谱狭窄、昆虫产生抗药性等问题[14, 15]。而Cry2类蛋白在结构和杀虫机制方面不同于Cry1类,如Cry2Aa既对鳞翅目害虫有毒性又能杀害双翅目害虫[16]。
有研究发现cry2类基因可以编码对鳞翅目害虫有活性的毒素蛋白,Cry2A毒素蛋白的大小约65-70 kD,其杀虫活性范围宽。Cry2Aa[17]、Cry2Ag[18]对鳞翅目和双翅目的幼虫都有有毒性。而已报道Cry2Ab[17]和Cry2Ac[19]只对鳞翅目有毒性。此外,还报道了Cry1A不与Cry2A分享膜上的结合位点[20],因此,新分离的蛋白具有不同的序列,具有更高的毒性和更广泛的杀害虫范围。目前的研究表明,Cry2Al1有广阔的杀虫活性,对斜纹夜蛾(LC50= 2.448 µg/mL)和棉铃虫(LC50= 3.374 µg/mL)都有一定的杀虫活性。据报道,Cry2Aa14蛋白对斜纹夜蛾的杀虫活性LC50为694 ng/cm2和122 ng/cm3[21],而且Cry2Aa蛋白有71.4%的杀虫死亡率和浓度在81%-99%时,有严重体重抑制作用,进行1周杀虫活性测定,对棉铃虫的幼虫体重抑制作用为2.3 µg/µL[22]。据相关的研究表明Cry2Ab毒素蛋白基因单独转化植物表达载体PSR784d,为进一步转化植物和研究其单价转基因植物的抗虫性奠定了基础[23]。Cry2Ab,Cry2Ae,Cry2Af蛋白仅对鳞翅目害虫有活性,其中Cry2Ab蛋白对棉铃虫(Helicoverpa armigera)、大豆食心虫(Leguminivora glycinivorella)、小菜蛾(Plutella xylostella)和水稻二化螟(Chilo suppressalis)等鳞翅目害虫具有高毒力[24]。基于以上研究背景,本研究采用分离Bt菌株进行高活性的筛选与基因鉴定的方法,来发掘对小菜蛾和棉铃虫具有高效杀虫活性的菌株,为解决农业害虫的防治提供了新的微生物资源。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒BtBJH500菌株由本实验室分离得到,表达菌株E. coli BL21与载体pEB由本实验室自己保存。
1.1.2 培养基液体LB培养基:胰蛋白胨5 g、酵母提取物2.5 g、氯化钠5 g、蒸馏水500 mL、pH7.0,121℃高温高压灭菌20 min。固体LB培养基:在液体LB培养基中加13 g/L的琼脂。固体1/2LB培养基:胰蛋白胨5 g、酵母提取物2.5 g、氯化钠5 g、琼脂13 g、蒸馏水1 000 mL,pH7.0,121℃高温高压灭菌20 min。
KOD酶、Taq DNA聚合酶、pMD19-T Simple Vector、Amp、X-Gal、IPTG、DNA Marker、蛋白质分子量标准均购自TaKaRa公司。质粒DNA提取试剂盒、胶回收试剂盒购自美国Axygen公司。引物由金维智生物有限公司(北京)有限公司合成。分析纯化学试剂均为市售。
小菜蛾和棉铃虫为科云生物有限公司(河南)所提供的标准化试虫。
1.2 方法 1.2.1 土样来源及Bt菌株的分离土样采自于中国海南地区,采用温度法进行Bt菌株的筛选[25]。
1.2.2 晶体形态观察将Bt菌株BJH500在1/2LB培养基上培养48 h后,将胞晶混合液滴于载玻片上,涂抹均匀,烘干固定,石炭酸复红染液染色3 min,清水冲洗,100×油镜进行镜检[26]。
1.2.3 Bt基因组的提取分离纯化后的Bt菌在固体LB培养基上30℃过夜培养12 h,采用张彦蕊等[27]的方法提取基因组。
1.2.4 cry2Ab基因的克隆和测序将提取基因组DNA,使用引物上游序列(5' -ATGAATAGTGTATTGAATAGCGGAA-3' )和下游序列(5' -TTAATAAAGTGGTGAAATATTAGTT-3' )扩增cry2Ab34基因,引物设计基于cry2Ab的全长序列。PCR扩增时使用KOD高保真酶,PCR反应程序:94℃ 3 min;94℃ 30 s,51.9℃ 30 s,68℃ 2 min,30个循环;最后68℃延伸10 min。扩增产物的回收纯化参照Axygen公司的胶回收试剂盒说明书进行。将回收的PCR产物分别连接pMD19-T Simple Vector克隆载体和pEB表达载体并转入E. coli BL21中[28],筛选阳性克隆进行PCR验证,以便确认其是否连有目的片段。提取连接正确的重组细菌的质粒送至吉林省库美生物科技有限公司进行测序。
1.2.5 基因诱导表达及SDS-PAGE分析诱导表达重组的大肠杆菌菌株,诱导条件为:IPTG 1 mg/mL,16℃,160 r/min,震荡培养12 h。将诱导好的培养液在8 000 r/min的条件下离心5 min并收集菌体,之后用预冷的20 mmol/L Tris-HCl(pH8.0)悬浮菌体洗两次。最后用5 mL 20 mmol/L Tris-HCl(pH8.0)悬浮菌体,并在冰水混合物中超声波破碎菌体,超声时工作3 s,间歇3 s,将破碎完全的菌液离心取上清和沉淀以备实验用[29]。
1.2.6 蛋白浓度的测定参照蛋白定量试剂盒的使用手册,以牛血清蛋白(BSA)为标准蛋白制作蛋白浓度标准曲线,进而测定上述参与蛋白SDS-PAGE定量分析的目的蛋白的浓度。再结合ImageMaster VDS软件对目的蛋白所占比例的分析结果,计算出目的蛋白的浓度。
1.2.7 室内生物活性的测定小菜蛾:量取10 mL待测蛋白溶液加入灭菌的50 mL离心管中,加入0.1%家用洗涤剂,充分混合均匀;选取新鲜的甘蓝叶片,均匀地浸入上述待测样品溶液中,浸泡20 s左右,使其表面完全沾湿。将毛笔用70%的乙醇处理后,再用无菌水冲洗,然后用毛笔轻轻的接入20头幼虫放入每个培养皿中,每个浓度梯度设3个重复,盖紧防止幼虫逃逸。放置25℃光照培养箱中进行培养,用光周期为16:8,在培养箱中放置一水盆以调节湿度,进行每天观察,24、48、72 h后调查死、活虫数,计算死亡率。
棉铃虫:称10 g人工饲料置于灭菌培养皿中,加入2 mL待测样品稀释液,充分与饲料搅拌混匀,放入室温中,用毛笔分装于培养板中,接入生理状况一致的棉铃虫初孵幼虫,每个接20头,每个处理3个重复,用Tris-HCl处理饲料作为对照,置于26℃光照培养箱中保持其适当湿度,培养7 d后调查死、活虫数,并检测幼虫取食情况。
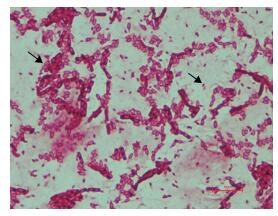
2 结果 2.1 晶体形态观察Bt BJH500菌株产生的晶体形态,在光学显微镜(图 1)下箭头所示,从左到右依次为芽胞和晶体。
|
| 图 1 光学显微镜下Bt BJH500的晶体形态 |
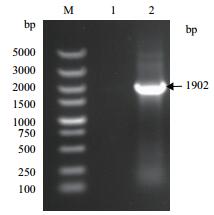
PCR扩增结果(图 2)所示,将测序结果提交到GenBank,获得登录号为KX357382。该基因序列已被国际Bt基因命名委员会正式命名为cry2Ab34。cry2Ab34序列全长为1 902 bp,编码633个氨基酸残基。cry2Ab34与其他来源于GenBank报道的Bt cry2Ab34基因有99%的相似度。
|
| 图 2 cry2Ab34全长基因扩增结果 M:Marke 1:阴性对照2:cry2Ab |
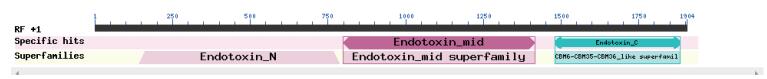
由DNA序列推导的氨基酸序列结果,Cry2Ab34蛋白由633个氨基酸组成,相对分子质量为158 921.4。其中亮氨酸Leu(L)、天冬酰胺Asn(N)、丝氨酸Ser(S)、苏氨酸Thr(T)较多,分别为10.3%、11.4%、9.0%和8.2%。该蛋白等电点pH 5.01,为弱酸性蛋白。通过NCBI Conserved Domain对cry2Ab34基因分析结果(图 3)所示,该基因所编码的蛋白的Domain I由N端第142-786位共644个氨基酸组成,Domain Ⅱ由第799-1 416位,共617个氨基酸组成,Domain Ⅲ由第1 480-1 884位,共404个氨基酸组成。故Cry2Ab34蛋白的活性区域估计在N端的142-1 884个氨基酸附近。Cry2家族含有芽胞杆菌产生的杀虫毒素,在芽胞形成过程中会产生晶体蛋白,其蛋白质的N末端和C末端的延伸部分会裂解出一些成分,一旦激活内毒素结合到肠上皮细胞会导致细胞裂解死亡。该激活区域δ-内毒素是由3个结构域,N末端的螺旋结构区域插入膜的孔隙形成过程中,第2个和第3个区域参与受体结合,结合到昆虫特异性受体的肠道上皮细胞中。
|
| 图 3 Cry2Ab34蛋白的保守结构域分析 |
对cry2Ab34基因进行诱导表达,提取蛋白并进行SDS-PAGE电泳检测。结果(图 4)显示,表达产物的大小约70 kD。以空质粒pEB转入E.coli BL21菌株作为阴性对照,未发现70 kD的蛋白,说明在大肠杆菌中成功表达Cry2Ab34蛋白。
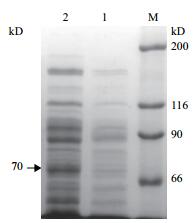
|
| 图 4 Cry2Ab34表达蛋白SDS-PAGE电泳 M:高分子量Marker;1:pEB空载体组分;2:表达蛋白Cry2Ab34 |
对在大肠杆菌中表达的Cry2Ab34蛋白进行对鳞翅目昆虫小菜蛾幼虫和棉铃虫幼虫的杀虫活性测定。利用20 mmol/L Tris-Cl溶液作为阴性对照,结果显示对小菜蛾和棉铃虫都有一定的毒力。表达活性蛋白对鳞翅目害虫小菜蛾生测的校正死亡率为10 µg/mL为31.25 %,100 µg/mL为62.5 %。棉铃虫的校正死亡率为10 µg/mL为29.4%,100 µg/mL为52.9%(表 1)。
目前,对Bt新基因的发掘是我国的重点研究项目,并多年致力于研发转基因植物,因此充分发掘Bt菌株新基因资源是一项重要工作。由于土壤成分、酸碱性、含水量和植被分布情况不同,对苏云金芽胞杆菌在土壤中的分布都存在影响,其沙壤中匮乏营养物质会限制Bt的生存,与之相反,植被覆盖率高、营养丰富的土壤则有利于Bt分布。此外,Bt的分布也受气候的影响,热带、亚热带土壤Bt分布[30]。苏云金芽胞杆菌(Bt)菌株可以从不同的栖息地区分离出来,得到的Bt cry基因表达的蛋白有着不同的毒力和杀虫谱[31],因此其成功的应用于生物杀虫剂中。但随着Bt基因在抗虫转基因植物中应用的不断扩大,Bt抗虫基因在农田应用过程中毒性不强、杀虫谱窄、持效期不长、害虫易产生抗药性等问题逐渐显现[32],cry基因编码的晶体蛋白均在不同程度上引起昆虫抗药性的产生[33]。本研究克隆了cry2Ab基因,该基因表达的Cry2Ab34蛋白是对小菜蛾有一定杀虫活性的毒素蛋白。对Cry2Ab34蛋白生物信息学分析,其中亮氨酸Leu(L)、天冬酰胺Asn(N)、丝氨酸Ser S)、苏氨酸Thr(T)较多,分别为10.3%、11.4%、9.0%和8.2%。可能是与Cry2Ab34蛋白的活性有相关性。对Cry2Ab34蛋白的跨膜区域分析发现,亲水域与疏水域是相互交替的。Cry2Ab34蛋白保守结构域分析,其中含有3个结构域。Bt菌株和产品数量还相对较少,还需深入研究其杀虫分子机理,同时扩大其杀虫谱测定,尤其是对不同鳞翅目害虫的毒性筛选,并进行田间防治剂型及应用方式的研究,将其应用到实践中。
有研究从玉米田中筛选出cry2+cry9复合基因型,对其进行生物学特性研究及分子鉴定,发现其对3种不同供试鳞翅目害虫幼虫的毒力差异显著,仅对亚洲玉米螟幼虫具有高毒力,对黏虫和斜纹夜蛾幼虫毒力不明显[34],而本研究中的实验菌株BJH500含有一种新的cry2基因,其对鳞翅目害虫的高毒力因素还需对其基因进行克隆、表达研究来进一步阐明。下一步工作需要对其基因进行更深入的研究,来确定其基因表达特性。苏云金芽胞杆菌的杀虫活性主要取决于其晶体蛋白的种类,而在蛋白序列中N端序列决定其杀虫活性的多样性[35]。研究发现的Cry2A新毒素蛋白与已知的晶体蛋白序列的不同主要位于其N端中,可能会导致其杀虫活性和杀虫谱的变化。在以往研究中,Cry2A毒素蛋白对鳞翅目、双翅目多种害虫具有杀虫活性[36]。因此,在今后研究过程中可以当增加生测试虫的范围,以扩大杀虫谱,为基因工程提供有益的基因资源,为生物制剂的开发提供研究材料。
4 结论本研究从Bt BJH500菌株中克隆得到cry2Ab34基因,基因序列全长为1 902 bp,编码633个氨基酸残基,分子量约为70 kD,GenBank登录号为KX357382。该基因序列已被国际Bt基因命名委员会正式命名为cry2Ab34,将该基因在大肠杆菌E.coli BL21中表达,表达的Cry2Ab34蛋白对鳞翅目小菜蛾和棉铃虫具有一定的杀虫活性,且浓度越大,杀虫活性越高。
| [1] | Ladics GS, Bardina L, Cressman RF, et al. Lack of cross-reactivity between the Bacillus thuringiensis derived protein Cry1F in maize grain and dust mite Der P7 protein with human sera positive for der p7-ige. Regul Toxicol Pharmacol, 2006, 44 (2): 136–143. DOI:10.1016/j.yrtph.2005.11.005 |
| [2] | Ibargutxi MA, Estela A, Ferr J, et al. Use of Bacillus thuringiensis toxins for control of the cotton pest Earias insulana(Boisd.)(Lepidoptera:Noctuidae). Applied and Environmental Microbiology, 2006, 72 (1): 437–442. DOI:10.1128/AEM.72.1.437-442.2006 |
| [3] | Bravo A, Gómez I, Porta H, et al. Evolution of Bacillus thuringiensis Cry toxins insecticidal activity. Microbial Biotechnology, 2013, 6 (1): 17–26. DOI:10.1111/j.1751-7915.2012.00342.x |
| [4] | Bravo A, Likitvivatanavong S, Gill SS, Soberón M. Bacillus thuringiensis:a story of a successful bioinsecticide. Insect Bio-chemistry and Molecular Biology, 2011, 41 (7): 423–431. DOI:10.1016/j.ibmb.2011.02.006 |
| [5] | Schnepf E, Crickmore N, Van RIE J, et al. Bacillus thuringiensis and its pesticidal crystal proteins. Microbiol MolBiol R, 1998, 62 (3): 775–806. |
| [6] | Bravo A, GIll SS, Sober NM. Mode of action of Bacillus thuringiensis Cry and Cyt toxins and their potential for insectcontrol. Toxicon, 2007, 49 (4): 423–435. DOI:10.1016/j.toxicon.2006.11.022 |
| [7] | Cajendra Babu B, Udayasuriyan V, Asia Mariamm M, et al. Comparative toxicity of Cry1Ac and Cry2Aa δ-endotoxins of Bacuillus thuringiensis against Helicoverpa armigera(H.). Crop Protection, 2002, 21 (9): 817–822. DOI:10.1016/S0261-2194(02)00044-3 |
| [8] | Schnepf HE, Whiteley HR. Cloning and expression of the Bacillus thuringiensis crystal protein gene in Escherichia coil. Proc Nati Acad Sci, 1981, 78 (10): 2893–2897. |
| [9] | Crickmore N, Zelgler DR, Feitelson J, et al. Revision of the nomenclature for the Bacillus thuringiensis pesticidal crystal proteins. Microbiol Mol Biol Revi, 1998, 62 (3): 807–813. |
| [10] | Chen M, Sheltin A, Ye GY. Insect-resistant genetically modified rice in china:From research to commercialization. Annual Review of Entomology, 2001, 56 : 81–101. |
| [11] | Lecadet MM, Dedonder R. Enzymatic hydrolysis of the crystals of Bacillus thuringiensis by the proteases of Pieris brassicae. I. Preparation and fractionation of the lysates. Journal of Invertebrate Pathology, 1967, 9 : 310–321. DOI:10.1016/0022-2011(67)90065-1 |
| [12] | Johnston KA, Lee MJ, Brough C, et al. Protease activities in the larval midgut of Heliothis virescens:Evidence for trypsin and chymotrypsin-like enzymes. Insect Biochemistry and Molecular Biology, 1995, 25 : 375–383. DOI:10.1016/0965-1748(94)00077-U |
| [13] | Haider MZ, Ellar DJ. Functional mapping of an entomocidal endotoxin:single amino acid changes produced by site-directed mutagenesis influence toxicity and specificity of the protein. Journal of Molecular Biology, 1989, 208 : 183–194. DOI:10.1016/0022-2836(89)90094-6 |
| [14] | Zhang YJ, Li YH, Zhang Y, et al. Seasonal expression of Cry1Ab and Cry1Ac proteins in transgenic rice lines and their resistance striped rice borer Chilo suppressalis(Walker). Transgenic Plants & Insects, 2011, 40 (5): 1323–1330. |
| [15] | Akhurst RJ, James W, Bird LJ, et al. Resistance to the Cry1Ac dalta-endotoxin of Bacillus thuringiensis in the cotton bollworm, Helicoverpa armigera(Lepidoptera; Noctuidae). Joumal of Economic Entomology, 2003, 96 (4): 1290–1299. |
| [16] | Park HW, Devera JA, Prins BA, et al. The dual-activity insecticidal protein, Cry2Aa, does not enhance the mosquitocidal activity of Bacillus thuringiensis subsp. Israelensis. Journal of Asia-Pacific Entomology, 2011, 14 (4): 429–431. DOI:10.1016/j.aspen.2011.05.007 |
| [17] | Winder WR, Whiteley HR. Two highly related crystal proteins of Bacillus thuringiensis serovar kurstaki possess different host range specificities. J Bacteriol, 1989, 171 : 965–974. DOI:10.1128/jb.171.2.965-974.1989 |
| [18] | Zheng A, Zhu J, Tan F, et al. Characterisation and expression of a novel haplotype cry2A-type gene from Bacillus thuringiensis strain JF19-2. Ann Microbiol, 2010, 60 : 129–134. DOI:10.1007/s13213-009-0011-x |
| [19] | Wu D, Cao XL, Bai Y, et al. Sequencing of an operon containing a novel d-endotoxin gene from Bacillus thuringiensis. FEMS Microbiol Lett, 1991, 81 (1): 31–35. |
| [20] | Karim S, Dean DH. Toxicity and receptor binding properties of Bacillus thuringiensis d-endotoxins to the midgut brush border mem-brane vesicles of the rice leaf folders. Cnaphalocrocis medinalis and Marasmia patnalis. Curr Microbiol, 2000, 41 (4): 276–283. DOI:10.1007/s002840010134 |
| [21] | Hire RS, Makde RD, Dongre TK, D'souza SF. Expression, purifica-tion and characterization of the Cry2Aa14 toxin from Bacillus thu-ringiensis subsp. Kenyae Toxicon, 2009, 54 (4): 519–524. DOI:10.1016/j.toxicon.2009.05.022 |
| [22] | Lenin K, Mariam MA, Udayasuriyan V. Expression of a cry2Aa gene in an acrystalliferous Bacillus thuringiensis strain and toxicity of Cry2Aa against Helicoverpa armigera. World J Microbiol Biotechnol, 2001, 17 : 273–278. DOI:10.1023/A:1016674417728 |
| [23] | 王毛, 吴亚飞, 邓拓, 等. 苏云金芽孢杆菌Cry2Ab基因克隆与植物表达载体的构建. 西北林学院学报, 2016, 31(5): 178–181. |
| [24] | 李长友, 张杰, 宋福平, 等. 苏云金芽孢杆菌B-Pr-88菌株中cry2Ab4基因的表达和杀虫活性研究. 生物工程学报, 2007, 23(4): 634–638. |
| [25] | 喻子牛. 苏云金芽胞杆菌[M]. 北京: 科学出版社, 1990: 305-323. |
| [26] | Baroy F, Lecadet MM, Deleluse A. Cloning and sequencing of three new putative toxin genes from Clostridium bifermentans. Gene, 1998, 211 (2): 293–299. DOI:10.1016/S0378-1119(98)00122-X |
| [27] | 张彦蕊, 束长龙, 宋福平, 等. 一种简单、快速的苏云金芽胞杆菌基因组DNA提取方法. 生物技术通报, 2012(11): 197–201. |
| [28] | 宋福平, 张杰, 黄大昉, 等. 苏云金芽胞杆菌cry基因PCR-RFLP鉴定体系的建立. 中国农业科学, 1998, 31(3): 13–18. |
| [29] | 刘东明. 苏云金芽胞杆菌新型cry1基因克隆, 表达及活性分析[D]. 哈尔滨: 东北农业大学, 2011. |
| [30] | 王志鑫, 束长龙, 申培立, 等. 含cry8型基因苏云金芽胞杆菌的分离和鉴定. 华北农学报, 2014, 29(6): 149–154. DOI:10.7668/hbnxb.2014.06.026 |
| [31] | 蔡亚君, 袁志明, 胡晓敏, 蔡全信. 苏云金芽胞杆菌几丁质酶基因的克隆及诱导表达. 湖北农业科学, 2011, 50: 63–66. |
| [32] | 王继磊, 刘迪秋, 丁元明, 等. Bt转基因抗虫植物研究进展. 生物学杂志, 2010, 27(4): 75–78. |
| [33] | 宋敏, 林祥明, 刘丽军. Cry基因家族的专利分布研究. 生物技术通报, 2010(21): 86–99. |
| [34] | 孟鑫睿, 路杨, 刘艳微, 等. 苏云金芽胞杆菌一新菌株的鉴定及其杀虫活性. 植物保护学报, 2015, 42(3): 410–417. |
| [35] | 邵宗泽, 喻子牛. 苏云金芽胞杆菌杀虫晶体蛋白作用的分子机制研究进展. 生物工程进展, 2001, 21(6): 38–41. |
| [36] | 李海涛, 姚江, 郭巍, 等. 苏云金芽孢杆菌cry2Aa基因的克隆、表达与活性. 农业生物技术学报, 2005, 6: 787–791. DOI:10.3969/j.issn.1674-7968.2005.06.020 |