2. 中国农业科学院植物保护研究所,北京 100193
2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193
利用细菌生产重组蛋白方便快捷,然而,常用的细菌表达系统如大肠杆菌(Escherichia coli)、荧光假单胞菌(Pseudomonas fluorescens)等不易将外源可溶性蛋白质产物直接分泌到培养基中,这不仅限制了产量,还增加了下游加工的时间和金钱成本[1]。此外,大肠杆菌的外膜中存在内毒素脂多糖(Lipopolysaccharide,LPS)[2],会引起发热和休克,且从重组蛋白中除去细菌外毒素难度大,经济成本高,产品安全性低。因而内毒素脂多糖的存在,限制了大肠杆菌在制药、食品等领域的应用[3-5]。一些芽胞杆菌(Bacillus)具有生长速度快、分泌能力强、安全等优点,已被广泛应用于科研、制药、工业、农业等领域[6]。近年来,利用芽胞杆菌,尤其是枯草芽胞杆菌(Bacillus subtilis,Bs)来分泌表达外源蛋白已经取得了很多可喜的成就[7, 8],特别是用来产生一些有价值的酶类,如甲基对硫磷水解酶(Methyl parathion hydrolase,MPH)[9]、木聚糖水解酶(Xylanase)[10]、琼胶酶(β-agarose)[11]、纤维素内切酶(Cellulase)[12]、植酸酶(Phytase)[13]、甘露聚糖酶(β-mannanase)[14]、脂氧合酶(Lipoxygenase)[15]、聚半乳糖醛酸盐裂解酶(Polygalacturonate lyase,PGL)[16]等。但遇到一些瓶颈问题,一方面,为避免分泌途径和细胞壁合成受阻,细胞内存在一系列质量控制点;另一方面,细胞同时会产生一些蛋白水解酶,可能会降解目的蛋白[17, 18]。这二者限制了外源蛋白分泌表达的产量。然而,目前仍然没有简便统一的策略来提高外源蛋白分泌表达的产量,多数情况下需要针对不同的目标蛋白研究合适的特异的优化方法[19]。因此,开发其他安全高效的分泌表达菌株,可能有效提高目前工业上产量受限的蛋白质的产量,为分泌表达外源蛋白提供更多的候选宿主。
苏云金芽胞杆菌在产生芽胞的同时可以产生具有杀虫活性的晶体蛋白,是一种应用广泛的微生物杀虫剂[20]。Bt作为一种革兰氏阳性菌细胞壁成分简单,胞外蛋白分泌到培养基时无需穿过细胞壁外膜,是一种良好的分泌表达外源蛋白的候选宿主。李玉呈[21]在Bt_HD73中分泌表达烟草几丁质酶基因tchiB,发现发酵液上清的几丁质酶活性得到了提高。然而Bt本身分泌的蛋白水解酶可能会影响目标蛋白的产量。因此,要将Bt发展为新的分泌表达宿主,首先应对其分泌蛋白组进行研究,为后续敲除蛋白水解酶基因,构建苏云金芽胞杆菌分泌表达宿主奠定基础。Bt_HD73的全基因组测序已于2013年完成[22],为Bt分泌蛋白组的研究提供了重要依据。
本研究制备了Bt_HD73过渡期T1的胞外蛋白质样品,并进行质谱鉴定。经分析比对确定其分泌蛋白的种类和含量,并重点分析其中的蛋白水解酶。同时,利用生物信息学网站分析这些分泌蛋白,建立Sec型信号肽库。本研究旨为进一步了解苏云金芽胞杆菌分泌的胞外蛋白的情况提供了数据,对充分了解该菌与昆虫的互作机理,进一步扩大该菌的应用范围提供新思路。
1 材料与方法 1.1 材料Bacillus thuringiensis subsp. kurstaki strain HD73野生型(Bt_HD73)由本实验室保存。LB培养基相关试剂购自Oxoid公司;30%丙烯酰胺、1 mol/L Tris-HCl、1.5 mol/L Tris-HCl等SDS-PAGE胶配制试剂购自Coolaber公司;尿素购自Sigma公司;2×蛋白上样缓冲液购自艾德莱公司;电泳缓冲液相关试剂购自Amresco公司,Typsin酶购自Promega公司。
1.2 方法 1.2.1 T0的确定将过夜活化的Bt_HD73菌株1%转接于100 mL(1 L锥形瓶)新鲜LB液体培养基中,30℃、180 r/min培养,从0 h开始,每0.5 h测定OD600,绘制生长曲线,对数期与过渡期的转折点记为T0,OD600约为2.6,从接种到T0的时间约为3.5 h。T0后1h记为T1,OD600约为3.2。
1.2.2 分泌蛋白样品的制备将过夜活化的Bt_HD73菌株1%转接于100 mL新鲜LB液体培养基中,30℃、180 r/min培养至T1。离心取胞外上清,并用0.2 μm无菌滤器过滤除菌2次,60%硫酸铵沉淀4 h后,用8 mol/L尿素溶解沉淀。最后用超滤浓缩管将样品浓缩为100-200 μL。
1.2.3 分泌蛋白样品的电泳及胶内酶解将样品分别上样于两块SDS-PAGE胶,一块进行常规电泳、染色、脱色、观察;另一块SDS-PAGE胶在样品刚进入分离胶约8 min后停止电泳,根据预染蛋白Maker的指示,于15 kD和25 kD之间切胶,以除去培养基中的干扰肽段。而后将此胶块切成1 mm3左右的小块,用50%乙腈/100 mmol/L NH4HCO3(pH 8.0)浸洗3次,抽干后,将胶块浸于10 mmol/L二硫苏糖醇(DL-Dithiothreitol,DTT)/50 mmol/L NH4HCO3(pH 8.0)中,56℃温育1 h后吸去浸液,将胶块浸于55 mmol/L碘乙酰胺(Iodoacetamide,IAM)/50 mmol/L NH4HCO3(pH 8.0)中,室温下暗室温育30 min后吸去浸液,依次用10 mmol/L NH4HCO3和乙腈浸洗2次,每次10 min,真空抽干后加入适量10 ng/μL的Typsin酶,孵育至酶液被胶块吸收,加入足量10 mmol/L NH4HCO3,37℃温育过夜,加入等体积的60%乙腈/5%甲酸,超声振荡10 min,离心后收集上清,并将上清真空抽干,最终溶解于50%乙腈中,待质谱检测。
1.2.4 质谱鉴定高分辨液质联用仪配置:液相色谱体系为EASY-nLCTM 1200(Thermo,USA);质谱仪为Orbitrap Fusion Lumos(Thermo,USA,配备纳喷离子源)。
色谱条件:毛细管液相色谱柱Acclaim PepMap 100 C18(75 μm ID*25 cm,3 μm填料)(Thermo,USA);流动相A溶液为0.1%甲酸,B溶液为0.1%甲酸与100%乙腈混合溶液,所用梯度为95 min内流动相B由5%升高至22%,然后16 min内流动相B由22%升高至32%,最终5 min内由32%升至95%,整个过程在120 min内完成;流速为250 nL/min;进样体积为2 μL(1 μg)。
质谱条件:采用数据依赖性采集技术(Data-dependent acquisition);喷雾电压为2.2 kV;检测方式为正离子;质荷比(m/z)扫描范围为350-2 000。
1.2.5 蛋白质鉴定数据使用Proteome Discoverer 2.0软件搜库鉴定。搜索引擎:SEQUEST HT;数据库:HD73本地化数据库;蛋白酶:trypsin(full);最大漏切位点:1;母离子质量精度:10 ppm;子离子质量精度:0.2 Da;固定修饰:Carbamidomethyl(C + 57.021 Da);可变修饰:Deamidated(N + 0.984 Da),Oxidation(M + 15.995 Da)。搜库结果使用Percolator卡值(FDR 1%)。输出结果中,emPAI值表征蛋白的含量。
1.2.6 信号肽分析在生物信息学网站SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)中输入蛋白质序列,预测该蛋白是否含有经典的Sec型信号肽及其信号肽的长度[23]。
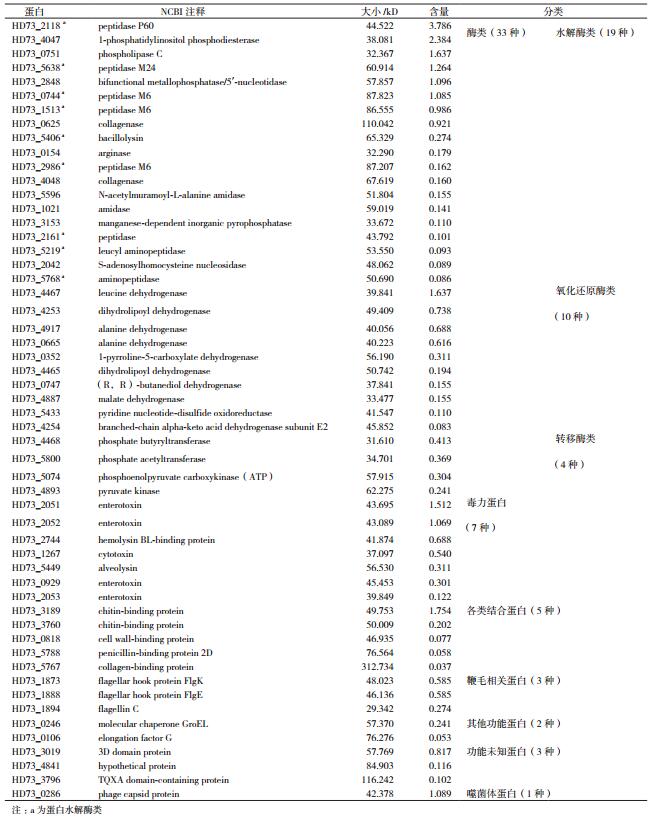
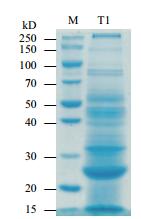
2 结果 2.1 Bt_HD73分泌蛋白质的提取、鉴定和分析制备Bt_HD73 T1时期的分泌蛋白质样品并进行电泳检测,结果(图 1)显示,Bt在T1时期可以分泌丰富的胞外蛋白质。预实验中直接对制备好的分泌蛋白质液态样品进行质谱检测,发现其中含有酪蛋白的干扰,大小约为20 kD,因而改进实验方法,采用电泳切胶方式,除去干扰肽段,而后再质谱检测,从而有效地解决了这一问题。结果(表 1)表明,共检测到54种HD73分泌蛋白。根据NCBI中的注释,将这些分泌蛋白分为7个大类,包括酶类、毒力蛋白、各类结合蛋白、鞭毛相关蛋白、噬菌体相关蛋白、其他功能蛋白及功能未知蛋白。
|
| 图 1 Bt_HD73 T1时期分泌蛋白质的SDS-PAGE电泳图 |
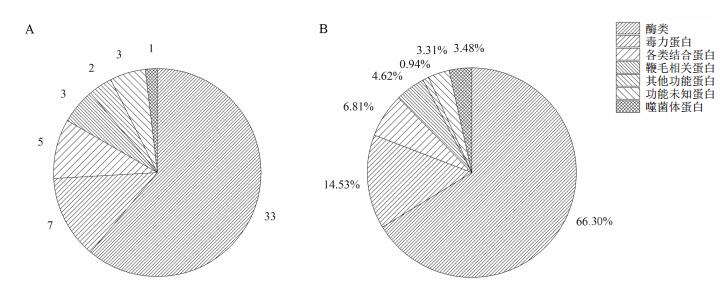
Bt_HD73 T1时期的分泌蛋白中共检测到33个酶类(图 2),含量占分泌蛋白总量的66.30%,其中包括19个水解酶类、10个氧化还原酶类及4个转移酶类,含量分别为47.06%、15.00%、4.25%;除酶类外,种类较多的为毒力蛋白,共检测到7个,含量占分泌蛋白总量的14.53%。此外,还包括5个结合蛋白、3个鞭毛相关蛋白、1个噬菌体相关蛋白、2个其他功能蛋白以及3个功能未知蛋白。
|
| 图 2 Bt_HD73 T1时期不同类型分泌蛋白的种类和含量 A:分泌蛋白的种类数;B:各类分泌蛋白的含量比例 |
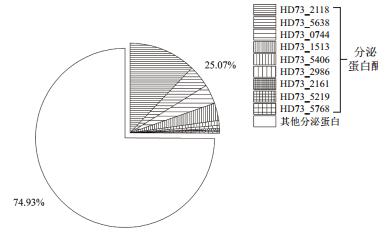
蛋白水解酶属于水解酶类,可以水解蛋白中的肽链。结果(图 3)表明,Bt_HD73 T1时期共检测到9种胞外蛋白水解酶,占所有分泌蛋白总量的25.07%、所有分泌酶类的37.82%。其中HD73_2118(peptidase P60)最多,占胞外蛋白水解酶的48.31%,HD73_5638(peptidase M24)、HD73_0744(peptidase M6)、HD73_1513(peptidase M6)次之,分别为16.13%、13.84%和12.58%。此外,HD73_5406(bacillolysin)、HD73_2986(peptidase M6)、HD73_2161(peptidase)、HD73_5219(leucyl aminopeptidase)、HD73_5768(aminopeptidase)这5种蛋白水解酶也有少量分泌。
|
| 图 3 Bt_HD73 T1时期分泌蛋白酶的含量 |
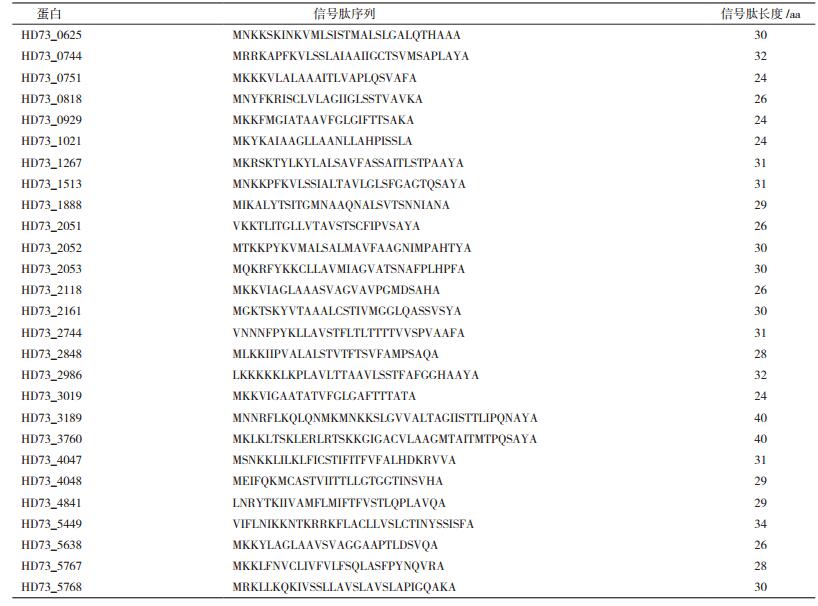
根据NCBI中Bt_HD73的蛋白质序列[22],利用SignalP 4.1分析预测所有质谱检测到的分泌蛋白,共发现27个蛋白含有经典的Sec型信号肽(表 2),其长度在24-40个氨基酸之间。
Gohar等[24]于2005年制备了Bt 407无晶体突变株在LB培养基中T2时期的胞外蛋白样品,质谱检测后以蜡样芽胞杆菌(Bacillus cereus,Bc)ATCC14579菌株的基因组数据库检索,鉴定出36个Bt胞外蛋白。本研究以Bt_HD73基因组数据库对质谱结果进行检索,检索结果更为准确,共鉴定出54个Bt胞外蛋白,其中14个蛋白与Gohar等鉴定的蛋白相似性在95%以上,其他为本研究中新检测到的蛋白,胞外蛋白种类更加丰富。此外,本研究还对胞外蛋白的含量作了进一步分析,结果表明,Bt在过渡期初期产生的胞外蛋白质中大部分为酶类,尤其是水解酶类,这可能与水解利用营养物质,以满足细菌快速生长的需求相关。
Bt细胞壁由肽聚糖和磷壁酸构成,这与大肠杆菌细胞壁有明显的差别,后者层次多且成分复杂。由于Bt没有脂多糖外膜,产物更容易分泌到培养基之中,且加工过程避免了内毒素、核酸等的污染。此外,从培养基中纯化目标产物大大降低了下游成本[25],且分泌蛋白不易形成包涵体,通常保持着生物活性形式[26]。因此,可以尝试利用Bt分泌表达外源蛋白。但是由于Bt可以分泌一些蛋白水解酶,可能造成外源蛋白的降解,因而对这类蛋白作进一步分析。结果表明,在过渡期T1时期,Bt胞外蛋白中约25%为蛋白水解酶类,其中HD73_2118最多,HD73_5638、HD73_0744、HD73_1513次之。经BLAST(http://blast.ncbi.nlm.nih.gov)分析比对,蜡样芽胞杆菌的EntFM(CwpFM)蛋白(GenBank:AAX14641.1)与HD73_2118相似性为100%,与HD73_5638相似性为46%。EntFM是一种细胞壁肽酶,含有特征性结构域NlpC/P60,与细菌运动性、形状、毒力相关,参与Bc黏附到上皮细胞和生物膜的形成过程,诱导巨噬细胞的空泡化[27]。HD73_0744和HD73_1513是M6家族的金属蛋白酶,该家族功能未知,但其特征性结构域Peptidase_M6一般存在于InhA中,InhA可以特异性地切割宿主抗菌蛋白[28, 29]。因而,HD73_0744和HD73_1513可能在侵染宿主过程中发挥一定的作用。在构建苏云金芽胞杆菌分泌表达宿主时,可敲除这些蛋白水解酶基因,尤其是要敲除编码HD73_2118和HD73_5638、HD73_0744、HD73_1513的基因,以免对目标蛋白产生降解作用,同时可减少背景蛋白的表达,更利于下游的纯化。
除酶类外,种类较丰富的还有毒力蛋白,它是细菌毒性的最直接体现。有些毒力蛋白靶向作用于细胞表面,如针对免疫系统和细胞表面分子的毒素、使细胞膜形成孔道的细胞膜破坏毒素以及杀虫毒素等;而有些毒力蛋白则靶向作用于胞内物质,如影响蛋白质合成、信号传导、胞内物质转运等[30]。本研究发现,在过渡期早期Bt胞外存在的毒力蛋白有溶血素、肠毒素、细胞毒素和蜂房毒素等,它们可能参与和宿主的相互作用。此外,各类结合蛋白中,几丁质结合蛋白HD73_3189(chitin-binding protein)的分泌量最大。
分泌蛋白质在胞内合成,而后运输到胞外发挥作用,这一现象贯穿细胞整个生命过程。大多数胞外蛋白首先被合成为蛋白质前体,并在氨基端带有信号肽。大多数细菌胞外蛋白通过高度保守的Sec途径运输到胞外[31]。信号肽可以引导蛋白质的定位和跨膜转运,当蛋白完成转运后,信号肽才被移除[32]。因而,信号肽对蛋白质的高效分泌至关重要,可以保证蛋白的活性和稳定性,尤其对于一些酶类来说,活性和稳定性是发挥生物催化必不可少的条件。Brockmeier等[33]以角质酶和酯酶作为分泌表达外源蛋白的报告基因,分析了Bs中所有Sec型信号肽对二者的分泌的影响,发现对角质酶分泌效率最高的信号肽对酯酶的分泌效率却很低,反之亦然,表明了信号肽与分泌的成熟蛋白间组合的重要性。这一结果强调了对于不同目标蛋白的分泌表达,需要确定其最优信号肽。2016年,Zhang等[10]的研究结果也证实了这一结论。因此,信号肽库是提高分泌表达效率的一个重要工具。本研究建立了含27种经典的Sec型信号肽的Bt信号肽库,为优化分泌表达、提高分泌效率奠定了基础。
4 结论苏云金芽胞杆菌产生分泌蛋白的能力较强,在过渡期T1时有50多种胞外蛋白质,且大部分为酶类,其次为毒力蛋白。其中,蛋白水解酶含量较多,尤其是HD73_2118和HD73_5638、HD73_0744、HD73_1513,可能会降解外源蛋白,因而构建Bt分泌表达宿主时可对其进行敲除。此外,建立了Bt_HD73 T1时期分泌蛋白质的Sec型信号肽库,包括27种具有引导外源蛋白分泌潜力的信号肽。
| [1] | Susanne P, Gaurav B, Joanne H, et al. Proteomic analysis of Bacillus subtilis strains engineered for improved production of heterologous proteins. Proteomics, 2013, 13 (22): 3298–3308. DOI:10.1002/pmic.v13.22 |
| [2] | Mamat U, Wilke K, Bramhill D, et al. Detoxifying Escherichia coli for endotoxin-free production of recombinant proteins. Microb Cell Fact, 2015, 14 : 57. DOI:10.1186/s12934-015-0241-5 |
| [3] | Liu S, Tobias R, McClure S, et al. Removal of endotoxin from recombinant protein preparations. Clin Biochem, 1997, 30 (6): 455–463. DOI:10.1016/S0009-9120(97)00049-0 |
| [4] | Schmidt FR. Recombinant expression systems in the pharmaceutical industry. Appl Microbiol Biotechnol, 2004, 65 (4): 363–372. DOI:10.1007/s00253-004-1656-9 |
| [5] | Ferrer-Miralles N, Domingo-Espin J, Corchero JL, et al. Microbial factories for recombinant pharmaceuticals. Microb Cell Fact, 2009, 8 : 17. DOI:10.1186/1475-2859-8-17 |
| [6] | Schallmey M, Singh A, Ward OP. Developments in the use of Bacillus species for industrial production. Can J Microbiol, 2004, 50 (1): 1–17. DOI:10.1139/w03-076 |
| [7] | Liu L1, Liu Y, Shin HD, et al. Developing Bacillus spp. as a cell factory for production of microbial enzymes and industrially important biochemicals in the context of systems and synthetic biology. Appl Microbiol Biotechnol, 2013, 97 (14): 6113–6127. DOI:10.1007/s00253-013-4960-4 |
| [8] | Rebekka B. A Bacillus megaterium system for the production of recombinant proteins and protein complexes. Advances in Experimental Medicine and Biology, 2016, 896 : 97–113. DOI:10.1007/978-3-319-27216-0 |
| [9] | Ruihua L, Zhenqiang Z, Yingming X, et al. Twin-arginine signal peptide of Bacillus subtilis YwbN can direct TatDependent secretion of methyl parathion hydrolase. J Agric Food Chem, 2014, 62 : 2913–2918. DOI:10.1021/jf405694n |
| [10] | Zhang W, Yang M, Yang Y, et al. Optimal secretion of alkali-tole-rant xylanase in Bacillus subtilis by signal peptide screening. Applied Microbiology and Biotechnology, 2016, 100 (20): 8745–8756. DOI:10.1007/s00253-016-7615-4 |
| [11] | Ramos KR, Valdehuesa KN, Cabulong RB, et al. Overexpression and secretion of AgaA7 from Pseudoalteromonas hodoensis sp. nov in Bacillus subtilis for the depolymerization of agarose. Enzyme and Microbial Technology, 2016, 90 : 19–25. DOI:10.1016/j.enzmictec.2016.04.009 |
| [12] | Thi Lan Thanh B, Shogo T, Kosei T, et al. Secretion of heterologous thermostable cellulases in Bacillus subtilis. J Gen Appl Microbiol, 2014, 60 (5): 175–182. DOI:10.2323/jgam.60.175 |
| [13] | Shogo T, Kosei T, Shinji T, et al. Enhanced secretion of natto phytase by Bacillus subtilis. Bioscience, Biotechnology, and Biochemistry, 2015, 79 (11): 1906–1914. DOI:10.1080/09168451.2015.1046366 |
| [14] | Guo S1, Tang JJ, Wei DZ, et al. Construction of a shuttle vector for protein secretory expression in Bacillus subtilis and the application of the mannanase functional heterologous expression. J Microbiol Biotechnol, 2014, 24 (4): 431–439. DOI:10.4014/jmb.1311.11009 |
| [15] | Zhang C, Tao T, Ying Q, et al. Extracellular production of lipoxygenase from Anabaenas sp. PCC 7120 in Bacillus subtilis and its effect on wheat protein. Appl Microbiol Biotechnol, 2012, 94 : 949–958. DOI:10.1007/s00253-012-3895-5 |
| [16] | Zhang J, Kang Z, Ling Z, et al. High-level extracellular production of alkaline polygalacturonate lyase in Bacillus subtilis with optimized regulatory elements. Bioresource Technology, 2013, 146 : 543–548. DOI:10.1016/j.biortech.2013.07.129 |
| [17] | Pohl S, Harwood CR. Heterologous protein secretion by Bacillus species from the cradle to the grave. Adv Appl Microbiol, 2010, 73 : 1–25. DOI:10.1016/S0065-2164(10)73001-X |
| [18] | Sarvas M, Harwood CR, Bron S, et al. Post-translocational folding of secretory proteins in Gram-positive bacteria. Biochim Biophys Acta, 2004, 1694 (1-3): 311–327. |
| [19] | Nijland R, Kuipers OP. Optimization of protein secretion by Bacillus subtilis. Recent Pat Biotechnol, 2008, 2 (2): 79–87. DOI:10.2174/187220808784619694 |
| [20] | Bravo A, Likitvivatanavong S, Gill SS, et al. Bacillus thuringiensis:a story of a successful bioinsecticide. Insect Biochem Mol Biol, 2011, 41 (7): 423–431. DOI:10.1016/j.ibmb.2011.02.006 |
| [21] | 李玉呈. 高效表达几丁质酶基因tchiB苏云金芽胞杆菌工程菌的构建及杀虫活性研究[D]. 长沙: 湖南师范大学, 2012. |
| [22] | Liu G, Song L, Shu C, et al. Complete genome sequence of Bacillus thuringiensis subsp. kurstaki strain HD73. Genome Announcements, 2013, 1 (2): e0008013. |
| [23] | Petersen TN, Brunak S, von Heijne G, et al. SignalP 4. 0:discriminating signal peptides from transmembrane regions. Nature Methods, 2011, 8 (10): 785–786. DOI:10.1038/nmeth.1701 |
| [24] | Gohar M, Gilois N, Graveline R, et al. A comparative study of Bacillus cereus, Bacillus thuringiensis and Bacillus anthracis extracellular proteomes. Proteomics, 2005, 5 (14): 3696–3711. DOI:10.1002/(ISSN)1615-9861 |
| [25] | Harwood CR, Cranenburgh RM. Bacillus protein secretion:an unfolding story. Trend Microbiol, 2008, 16 (2): 73–79. DOI:10.1016/j.tim.2007.12.001 |
| [26] | Nakayama A, Ando K, Kawamura K, et al. Efficient secretion of the authentic mature human growth hormone by Bacillus subtilis. Journal of Biotechnology, 1988, 8 (2): 123–134. DOI:10.1016/0168-1656(88)90074-0 |
| [27] | Tran SL, Guillemet E, Gohar M. CwpFM (EntFM) is a Bacillus cereus potential cell wall peptidase implicated in adhesion, biofilm formation, and virulence. J Bacteriol, 2010, 192 (10): 2638–2642. DOI:10.1128/JB.01315-09 |
| [28] | Grandvalet C, Gominet M, Lereclus D. Identification of genes involved in the activation of the Bacillus thuringiensis inhA metalloprotease gene at the onset of sporulation. Microbiology, 2001, 147 (7): 1805–1813. DOI:10.1099/00221287-147-7-1805 |
| [29] | Fedhila S, Nel P, Lereclus D. The InhA2 metalloprotease of Bacillus thuringiensis strain 407 is required for pathogenicity in insects infected via the oral route. J Bacteriol, 2002, 184 (12): 3296–3304. DOI:10.1128/JB.184.12.3296-3304.2002 |
| [30] | Masignani V, Pizza M, Rappuoli R. The prokaryotes:Bacterial toxins[M]. Springer New York, 2006: 893-955. |
| [31] | Tjalsma H, Bolhuis A, Jongbloed JD, et al. Signal peptide-dependent protein transport in Bacillus subtilis:a genome-based survey of the secretome. Microbiol Mol Biol Rev, 2000, 64 (3): 515–547. DOI:10.1128/MMBR.64.3.515-547.2000 |
| [32] | Tjalsma H, Antelmann H, Jongbloed JD, et al. Proteomics of protein secretion by Bacillus subtilis:separating the "secrets" of the secretome. Microbiol Mol Biol Rev, 2004, 68 (2): 207–233. DOI:10.1128/MMBR.68.2.207-233.2004 |
| [33] | Brockmeier U, Caspers M, Freudl R, et al. Systematic screening of all signal peptides from Bacillus subtilis:a powerful strategy in optimizing heterologous protein secretion in gram-positive bacteria. J Mol Biol, 2006, 362 (3): 393–402. DOI:10.1016/j.jmb.2006.07.034 |