随着20世纪后期新型纳米技术的迅速兴起,纳米材料越来越被广泛的应用于工农业生产中[1, 2]。纳米碳是一种具有宏观量子隧道效应、量子尺寸效应及高表面能小尺度效应的纳米材料,与其他纳米材料相比,尤其是纳米金属材料,其化学性质稳定,且碳元素广泛存在于生物圈,因此对环境的潜在危害较小[3, 4]。目前已有研究表明,纳米碳在影响生物代谢、促进作物生长发育等方面具有良好的作用[5],如可以提高植物根系活力,增强植物抗氧化能力,改善作物品质,增加作物产量等[6-8]。对于纳米碳的研究及应用主要集中在其理化性质、结构特性及改良土壤、促进作物吸水吸肥、增产等,但其对植物的生理作用、分子机制及在植物组织培养中的应用研究较少。Khodakovskaya和Dervishi等[9]将番茄种子接入含纳米碳10-40 mg/L的MS培养基中可提高种子萌发率,同时纳米碳能够穿透种皮,促进种子内部水分的吸收,影响种子萌发和幼苗的生长;王佳奇等[10]、Tiwari等[11]研究了玉米的种子和幼苗在含纳米碳的培养基中生长,发现纳米碳可促进种子萌发及根系的生长,提高玉米幼苗对水分及矿质元素的吸收。从这些研究中可以看出,目前纳米碳在植物组织培养中的应用还处于起步阶段,其对愈伤组织诱导、细胞培养、芽分化、继代、生根等植物组织培养中关键步骤[12]的影响目前未见报道。本研究主要考察纳米碳浓度对几种植物组培苗的外植体增殖、分化及生长的影响,以获得纳米碳作用不同外植体继代培养的最适浓度,旨为提高植物组培快繁的效率及进一步研究纳米碳在植物离体培养条件下的作用机制提供参考。
1 材料与方法 1.1 材料纳米碳(C﹥90%,粒径40-80 nm,山西华农纳米科技有限公司)。6-BA(6-苄基腺嘌呤);NAA(萘乙酸)。食用百合(Lilium brownii var. viridulum)、红掌(Anthurium andraeanum)、大花蕙兰(Cymbidium)及金昌枣(Zizyphus jujuba Mill)的组培苗由山西农业大学植物组织培养实验室提供。
1.2 方法 1.2.1 食用百合的培养选择大小基本一致的食用百合鳞茎,将其接入MS+6-BA 0.8 mg/L +NAA 0.2 mg/L中进行继代增殖培养,待新的小鳞茎芽长至3-4 cm时,将其分为单株转接到含纳米碳(0、0.10、0.25、0.50、0.75、1.00和2.00 g/L)的增殖培养基中培养。共7个处理,每个处理6瓶,每瓶接入单株6株,重复3次。定期观察,40 d后统计鳞茎增殖系数、生根率及生根数等。鳞茎增殖系数=(增殖鳞茎总数-接种鳞茎数)/接种鳞茎数;生根率=(生根株数/接种株数)×100%。
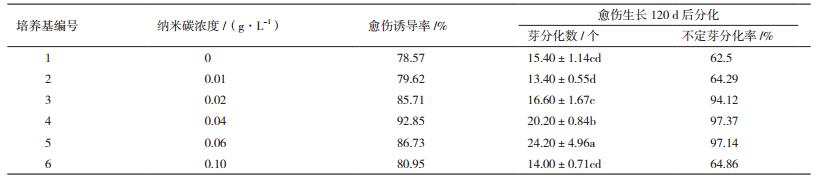
1.2.2 红掌的培养将红掌的组培苗叶片接种在诱导和分化培养基1/2MS+2.0 mg/L 6-BA+0.8 mg/L 2, 4-D上培养,不定芽长至1 cm左右时,将其转入MS+2.0 mg/L 6-BA+0.2 mg/L NAA中进行增殖培养。上述获得的不定芽,选择中间部位含一个腋芽1 cm左右的外植体,将其接入含纳米碳(0、0.01、0.02、0.04、0.06和0.10 g/L)的MS+1.5mg/L 6-BA+0.2 mg/L IBA的诱导和分化培养基中培养。共6个处理,每个处理6瓶,每瓶7个外植体,重复3次。定期观察,40 d后统计红掌的愈伤诱导率,观察其生长情况;120 d后统计外植体的平均芽分化数及不定芽分化率。愈伤诱导率(%)=诱导出愈伤组织的外植体数/接种外植体数×100%;不定芽分化率(%)=分化不定芽的愈伤组织块数/接种愈伤组织块数×100%。
1.2.3 大花蕙兰的培养以大小基本一致的大花蕙兰原球茎作为外植体,将其接入MS+4 mg/L 6-BA + 0.5 mg/L NAA中进行继代增殖培养,待新的原球茎芽长至2-3 cm时,将其分为单株转接到含纳米碳(0、0.30、0.50、0.70、1.00和2.00 g/L)的培养基中。共6个处理,每个处理6瓶,每瓶接入4个外植体,重复3次。每隔7 d定期观察,40 d后记录大花蕙兰的增殖系数、褐化率。褐化率(%)=褐化的外植体数/接种外植体数×100%。
1.2.4 金昌枣的培养将金昌枣的组培苗茎尖作为外植体,接种于MS+1.5 mg/L 6-BA+0.5 mg/L IBA的培养基中继代增殖,待丛生芽长至1.5 cm左右时,取茎尖部位转接到含纳米碳(0、0.025、0.05、0.075、0.10、0.125和0.15 g/L)的增殖培养基中培养。共7个处理,每个处理6瓶,每瓶接入7个外植体,重复3次。每隔30 d定期观察,记录金昌枣丛生芽的芽长、增殖系数及生长情况。
1.3 培养条件以MS为基本培养基,蔗糖30.0 g/L(除金昌枣的继代增殖培养基含蔗糖40.0 g/L外),琼脂5.0 g/L,pH6.0,121℃高温灭菌20 min。光照强度30-40 μmol/(m2·s)(除红掌腋芽诱导的光照强度12-13 μmol/(m2·s)外),光照时间14 h/d,温度(25±2)℃。
1.4 数据统计分析采用Excel 2007和DPS 7.5数据分析系统,对试验数据进行方差分析和多重比较分析(Duncan法)。
2 结果 2.1 纳米碳对食用百合生长及增殖的影响以食用百合的鳞茎为外植体进行继代增殖培养,由表 1可知,随着纳米碳浓度的增加,对百合鳞茎的增殖、生根呈现不同的影响(图 1-A,1-B,1-C)。未添加纳米碳的鳞茎增殖系数比添加0.10 g/L纳米碳减少0.66,而生根率低仅5.56%,且随着纳米碳浓度的继续增加,鳞茎增殖系数降低,不利于百合鳞茎增殖;当加入0.75 g/L纳米碳时,百合苗生根率增加至94%以上,而增殖系数低仅0.50,随着纳米碳浓度的增加,百合苗生根率增高,有利于苗的生长。当纳米碳浓度为0.50 g/L时,与对照相比,鳞茎增殖系数差异不显著;而百合苗根长、生根数较其他处理效果明显,且生根率达91.67%,苗长势健壮。这说明纳米碳影响百合鳞茎的分化及生长,低剂量的纳米碳促进百合鳞茎增殖,高剂量的纳米碳利于百合苗的生长及生根,添加一定浓度的纳米碳可提高百合苗的质量,延长继代周期。

|
| 图 1 利用含不同浓度纳米碳的培养基培养几种植物组培苗的不同外植体 A:食用百合鳞茎增殖未添加纳米碳;B、C:食用百合鳞茎增殖分别添加纳米碳0.10、0.50 g/L;D,F:红掌腋芽分别在含纳米碳0、0.06、0.10 g/L的培养基中培养120 d时的分化情况;G:在未添加纳米碳的培养基中培养大花蕙兰出现的褐化现象;H,I:分别添加纳米碳0.70、2.00 g/L时,大花蕙兰的褐化情况;J,L:分别添加纳米碳0、0.05和0.15 g/L时金昌枣茎尖继代增殖培养90 d的生长情况 |
以红掌的腋芽为外植体进行诱导和分化培养,腋芽基部(接触培养基部位)在10 d左右开始膨大,40 d可见紧密、嫩绿的愈伤,培养80 d愈伤组织黄绿色紧密并开始分化。由表 2可知,随着纳米碳浓度的增加,愈伤诱导率提高,尤其是含纳米碳0.04 g/L的培养基诱导率比对照高14.28%。培养120 d,愈伤组织分化产生不定芽(图 1-D,1-E,1-F),随着纳米碳浓度的增加,不定芽分化数、不定芽分化率均有增加。当纳米碳浓度为0.04-0.06 g/L时,平均芽分化数高达20个以上,不定芽分化率达97%左右。这说明在红掌的诱导分化培养基中添加一定浓度的纳米碳,有利于愈伤诱导和不定芽分化。
以大花蕙兰的原球茎为外植体进行继代培养,由表 3可知,随着纳米碳浓度的增加,大花蕙兰的增殖系数处理间无显著差异,但褐化率明显降低。未添加纳米碳的培养基中大花蕙兰褐化严重达100%(图 1-G),当添加纳米碳0.70-1.00 g/L时,增殖系数增加0.12以上,褐化率降低80%-95%,苗长势良好(图 1-H),有利于大花蕙兰继代增殖培养。当纳米碳浓度为2.00 g/L时,大花蕙兰的增殖系数与对照相比仅减少0.09,且培养基中无褐化现象(图 1-I),有利于苗的生长。这说明添加纳米碳可抑制大花蕙兰在植物组织培养过程中产生的褐化现象,高剂量的纳米碳有利于大花蕙兰原球茎的生长,且不影响其继代增殖。
以金昌枣的茎尖为外植体进行继代增殖,由表 4可知,随着纳米碳浓度的增加,金昌枣丛生芽的平均芽长呈先增高后降低的趋势,芽增殖系数先增加后下降。培养60 d后,纳米碳浓度为0.075 g/L的增殖培养基比未添加纳米碳的培养基平均芽长增加0.38 cm,增殖系数差异不显著;纳米碳浓度在0.10-0.15 g/L时,增殖系数降低,平均芽长略有降低,但从生芽长势健壮。当纳米碳浓度为0.05 g/L时,金昌枣丛生芽的平均芽长增加,增殖系数最佳可达5.74,有利于继代增殖培养。培养90 d后(图 1-J,1-K,1-L),含0.05 g/L纳米碳的培养基丛生芽增殖系数最佳达9.76,但玻璃化现象严重;含0.125-0.15 g/L纳米碳的培养基芽长势健壮,未出现玻璃化。这说明添加一定浓度的纳米碳可促进金昌枣芽的继代增殖,低剂量的纳米碳有利于增殖培养,高剂量的纳米碳抑制增殖,但可提高芽的质量。
在植物组织培养过程中,需遵循植物的生长规律,进而对细胞、组织、器官等外植体的生长发育进行改进,调节外植体的脱分化、再分化过程,促进次生代谢物的产生,防止组培苗的玻璃化、褐化及菌类污染等[12, 13]。Khodakovskaya等[9]利用高倍率透射电子显微镜观察番茄幼苗的根系发现纳米碳能进入植物根系,并提高根系的吸水吸肥能力;Liu等[14]研究发现单壁碳纳米管能穿透细胞壁和细胞膜进入烟草细胞,且可作为分子转运载体进入细胞,同时能够将不同的物质传递到不同植物细胞器中。本实验研究结果表明,百合鳞茎继代增殖培养过程中添加纳米碳0.10 g/L时,促进百合鳞茎增殖,添加纳米碳0.50 g/L时,提高百合苗生根率,促进生长;对红掌的腋芽进行诱导分化时,添加0.04-0.06 g/L的纳米碳有利于愈伤组织的诱导及不定芽的产生;金昌枣茎尖继代增殖培养时,加入纳米碳0.05 g/L时,芽增殖系数增加,加入纳米碳0.15 g/L时,芽长势健壮,增殖系数明显降低。这说明低剂量的纳米碳有利于组培苗的继代增殖,促进扩繁;高剂量的纳米碳抑制其增殖,但能促进组培苗的生长且长势健壮,延长继代周期。这些现象可能是纳米碳进入植物内部,影响植物内部的代谢水平;也可能是纳米碳进入细胞影响某些基因的表达,进而影响植株的生长与发育,这有待进一步研究证实。
此外,本研究也表明,金昌枣茎尖继代增殖培养90 d后,含低剂量纳米碳(0.025-0.075 g/L)的培养基丛生芽玻璃化现象严重,含高剂量纳米碳的培养基未出现此现象;大花蕙兰原球茎继代增殖培养中,未添加纳米碳时褐化现象严重,添加纳米碳1.00-2.00 g/L能够抑制其褐化现象,且不影响继代增殖。由于玻璃化、褐化现象均受激素水平的影响,尤其是细胞分裂素、生长素,如高浓度的细胞分裂素会促进使玻璃化现象,细胞分裂素与生长素比例失调也会导致玻璃化现象[15]。这说明纳米碳可调节外源激素的平衡和利用效率,从而改善植物分化及生长的进程,同时能提高培养基中其他有机、无机营养物质的利用率。
4 结论本研究通过添加不同浓度的纳米碳培养几种植物的不同外植体,表明纳米碳对植物组培苗具有一定的影响及应用价值,低剂量的纳米碳可促进增殖,有利于继代扩繁;高剂量的纳米碳使组培苗健壮且促进生长,可防止玻璃化、褐化现象,延长继代周期,提高苗的成活率。
| [1] | Iijima S. Helical microtubules of graphitic carbon. Nature, 1991, 354 (6348): 56–58. DOI:10.1038/354056a0 |
| [2] | 吕金榜, 周蓓蓓, 王全九. 地表下纳米碳混合层对土壤入渗过程的影响. 水土保持学报, 2016, 30(2): 126–130. |
| [3] | 梅龙伟, 张振华, 丁开和. 单壁碳纳米管电子输运特性的稳定性分析. 物理学报, 2009, 58(3): 1971–1979. DOI:10.7498/aps.58.1971 |
| [4] | 韩红梅, 邱介山, 周颖, 等. 碳纳米管的制备及其热稳定胜和表面性质的研究. 炭素技术, 2001(4): 5–9. |
| [5] | 马辰. 纳米碳对玉米养分利用及产量的影响[D]. 哈尔滨: 东北农业大学, 2014. |
| [6] | 武美燕, 蒿若超, 田小海, 等. 添加纳米碳缓释肥料对超级杂交稻产量和氮肥利用率的影响. 杂交水稻, 2010, 4: 86–90. DOI:10.3969/j.issn.1005-3956.2010.01.035 |
| [7] | 梁太波, 蔡宪杰, 过伟民, 等. 纳米碳用量对烤烟生长发育和钾素吸收积累的影响. 烟草科技, 2011(11): 61–65. DOI:10.3969/j.issn.1002-0861.2011.11.016 |
| [8] | Fan IL, Wang YH, Shao XW, et al. Effects of combined nitrogen fertilizer and nano-carbon application on yield and nitrogen use of rice grown on saline-alkali soil. Food, Agriculture and Environment (JFAE), 2012, 10 (1): 558–562. |
| [9] | Khodakovskaya M, Dervishi E, et al. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth. Acs Nano, 2009, 10 : 3221–3227. |
| [10] | 王佳奇, 李丽鹤, 孟令波, 等. 纳米碳对玉米种子萌发及根系形态的影响. 中国农学通报, 2013, 29(18): 62–66. DOI:10.11924/j.issn.1000-6850.2012-3267 |
| [11] | Tiwari DK, Dasgupta-Schubert N, et al. Interfacing carbon nanotu-bes (CNT) with plants:enhancement of growth, water and ionic nutrient uptake in maize (Zea mays) and implications for nanoa-griculture. Applied Nanoscience, 2013, 5 : 577–591. |
| [12] | 吕冬梅, 袁媛, 詹志来. 药用植物大规模组织培养的相关问题探讨. 中国中药杂志, 2014, 39(17): 3413–3415. |
| [13] | 高国训. 植物组织培养中的褐变问题. 植物生理学报, 1999(6): 501–506. |
| [14] | Liu Q, Chen B, Wang Q, et al. Carbon nanotubes as molecular transporters for walled plant cells. Nano Letters, 2009, 9 : 1007–1010. DOI:10.1021/nl803083u |
| [15] | 邵龙珠, 赵淑君, 王淑荣, 等. 植物组织培养中的常见问题与解决技术措施. 林业勘查设计, 2012(1): 49–51. |