2. 塔里木大学生命科学学院,阿拉尔 843300;
3. 塔里木大学植物科学学院,阿拉尔 843300
2. The College of Life Science in Tarim University, Alar 843300;
3. The College of Plant Science in Tarim University, Alar 843300
非生物胁迫是导致作物减产甚至植株死亡的重要因素[1]。在非生物胁迫因子中,高温是影响植物包括生长、发育、生殖及产量等整个生育期的重要逆境因子。随着全球气候变化,极端高温对植物造成的胁迫正日益加剧,人们也越来越多的关注高温对植物产生的影响。2015年7月,新疆出现历史罕见的大范围、长时间、高强度的高温天气。全疆平原地区均出现35℃以上的高温,其中50县市出现40℃以上的高温;其中吐鲁番东坎儿7月24日最高气温达47.7℃。高温给人们生活、农作物及林果、尤其是棉花产量造成严重影响(http://www.xj-agri.gov.cn/nongyeyw/16643.jhtml)。有数据显示,1980-2008年间,由热胁迫给小麦和玉米分别造成5.5%和3.8%的减产,仅1980年和1988年的热浪给美国农业分别造成550亿美元和710亿美元的损失[2]。
从宏观上,高温会导致本就脆弱的生态更加不堪一击,严重时会引起草场退化、植被减少,沙漠扩展;从微观上,高温胁迫不同程度地影响着细胞中各种蛋白、膜系统、RNA的种类、细胞骨架结构、酶促反应效率的稳定性,以及细胞渗透压,进而影响着代谢平衡的状态[2]。因此,细胞膜透性、膜脂过氧化程度及保护酶系统的活性常被作为评价植物抗逆性的生理指标。而荒漠植物在长期的进化中形成了一整套应对各种自然环境胁迫的适应体系,以重建新的代谢平衡,这可使有机体发挥正常功能、继续存活、甚至在高温等逆境条件下保持产量。
花花柴(Karelinia caspia Less)又名胖姑娘、胖娃娃草,是菊科(Asteraceae)花花柴属(Karelinia Less)多年生草本植物,在中国、蒙古、苏联的中亚和欧洲东部、伊朗和土耳其等地都有广泛的分布,多生于干旱、半干旱地区河谷冲积平原及沙质草甸盐土上[3]。我国主要分布于新疆准噶尔盆地和塔里木盆地、青海柴达木盆地、甘肃西北部和北部、内蒙古西部,常大片群生,极常见。花花柴叶片扁平且明显肉质化,体内有发达的储水组织,保水能力强[4];具有较低的萎蔫系数、较强的繁殖特性以及叶片积累大量游离脯氨酸等特点以适应荒漠高温干旱环境[5]。作为重要的防风固沙植物,花花柴具耐盐碱、耐干旱、耐高温以及耐沙埋等特性,是一种改善荒漠地区生态平衡的重要植物[6]。本研究所选的花花柴长期生长在塔里木盆地,该地区属暖温带荒漠干旱气候,全年日照时数2 556.3-2 991.8 h,年平均气温8.9-11.4℃,夏季最高温度达45℃以上,年降水量不足100 mm,年蒸发量(潜势)在1 900 mm以上。为了适应这种复杂恶劣的生态环境,花花柴进化形成了对高温等逆境耐受性的生理特性。因此,本实验以花花柴为材料,对花花柴幼苗进行持续高温处理试验,对高温胁迫下花花柴幼苗生理生化特性变化进行比较,评价花花柴对高温的耐受性,旨为花花柴耐高温的生物学特性发掘和利用提供科学依据。
1 材料与方法 1.1 材料种子采集:本实验所用的花花柴种子于2014年10月在阿拉尔市(40° 32'N,81° 17'E)的沙漠边缘采得,种子经干燥后置于纸袋内,室温通风保存备用。
1.2 方法 1.2.1 种子发芽及幼苗培养将花花柴种子播种于营养钵(营养土:蛭石=2:1)中,每个营养钵播种15粒,待大部分种子萌发后,用自来水浇灌,每周1次,每次浇透。室温(25±2℃),光照/黑暗为16 h/8 h,光强为600 μmol/(m2·s)培养至两个月时,选取株高15-20 cm大小长势良好的幼苗进行高温胁迫实验。
1.2.2 高温处理将所选取幼苗的花盆分别放入40、45和50℃培养箱中,光照时间及光照强度不变:光照/黑暗为16 h/8 h,光强为600 μmol/(m2·s)。对40℃处理的幼苗,分别在处理6、12、24和48 h时采集幼苗叶片;对45℃处理的幼苗,分别在处理2、4、6、8、12和24 h时采集幼苗叶片;对50℃处理的幼苗,分别在处理1、2、3和4 h时采集幼苗叶片;分别进行丙二醛、电导率、SOD、POD及CAT指标的检测,每个处理设3次重复。
1.2.3 对照的设置以高温处理前采集的幼苗叶片(即25℃条件)为对照(ck),测定丙二醛、电导率、SOD、POD及CAT指标,每个指标设置3个重复。1.2.4检测方法采用硫代巴比妥酸法[7]测定丙二醛。采用浸泡法[8]测定电导率。采用氮蓝四唑(NBT)法[7]测定SOD。采用紫外吸收法[7]测定CAT。
台盼蓝染色法:将4 g台盼蓝加少量蒸馏水研磨,用双蒸水定容至100 mL,并过滤配制成4%(g/v)的台盼兰溶液,将待检测样品完全浸泡在台盼蓝溶液中染色,30 min后吸尽染色液,用蒸馏水清洗3次,最后在蒸馏水中浸泡1 h,充分洗脱吸附在样品表面的染料,最后再拍照观测染色结果。每个处理重复3次,实验结果为3次实验的平均值取标准差。利用Excel,SPSS17.0软件对实验数据进行差异显著性分析、相关分析和作图。
2 结果 2.1 高温对花花柴幼苗叶片膜脂过氧化及膜透性的影响 2.1.1 高温处理下花花柴幼苗叶片中MDA含量的变化在40℃高温处理6 h内,细胞MDA含量急剧升高,在6 h处达到最高,为对照的2.7倍;随着胁迫时间延长,MDA含量逐渐降低,并在胁迫12 h后保持稳定,为对照的1.8倍(图 1-A)。在45℃高温处理下,随着胁迫时间的延长,MDA含量逐渐增加;在处理前4 h内,幼苗叶片MDA含量逐渐升高,彼此差异显著;在胁迫4-8 h内,MDA升高缓慢,且无显著差异,该阶段高温条件下MDA含量为对照的3.1倍;在处理12 h后,MDA含量显著上升,在处理24 h时,其MDA的含量为对照的6.1倍(图 1-B)。由图 1-C看出,在50℃高温处理下,花花柴幼苗叶片MDA含量随着胁迫时间的延长而增加,在处理的各时间段,其MDA含量与对照相比差异显著;在处理4 h时幼苗MDA含量达到最高,为对照的7.4倍。
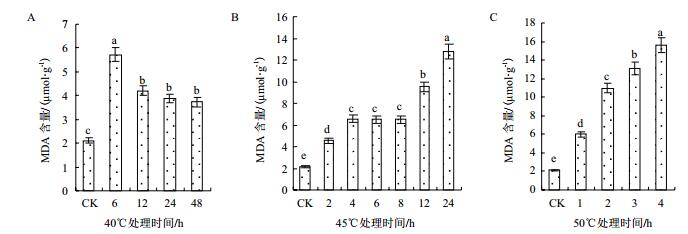
|
| 图 1 高温处理下花花柴幼苗叶片MDA含量的测定结果 |
在40℃处理下,花花柴叶片相对电导率呈先升高后降低趋势,在处理12 h时达到最高,为对照的4.9倍,在处理6 h和12 h时其值无显著差异;随着处理时间的延长,相对电导率显著下降,为对照3.1倍左右,在处理24 h后其电导率变化不显著(图 2-A)。在45℃处理条件下,随着胁迫时间延长相对电导率逐渐增加;在胁迫前2 h内,相对电导率急剧升高;在随后的2-8 h内,相对电导率彼此无显著差异,为对照的4.8倍左右;在处理12 h后,相对电导率急剧上升,且在处理8 h、12 h和24 h时的相对电导率彼此差异显著,在24 h处达到最高,为103.5%,是对照的7.4倍(图 2-B)。在50℃处理条件下,花花柴幼苗叶片相对电导率随着胁迫时间的延长而显著增加,且各处理时间段的相对电导率与对照差异显著;在高温胁迫3 h内,幼苗相对电导率为77.4%-92.3%,胁迫4 h时达到最高,为233%,是对照的16.6倍(图 2-C)。

|
| 图 2 高温处理下花花柴幼苗叶片相对电导率的测定结果 |
通过对保护酶SOD活性的测定,结果(图 3-A)显示在40℃处理下,花花柴幼苗叶片SOD活性随处理时间的延长逐渐升高。在处理前24 h内,SOD活性显著升高。在此时间内各胁迫时间段的SOD活性与CK相比差异显著;胁迫24 h后,SOD活性趋于稳定,在24 h和48 h时的SOD活性无显著差异,为CK的4.8倍。在45℃条件下(图 3-B),随着处理时间的延长幼苗SOD活性呈先上升后降低趋势。在处理前8 h内,叶片SOD活性随着胁迫时间延长显著上升,在此时间段内的各胁迫时间处的SOD活性与CK差异显著,并在8 h处达到最大,为CK的6.4倍;在胁迫12 h后,SOD活性迅速下降,在24 h是为对照的91.1%。在50℃高温处理下(图 3-C),幼苗叶片SOD活性在处理1 h内急剧升到最高,为对照的5.9倍;随着胁迫时间的延长SOD活性又迅速下降,在胁迫4 h时降到最低,仅为对照的78.8%。

|
| 图 3 高温处理下花花柴幼苗叶片SOD活性的测定结果 |
通过对保护酶POD活性的测定,在40℃条件下,花花柴幼苗叶片POD随着高温胁迫时间延长呈先升高后降低趋势。在胁迫前12 h内,POD活性迅速升高,在6 h和12 h处的POD活性与CK差异显著,胁迫12 h后,POD活性下降,在12 h和24 h处的POD活性无显著差异。POD活性在12 h处的达到最高,为CK的1.6倍;在48 h处降到最低,为CK的84.9%。因此,40℃胁迫下(图 4-A)花花柴的POD耐热时间临界值为12 h。在45℃高温胁迫下(图 4-B),随着胁迫时间延长幼苗POD活性呈先上升后降低趋势。在胁迫前4 h内,叶片POD活性在2 h处略有下降后,随着胁迫时间延长急剧上升,并在4 h处达到最大,为CK的1.16倍;在胁迫6 h后,POD活性迅速下降,在24 h处降到最低,为对照的9.6%;在此时间内的各胁迫时间处的POD活性差异显著。因此,45℃胁迫下花花柴的POD耐热时间极限值为4 h。在50℃高温胁迫下(图 4-C),幼苗叶片POD活性在胁迫1 h内急剧升到最高,为对照1.3倍;随后随着胁迫时间的延长POD活性又迅速下降,在胁迫4 h时降到最低,为对照的12.7%。因此,50℃胁迫下花花柴的POD耐热时间极限值为1 h。
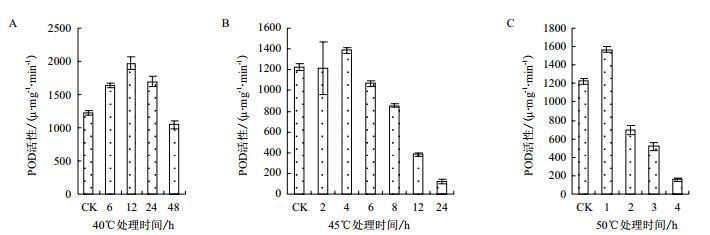
|
| 图 4 高温处理下花花柴幼苗叶片POD活性的测定结果 |
通过对各温度处理下花花柴叶片CAT活性的测定结果比较发现,40℃条件下(图 5-A),花花柴幼苗叶片CAT随着高温胁迫时间延长逐渐升高,在处理24 h时,CAT活性达到最高,为对照的2.2倍,且在此时间内的各胁迫时间处的CAT活性差异显著;胁迫24 h后,CAT活性趋于稳定,且在24 h和48 h处无显著差异。在45℃和50℃处理下,随着处理时间的延长,花花柴幼苗叶片的CAT活性呈先上升后降低趋势。45℃条件下(图 5-B),在处理前8 h内CAT活性达到最大,为对照的1.8倍。在此时间内的各胁迫时间处的CAT活性与对照差异显著,但在处理2 h、4 h和6 h彼此无显著差异;在处理12 h后,CAT活性迅速降低,在24 h处降到最低,为对照的29.5%。在50℃处理下(图 5-C),幼苗叶片CAT活性在处理1 h内与对照没有差异,随着处理时间的延长CAT活性迅速下降,且各处理时间段的CAT活性差异显著。

|
| 图 5 高温处理下花花柴幼苗叶片CAT活性的测定结果 |
在40℃的条件下,台盼蓝染色结果(图 6)显示48 h内花花柴幼苗叶片未着色;在45℃处理花花柴幼苗,6 h后,叶片出现蓝色斑点,随着胁迫时间的延长,斑点越多、着色面积越大;在50℃的高温胁迫下,胁迫1 h叶片就出现蓝斑,胁迫时间越长,叶片染色范围越大、颜色越深。

|
| 图 6 高温处理下花花柴幼苗叶片台盼蓝染色结果 (A)1:未处理未染色的叶片;2-6:分别为40℃处理0、6、12、24、48 h的染色结果。(B)1-6:分别为45℃处理2、4、6、8、12、24 h的染色结果。(C)1-4:分别为50℃处理1、2、3、4 h的染色结果 |
采用模糊数学隶属函数法综合评价花花柴对高温的耐受性[9]。结果显示,评价指标中相对电导率、丙二醛和台盼蓝染色相对面积与花花柴的抗高温呈负相关性,而POD,CAT,SOD均属于保护酶与抗高温呈正相关性,表明这6个指标都可以作为评价花花柴对高温的耐受性指标。在40℃处理下,6 h和12 h时隶属函数值小于0.5,其他处理的隶属函数值大于0.5;在45℃处理下,12 h和24 h时隶属函数值小于0.5,其他处理的隶属函数值大于0.7;在50℃处理下,3 h和4 h时的隶属函数值小于0.5,1 h和2 h时隶属函数值大于0.5。
3 讨论植物在高温胁迫下,产生大量的活性氧(Reactive oxygen species,ROS),致使细胞膜膜脂发生过氧化、膜蛋白变性、生理生化代谢失衡和异常[2, 10],并产生有害物质,如丙二醛MDA;同时高温还会引起生物膜的疏水键断裂,导致细胞膜流动性和通透性增加,膜的选择性吸收功能丧失,细胞内电解质外渗,电导度升高[11]。因此,MDA和相对电导率被作为评价细胞膜膜脂过氧化程度和细胞膜完整性的重要指标。台盼蓝是一种高分子量的活性染色剂,作为一种细胞染料,可以穿过受损或者死亡的全透细胞膜,使不完整或死亡的细胞着色。因此台盼蓝染色的着色面积和染色深度也可以作为评价细胞死亡的指标。本实验结果表明,在40℃条件下,幼苗MDA含量和相对电导率随着胁迫时间延长均呈先升高后降低趋势,表明花花柴幼苗在胁迫初期细胞膜系统受到损害[12],随后在一系列应激和保护系统的调节下,花花柴细胞重建了ROS等的平衡,并快速修复了细胞损伤[13],台盼蓝染色的结果也表明在40℃条件下受损失细胞很少。但随着温度的进一步升高(如45℃和50℃),MDA含量和相对电导率在处理一定的时间内达到一定的平衡状态,但随着处理时间的延长,这种高强度长时间的高温胁迫导致细胞膜的过氧化程度和膜透性发生了不可修复性的损伤,致使其MDA和相对电导率急剧升高,直至细胞凋亡[14, 15],相应的台盼蓝的相对染色面积也随着处理时间的延长逐渐增大。这与研究人员关于高温胁迫下水稻(Oryza sativa)[16]、芹菜(Apium graveolens)[17]膜稳定性影响的研究一致。而且这种结果符合沙漠植物花花柴的生态环境。本实验所选花花柴长期生长在塔克拉玛干沙漠边缘,本地的温度在夏季午时经常在45℃左右,因此40℃对花花柴不会造成不可逆的伤害,这与本研究的实验结果一致。在自然状态下,45℃高温发生的时间大约在夏季白天13:00-17:00之间,最高温度约在15:00-16:00之间,因此,在45℃和50℃处理下,花花柴分别可以耐受8 h和1 h,这种结果不仅与自然条件相符,也为花花柴高温处理过程的温度及处理时间设置提供了可靠的实验支撑。
高温对植物主要造成氧化胁迫。细胞内ROS的上升与保护酶清除ROS活性的增强,处在动态平衡状态[2, 10, 11]。因此,保护酶系统(SOD、POD、CAT等)的活性则是评价细胞防止过氧化能力的重要指标。高温胁迫致使RNA和蛋白质的种类发生变化,酶活性降低,大量活性氧(O2-、OH-和H2O2)生成并积累,这都会对植物造成不可逆转的损伤[2]。植物为避免活性氧的损害,在一定范围内会主动调控抗氧化保护酶(POD、SOD和CAT)系统的活性,清除过多的ROS,修复受损细胞[18]。从本实验可以看出,在40℃胁迫下,3种酶活性在处理24 h时皆达到最高,随后趋于稳定。说明花花柴的这3种酶在40℃条件下其活性不受影响。但在45℃和50℃条件下,SOD和CAT酶活性都随着胁迫时间延长呈先升高后降低趋势,说明在极端温度处理下,叶片内抗氧化酶的活性在一定时间内具有防护作用,但随着处理时间的延长,其活性受到影响而降低,这种结果进一步导致ROS产生不能及时清除从而大量积累,从而造成细胞死亡,最终致使植株死亡。从SOD和CAT的活性变化,随着胁迫温度的升高和胁迫时间的延长呈现出不同的差异性,对高温胁迫的敏感性SOD>POD>CAT;这与研究人员对柑橘[19]、杜鹃花(Rhododendron simsii)的研究一致[20, 21]。
4 结论通过对花花柴幼苗生物膜膜脂过氧化程度(MDA)、膜透性(相对电导率)以及保护酶系统(SOD、POD及CAT)的测定结果比较分析以及与台盼蓝染色的相关性分析,结果显示相对电导率、丙二醛和台盼蓝染色相对面积与花花柴的耐高温性呈负相关性,而POD、CAT、SOD均属于保护酶与耐高温呈正相关性,说明这5个指标可以作为花花柴耐高温性评价的有效指标。另外,实验结果也说明花花柴可以耐受40℃,而对45℃的耐受时间拐点在8 h左右,对50℃的耐受极限时间在1 h左右。结果表明花花柴具有很强的耐高温特性。
| [1] | Krasensky J, Jonak C. Drought, salt, and temperature stress-induced metabolic rearrangements and regulatory networks. J Exp Bot, 2012, 63 (4): 1593–1608. DOI:10.1093/jxb/err460 |
| [2] | Mittler R, Finka A, Goloubinoff P. How do plants feel the heat?. Trends in Biochem Sci, 2012, 37 (3): 118–125. DOI:10.1016/j.tibs.2011.11.007 |
| [3] | 罗家雄, 程昌平, 丁金石, 等. 花花柴利用的研究. 中国草原, 1988, 2: 16–20. |
| [4] | 周玲玲, 冯元忠, 吴玲, 等. 新疆六种盐生植物的解剖学研究. 石河子大学学报:自然科学版, 2002, 3: 217–221. |
| [5] | 王翠, 雷加强, 李生宇, 等. 新疆策勒绿洲-沙漠过渡带花花柴沙堆的形态特征. 中国沙漠, 2013, 33(4): 981–989. DOI:10.7522/j.issn.1000-694X.2013.00140 |
| [6] | 唐钢梁, 李向义, 林丽莎, 等. 表皮环割对花花柴水势及光合参数的短期影响. 中国沙漠, 2014, 34(6): 1527–1536. DOI:10.7522/j.issn.1000-694X.2013.00314 |
| [7] | 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 105-118. |
| [8] | 陈建勋, 王晓峰. 植物生理学实验指导[M]. 第2版. 广州: 华南理工大学出版社, 2006: 64-66. |
| [9] | 陈德明, 俞仁培, 杨劲松. 盐渍条件下小麦抗盐性的隶属函数值法评价. 土壤学报, 2002, 39(3): 368–374. DOI:10.11766/trxb200101260311 |
| [10] | Pucciariello C, Banti V, Perata P. ROS signaling as common element in low oxygen and heat stresses. Plant Physiol and Biochem, 2012, 59 : 3–10. DOI:10.1016/j.plaphy.2012.02.016 |
| [11] | Jaspers P, Kangasjärvi J. Reactive oxygen species in abiotic stress signaling. Physiol Plantarum, 2010, 138 (4): 405–413. DOI:10.1111/ppl.2010.138.issue-4 |
| [12] | 张志伟, 周津吟, 李莎. 高温胁迫对胭脂花叶片细胞膜透性影响研究. 安徽农学通报, 2015, 21(3-4): 33–34. |
| [13] | Saidi Y, Finka A, Goloubinoff P. Heat perception and signalling in plants :a tortuous path to thermotolerance. New Phytologist, 2011, 190 : 556–565. DOI:10.1111/nph.2011.190.issue-3 |
| [14] | Wang SY, Gao HY. Effect of chitosan-based edible coating on antioxidants, antioxidant enzyme system, and postharvest fruit quality of strawberries (Fragaria×aranassa Duch.). Food Science and Technology, 2013, 52 (2): 71. |
| [15] | 杨小飞, 郭房庆. 高温逆境下植物叶片衰老机理研究进展. 植物生理学报, 2014, 50(9): 1285–1292. |
| [16] | 赵森, 于江辉, 肖国樱. 高温胁迫对爪哇稻剑叶抗氧化酶及膜透性的影响. 热带作物学报, 2012, 33(10): 1846–1850. DOI:10.3969/j.issn.1000-2561.2012.10.024 |
| [17] | 朱鑫, 沈火林. 高温胁迫对芹菜幼苗细胞膜稳定性的影响. 北方园艺, 2014(7): 16–20. |
| [18] | 屠小菊, 汪启明, 饶力群. 高温胁迫对植物生理生化的影响. 湖南农业科学, 2013(13): 28–30. |
| [19] | 吴韶辉, 朱美红. 柑橘高温热害生理作用机理研究进展. 浙江柑橘, 2013, 30(2): 7–11. |
| [20] | 王丽娟, 欧静, 钟登慧, 等. 高温胁迫对桃叶杜鹃幼苗生理生化指标的响应. 湖北农业科学, 2014, 20: 4882–4891. |
| [21] | 耿兴敏, 胡才民, 杨秋玉, 等. 杜鹃花对各种非生物逆境胁迫的抗性研究进展. 中国野生植物资源, 2014, 3: 18–21. DOI:10.3969/j.issn.1006-9690.2014.03.006 |




