2. 江苏沿海地区农业科学研究所,盐城 224002;
3. 南京农业大学农村土地资源利用与整治国家地方联合工程研究中心,南京 210095
2. Jiangsu Coastal Area Institute of Agricultural Sciences, Yancheng 224002;
3. National Joint Local Engineering Research Center for Rural Land Resources Use and Consolidation, Nanjing Agricultural University, Nanjing 210095
随着全球工农业的快速发展,环境污染问题日益严重,其中,重金属是主要的环境污染物之一。金属污染物具有隐蔽性、滞留时间长、移动性差、不能被微生物降解等特点,土壤中的有害金属的污染直接影响土壤质量、水质状况、作物生长、农产品产量及品质,还能够通过食物链富集到人体和动物中,危害人畜健康,引发人类癌症和其它疾病等[1, 2]。其次,土壤的重金属污染还间接导致大气、地表水和地下水污染以及生态系统退化等其它次生生态环境问题。因此,如何有效地防治和解决土壤重金属污染问题,越来越受到世界各国的重视。目前,重金属污染土壤的修复方法有很多,主要可分为物理、化学、生物方法。其中传统的物理、化学治理方法,如排土填埋、稀释、淋洗、物理分离和电化学等方法,虽效果好、历史短,但往往存在费用高、能耗大、容易造成二次污染等不足[3, 4],在大规模应用上受到一定的限制[4, 5]。近年来,植物、微生物修复方法得到了广泛的重视,尤其是在植物-微生物联合修复方面,取得了显著进展。微生物-植物联合修复重金属污染技术是利用与植物共生的真菌、细菌等微生物的联合作用降解、吸附污染物,以达到修复的目的。
微生物可以用于辅助、强化植物进行土壤重金属污染修复,主要基于以下两方面:(1)根际微生物通过代谢活动产生有机酸、氨基酸、酶类以及其它代谢产物,可以有效地溶解重金属以及含重金属的矿物,使土壤中呈固态的重金属活化成为可溶态或交换态,有利于植物的吸收和富集,达到提高植物修复重金属污染土壤的效率[5];(2)根际微生物可以合成一些植物激素,如生长素和赤霉素,同时还可以分泌铁载体,具有溶磷、固氮等作用,能够有效地促进植物生长[6, 7];有些微生物还可以通过竞争、拮抗作用抑制或是杀死病原微生物,提高植物的抗逆性[8];其次,还有的细菌具有ACC脱氨酶活性,能够将乙烯的代谢前体ACC分解,减少植物体内乙烯的含量,从而减轻重金属对植物根系生长的抑制作用,增强植物对重金属胁迫的抗性[9, 10]。可见,微生物辅助植物修复重金属污染土壤是一条集高效、经济、环境友好于一体,具有发展前景的生物修复新途径。
菌根作为微生物与植物共生的一个互惠共利的共生系统,是真菌与植物根部形成的有机结合体,影响着宿主植物营养的吸收和土壤结构,受到了长时间的关注与研究:植物为菌根真菌提供碳源,相应的,真菌为宿主植物提供矿质营养元素、水、以及协助宿主抵御病虫害等胁迫[11]。外生菌根真菌可以通过协助宿主抵御生物和非生物胁迫[12-15]来辅助宿主植物在逆境下定植、生存。已有研究表明,某些地区进行林业引种失败的原因与缺少特定的菌根真菌密切相关[16]。菌根真菌在辅助、强化宿主植物在重金属污染土壤修复方面有着重要的意义[17-19]。其作用机理表现为以下两个方面:一方面,菌根真菌具有“固持作用”,可以通过将重金属元素吸附、固定并积累在菌丝体[20]、泡囊[21]、和植物根系[22]等部位来限制重金属元素向宿主植物运输[23];另一方面,菌根可以通过影响宿主植物对重金属的积累和分配模式,来增加积累量[24],以达到辅助宿主富集重金属的目的。但在实际应用中,针对不同的重金属污染土壤,往往会遇到菌种、宿主选择的难题:菌种是否具有重金属耐性、是否可以与宿主植物形成菌根、宿主能否在污染区定植,是植物-微生物联合修复中亟待解决的问题。
研究发现在重金属污染土壤中能有效定植的大多数宿主植物普遍与具有重金属耐性的菌根真菌相伴而生,表明这些真菌在与宿主协同进化的过程中已逐渐形成了对受重金属胁迫的耐性。本研究针对Cu污染土壤,从生态学和重金属污染生态修复角度,利用筛选(实验方法待发表)出的高耐铜性外生菌根真菌(Pisolithus tinctorius,Pt)进行耐重金属特性的研究,基于其普遍存在、易于培养,同时易形成菌根结构的特点,利用其与黑松幼苗共生形成菌根体系,促进宿主生长的同时,辅助宿主对重金属Cu的富集,以期为重金属污染地的改良探索出一条新途径。
1 材料与方法 1.1 材料 1.1.1 植物黑松(Pinus thunbergii)。
1.1.2 菌种彩色豆马勃(Pisolithus tinctorius,Pt)。
1.1.3 MMN培养基KH2PO4 0.5 g/L,(NH4)2HPO4 0.25 g/L,CaCl2 0.05 g/L,NaCl 0.025 g/L,MgSO4· 7H2O 0.15 g/L,维生素B1(thiamine hydrochloride)100 μg/L,FeCl3·6H2O 0.03 g/L葡萄糖10 g/L,麦芽膏3 g/L,琼脂14 g/L,pH5.50。121℃,0.1 MPa,灭菌20 min。
1.2 方法 1.2.1 Pt菌种耐铜性菌种扩繁:选取生长旺盛的菌种,在菌落边缘切取直径约0.8 cm的菌块倒置于固体MMN培养基平板中,25℃下暗箱纯培养,扩繁。
菌种的重金属耐性:配置的MMN液体培养基中,添加过滤灭菌(通过0.22 μm超滤膜)的重金属(CuSO4)溶液,使Cu2+的浓度分别达到0、5、50、100、250和500 μmol/L,分装于250 mL锥形瓶,每个100 mL,5个重复。扩繁菌落边缘截取0.8 cm的菌块置于液体培养基中,25 ℃下暗箱培养。60 d后,通过过滤获得菌丝体,再用超纯水冲洗几次,确保洗净表面残留的金属离子。将菌丝体置于50℃,72 h烘干,称量干重。对菌丝体高温消解,AAS分析金属Cu含量。
1.2.2 盆栽实验幼苗准备:选取饱满黑松种子,30% H2O2表面灭菌处理15 min,无菌水冲洗干净播种于装有经高温灭菌处理蛭石的育苗篮中,25℃下培养45 d左右备用。菌根化幼苗的准备:选取长势一致的黑松,剪去主根,预留1 cm左右后与菌块(取整个培养皿中菌块)充分接触(与空白培养基接触作为未接菌空白对照)种植于土、蛭石、沙的混合培养基质(V:V:V=1:1:1)中,置于阳光房中培育,自然光照,温控25℃/20℃(早/晚)。淋浇去离子水,以保持一定的湿度[(65±10)%相对空气湿度],培养6个月,获得成功侵染Pt菌种的菌根化松树幼苗。
Pt菌根化幼苗盆栽实验:选取长势较为一致的Pt侵染(侵染率:90±5%,侵染率=成功侵染Pt菌种的根尖数量/幼苗总的根尖数×100%)的菌根化幼苗和未接菌的幼苗,忽略移栽时幼苗间的差异。将上述幼苗种植于装有2.5 kg重金属Cu污染土壤的盆中,每盆3棵,两种苗各5盆,培植5个月。设置3个不种植苗的空白盆作为空白对照。污染土壤基本理化性质:pH(水提)6.99、电导0.87 ds/m、阳离子交换量50.09 cmol/kg、有机质2.16%,总P 0.52 g/kg,总K 5.29 g/kg、总N 0.64%,总Cu 905.10 mg/kg。上述盆栽置于阳光房中培育,自然光照,温控25℃/20℃(早/晚),相同方法淋浇去离子水。
1.2.3 样品收集和处理小心取出盆中松树苗,以保证根部的完整性,用抖土的方法收集幼苗根际土壤,同时将松树幼苗,洗净并分为根、茎、叶三部分,分装,70℃,72 h烘干,称重。粉碎后经玛瑙研钵研细过60目筛。秤取一定质量的粉碎样品,高温消解,分析测定重金属Cu元素以及营养元素K、Ca、P。根际土样经玛瑙研钵研细过100目筛后高温消解,分析总Cu含量。利用Tessier五步连续提取法,依次提取未种苗土(原位土壤)以及幼苗根际土样中的可交换态(Exchangeable)、碳酸盐结合态(Carbonate)、铁-锰氧化物结合态(Fe-Mn oxides)和有机结合态(Organic matter)的Cu元素,以总Cu含量减去上述4种形态的Cu得到残渣态(Residual)。
1.3 数据分析采用SPSS 22.0统计软件,对数据进行单因素方差分析(one-way ANOVA,P < 0.05)。
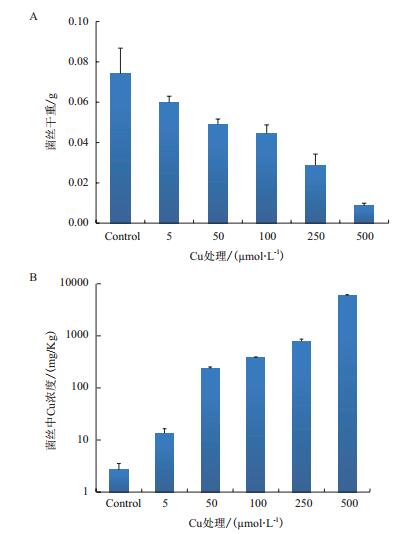
2 结果 2.1 Pt菌种的重金属Cu耐性不同Cu浓度处理下,液体培养基中菌丝体干重及菌种菌丝体所含重金属Cu含量如图 1所示。随着Cu处理浓度的增加,菌丝体的生长明显受到抑制,当处理浓度达到200 μmol/L左右时,菌丝生长抑制率达到50%;同时,菌丝体内的Cu含量也随着处理浓度的增加而增加,在500 μmol/L处理下,菌丝Cu含量接近了6 000 mg/kg。通过液体纯培养实验可以看出,菌种Pt具有很强的Cu耐性,且对Cu具有较强的吸附能力。
|
| 图 1 不同Cu浓度处理下Pisolithus tinctorius(Pt)菌种液体纯培养菌丝干重(A)及菌丝Cu(B)含量 |
5个月盆栽试验后,收集黑松苗各部分干重及总生物量如图 2所示。收集获得的Pt菌根化幼苗仍然保持较高的侵染率(82.1±10.5)%。与未接种的幼苗相比,Pt的侵染可以显著地(F=44.57,P=0.003)促进宿主幼苗的生长,尤其是根(F=9.66,P=0.036)和叶(F=21.78,P=0.010)

|
| 图 2 P. tinctorius(Pt)菌根化幼苗和非(Control)菌根化幼苗不同部位干重 |
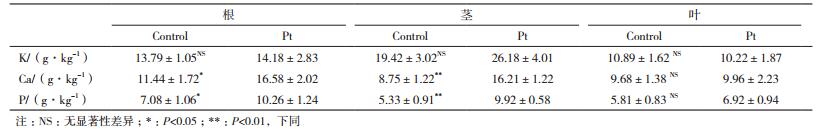
表 1显示,外生菌根真菌的侵染,可以有效的促进宿主幼苗根及茎中P和Ca的吸收,而宿主植物对K的吸收、幼苗叶片对Ca和P的吸收均没有受到菌种侵染的影响。
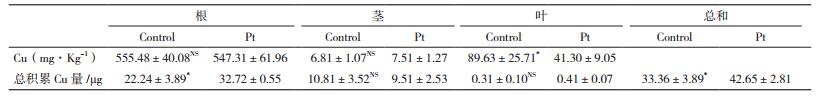
在Cu污染的土壤中,重金属Cu主要集中在植物根部,Pt菌种的侵染可以有效地降低重金属由根部向针叶的转运,减少重金属的毒害。由表 2可知,Pt菌种的侵染可以显著(P < 0.001)降低重金属生物转运系数(生物转运系数=针叶的重金属含量/根部重金属含量),由不接菌的(15.98±3.38)%降低到(7.50±0.96)%,继而减少了Cu对宿主植物的毒害作用。尽管如此,Pt菌种的侵染可以通过增加生物量来显著(F=11.26,P=0.02)提高幼苗体内总Cu量:由不接菌的(33.36±3.89)μg增加到(42.65±2.81)μg。同时,又由于菌根作用,宿主生物量的提高,有效地稀释了重金属在宿主体内的浓度,降低了其对宿主植物的毒害。
由表 3可见,供试土壤中Cu主要以铁-锰氧化物结合态(Fe-Mn oxides)、有机结合态和残渣态的形式存在。植物的种植,可以显著的降低土壤中碳酸盐结合态Cu含量,由原位土壤的7.87%分别降低到4.86%(不接菌)和5.42%(接菌处理),菌根的侵染显著降低了土壤中可交换态Cu的含量,由原位土壤的0.58%降低到0.35%,而种植未接菌的幼苗,只降低到0.42%。
早期的研究表明,Pt菌种含有的金属结合蛋白,如金属硫蛋白、蛋白硫化物[25],可以有效提高Pt菌种对Cu的耐性,本研究中液体纯培养耐Cu性实验,很好地验证了这一点,且随着Cu含量增高,菌丝体内Cu含量也增加。Pt菌种除可与很多常见树种(如松树、栎树、栗树等)形成菌根形态,还可以与一些生长在不同生境下的重要树种共生[26-28],在全球分布很广。它们可影响森林生态系统[26, 29],特别是在外界逆境胁迫下,可以有效地促进宿主植物对P、K、Ca的吸收,通过辅助宿主植株吸收营养矿质元素来提高其对外界环境胁迫(重金属、干旱等)的适应性[30-34],基于Pt菌种具有重金属耐性、普遍存在,容易实验室培养、回接(与宿主幼苗形成菌根)等优点,其在逆境下森林恢复中具有很高的应用前景。
菌根真菌的侵染可以通过增加营养元素的吸收、降低重金属的吸收来抵御重金属胁迫[35-37],外生菌根真菌普遍存在森林土壤中,也包括那些重金属含量比较高的地方,这些菌根真菌在提高宿主植物耐受重金属毒害方面发挥着巨大的作用[11, 38],可以提高污染土壤中植被的恢复[39]。在重金属胁迫下,相对于针叶部分,幼苗的根和茎部更易受到重金属的毒害。本研究结果显示,菌根Pt的存在,可以有效地促进宿主植物根、茎部营养元素(Ca、P)的吸收,以抵制重金属对幼苗的毒害。而对于K元素的吸收,在我们的研究中发现,菌根真菌Pt的侵染对其影响并不显著,由此推测,在K元素丰富的土壤环境下,宿主不需要通过菌根来增加体内的K含量。有关菌根在辅助宿主于不同K浓度下吸收K的原理,有待进一步的探索研究。可见,菌根真菌Pt可以辅助宿主植株黑松在重金属Cu污染土壤中定植,同时可以有效地促进宿主对营养元素的吸收,促进宿主植株的生长。研究还发现,外生菌根真菌Pt的侵染,减少了逆境胁迫下重金属Cu由地下部分向地上部的转运,提高了宿主重金属Cu耐性,同时通过提高宿主的生物量,提高了重金属在植物体内的总含量,从而提高污染土壤中重金属的植物提取效率,在辅助植物修复重金属Cu污染土壤应用中表现出积极的作用。
土壤重金属总量与其生物有效态、生物效应间关系比较复杂。由于元素形态的组成不同,等量重金属在不同地理、生态环境下所表现出的环境生物有效性差异较大,采用总量很难科学评价土壤中重金属的污染水平,因此,生物有效态含量逐渐成为土壤污染评价与风险预测的重要依据。土壤元素生物有效态(Bioavailable Fraction)通常指土壤中生物可吸收的元素形态。Tessier连续提取法中可交换态与碳酸盐结合态之和描述的是重金属在土壤中的生物活性部分的大小[40]。外生菌根真菌的侵染,可以减少土壤中生物有效态,尤其是可交换态的重金属(Cu)含量,从而减少重金属对菌根宿主以及其他植株的毒害,有利于其定植生长。菌根真菌的菌丝体,可以有效地吸附可交换态的金属,同时,其代谢分泌物对可交换态金属离子具有固定作用[41-43],通过这两个途径降低了土壤中可交换态Cu的含量。
接种外生菌根真菌,不仅促进宿主植株对营养元素的吸收,同时降低土壤中可交换态重金属(Cu)的含量,降低了重金属Cu的毒害性,有利于宿主植物以及周边其他植物的定植,在植被的恢复中及生物修复等方面具有一定的应用前景。
4 结论具有一定重金属耐性的外生菌根真菌(Pt),可以辅助宿主植株在重金属Cu污染土壤中定植,同时可以有效地促进宿主对营养元素(Ca、P)的吸收,促进宿主植株的生长。
重金属Cu胁迫下,菌根真菌(Pt)可以通过减少宿主幼苗Cu从地下部分向地上部的转运,减少重金属Cu对宿主的毒害,提高宿主生物量,以增加Cu的吸附量,达到辅助修复重金属Cu污染土壤的目的。
外生菌根真菌Pt的侵染,可以减少土壤中生物有效性的重金属Cu含量,增加残渣态的量,减少重金属Cu对周边植株的毒害,利于其他植物的定植。
| [1] | Diels L, van der Lelie N, Bastiaens L. New developments in treatment of heavy metal contaminated soils. Reviews in Environmental Science and Biotechnology, 2002, 1 (1): 75–82. DOI:10.1023/A:1015188708612 |
| [2] | Muchuweti A, Birkett JW, Chinyanga E, et al. Heavy metal content of vegetables irrigated with mixtures of wastewater and sewage sludge in Zimbabwe :Implications for human health. Agriculture Ecosystems and Environment, 2006, 112 (1): 41–48. DOI:10.1016/j.agee.2005.04.028 |
| [3] | Martin TA, Ruby MV. Review of in situ remediation technologies for lead, zinc, and cadmium in soil. Remediation Journal, 2004, 14 (3): 35–53. DOI:10.1002/(ISSN)1520-6831 |
| [4] | Tandy S, Ammann A, Schulin R, et al. Biodegradation and speciation of residual SS-ethylenediaminedisuccinic acid (EDDS) in soil solution left after soil washing. Environmental Pollution, 2006, 142 (2): 191–199. DOI:10.1016/j.envpol.2005.10.013 |
| [5] | Kalinowski B, Liermann L, Brantley S, et al. X-ray photoelectron evidence for bacteria-enhanced dissolution of hornblende. Geochimica et Cosmochimica Acta, 2000, 64 (8): 1331–1343. DOI:10.1016/S0016-7037(99)00371-3 |
| [6] | Khan AG. Role of soil microbes in the rhizospheres of plants growing on trace metal contaminated soils in phytoremediation. Journal of Trace Elements in Medicine and Biology, 2005, 18 (4): 355–364. DOI:10.1016/j.jtemb.2005.02.006 |
| [7] | Rajkumar M, Freitas H. Influence of metal resistant-plant growthpromoting bacteria on the growth of Ricinus communis in soil contaminated with heavy metals. Chemosphere, 2008, 71 (5): 834–842. DOI:10.1016/j.chemosphere.2007.11.038 |
| [8] | Stearns JC, Shah S, Greenberg BM, et al. Tolerance of transgenic canola expressing 1-aminocyclopropane-1-carboxylic acid deaminase to growth inhibition by nickel. Plant Physiology and Biochemistry, 2005, 43 (7): 701–708. DOI:10.1016/j.plaphy.2005.05.010 |
| [9] | Belimov A, Hontzeas N, Safronova V, et al. Cadmium-tolerant plant growth-promoting bacteria associated with the roots of Indian mustard (Brassica juncea L. Czern.). Soil Biology and Biochemistry, 2005, 37 (2): 241–250. DOI:10.1016/j.soilbio.2004.07.033 |
| [10] | Arshad M, Saleem M, Hussain S. Perspectives of bacterial ACC deaminase in phytoremediation. Trends in Biotechnology, 2007, 25 (8): 356–362. DOI:10.1016/j.tibtech.2007.05.005 |
| [11] | Harley JL, Smith SE. Mycorrhizal symbiosis[M]. Academic Press, Inc., 1983. |
| [12] | Sousa NR, Ramos MA, Marques AP, et al. The effect of ectomycorrhizal fungi forming symbiosis with Pinus pinaster seedlings exposed to cadmium. Science of the Total Environment, 2012, 414 (1): 63–67. |
| [13] | Herzog C, Peter M, Pritsch K, et al. Drought and air warming affects abundance and exoenzyme profiles of Cenococcum geophilum associated with Quercus robur, Q. petraea and Q. Pubescens. Plant Biology, 2013, 15 (s1): 230–237. |
| [14] | 温祝桂, 陈亚华. 中国外生菌根真菌研究进展. 生物技术通报, 2013, 1(2): 22–30. |
| [15] | Ma Y, He J, Ma C, et al. Ectomycorrhizas with Paxillus involutus enhance cadmium uptake and tolerance in Populus× canescens. Plant, Cell and Environment, 2014, 37 (3): 627–642. DOI:10.1111/pce.2014.37.issue-3 |
| [16] | Menkis A, Vasiliauskas R, Taylor AFS, et al. Afforestation of abandoned farmland with conifer seedlings inoculated with three ectomycorrhizal fungi—impact on plant performance and ectomycorrhizal community. Mycorrhiza, 2007, 17 (4): 337–348. DOI:10.1007/s00572-007-0110-0 |
| [17] | Ladeyn I, Plassard C, Staunton S. Mycorrhizal association of maritime pine, Pinus pinaster, with Rhizopogon roseolus has contrasting effects on the uptake from soil and root-to-shoot transfer of 137 Cs, 85 Sr and 95m Tc. Journal of Environmental Radioactivity, 2008, 99 (5): 853–863. DOI:10.1016/j.jenvrad.2007.10.012 |
| [18] | Sepehri M, Khodaverdiloo H, Zarei M. Fungi and their role in phytoremediation of heavy metal-contaminated soils[M]. Fungi as Bioremediators; Springer, 2013: 313-345. |
| [19] | Chen Y, Nara K, Wen Z, et al. Growth and photosynthetic responses of ectomycorrhizal pine seedlings exposed to elevated Cu in soils. Mycorrhiza, 2015, 25 (7): 561–571. DOI:10.1007/s00572-015-0629-4 |
| [20] | 陈保冬, 李晓林, 朱永官. 丛枝菌根真菌菌丝体吸附重金属的潜力及特征. 菌物学报, 2005, 24(2): 283–291. |
| [21] | Krupa P. Inhibition of selected heavy metals translocation through mycorrhizal fungi and process dependance on the fungal symbiont. Polish Journal of Environmental Studies, 1997, 6 (2): 35–38. |
| [22] | Joner E, Leyval C. Uptake of 109Cd by roots and hyphae of a Glomus mosseae / Trifolium subterraneum mycorrhiza from soil amended with high and low concentrations of cadmium. New Phytologist, 1997, 135 (2): 353–360. DOI:10.1046/j.1469-8137.1997.00633.x |
| [23] | 申鸿, 刘于, 李晓林, 等. 丛枝菌根真菌 (Glomus caledonium) 对铜污染土壤生物修复机理初探. 植物营养与肥料学报, 2005, 11(2): 199–204. DOI:10.11674/zwyf.2005.0211 |
| [24] | Oudeh M, Khan M, Scullion J. Plant accumulation of potentially toxic elements in sewage sludge as affected by soil organic matter level and mycorrhizal fungi. Environmental Pollution, 2002, 116 (2): 293–300. DOI:10.1016/S0269-7491(01)00128-2 |
| [25] | Morselt AF, Smits WT, Limonard T. Histochemical demonstration of heavy metal tolerance in ectomycorrhizal fungi. Plant and Soil, 1986, 96 (3): 417–420. DOI:10.1007/BF02375146 |
| [26] | Cairney J, Chambers S. Interactions between Pisolithus tinctorius and its hosts :a review of current knowledge. Mycorrhiza, 1997, 7 (3): 117–131. DOI:10.1007/s005720050172 |
| [27] | Dickie AI, Reich PB. Ectomycorrhizal fungal communities at forest edges. Journal of Ecology, 2005, 93 (2): 244–255. DOI:10.1111/jec.2005.93.issue-2 |
| [28] | Gebhardt S, Neubert K, Wöllecke J, et al. Ectomycorrhiza communities of red oak (Quercus rubra L.) of different age in the Lusatian lignite mining district, East Germany. Mycorrhiza, 2007, 17 (4): 279–290. DOI:10.1007/s00572-006-0103-4 |
| [29] | O'Hanlon R, Harrington TJ. Similar taxonomic richness but different communities of ectomycorrhizas in native forests and nonnative plantation forests. Mycorrhiza, 2012, 22 (5): 371–382. DOI:10.1007/s00572-011-0412-0 |
| [30] | 陈梅梅, 陈保冬, 王新军, 等. 不同磷水平土壤接种丛枝菌根真菌对植物生长和养分吸收的影响. 生态学报, 2009, 29(4): 1980–1986. |
| [31] | Bücking H, Liepold E, Ambilwade P. The role of the mycorrhizal symbiosis in nutrient uptake of plants and the regulatory mechanisms underlying these transport processes[M]. Intech Open Access Publisher, 2012. |
| [32] | Kariman K, Barker SJ, Jost R, et al. A novel plant-fungus symbiosis benefits the host without forming mycorrhizal structures. New Phytologist, 2014, 201 (4): 1413–1422. DOI:10.1111/nph.12600 |
| [33] | Kayama M, Yamanaka T. Growth characteristics of ectomycorrhizal seedlings of Quercus glauca, Quercus salicina, and Castanopsis cuspidata planted on acidic soil. Trees, 2014, 28 (2): 569–583. DOI:10.1007/s00468-013-0973-y |
| [34] | Teste FP, Veneklaas EJ, Dixon KW, et al. Complementary plant nutrient-acquisition strategies promote growth of neighbour species. Functional Ecology, 2014, 28 (4): 819–828. DOI:10.1111/fec.2014.28.issue-4 |
| [35] | Toler HD, Morton JB, Cumming JR. Growth and metal accumulation of mycorrhizal sorghum exposed to elevated copper and zinc. Water, Air, and Soil Pollution, 2005, 164 (1-4): 155–172. DOI:10.1007/s11270-005-2718-z |
| [36] | de Andrade SAL, da Silveira APD, Jorge RA, et al. Cadmium accumulation in sunflower plants influenced by arbuscular mycorrhiza. International journal of Phytoremediation, 2008, 10 (1): 1–13. DOI:10.1080/15226510701827002 |
| [37] | Jourand P, Hannibal L, Majorel C, et al. Ectomycorrhizal Pisolithus albus inoculation of Acacia spirorbis and Eucalyptus globulus grown in ultramafic topsoil enhances plant growth and mineral nutrition while limits metal uptake. Journal of Plant Physiology, 2014, 171 (2): 164–172. DOI:10.1016/j.jplph.2013.10.011 |
| [38] | Colpaert JV, Wevers JH, Krznaric E, et al. How metal-tolerant ecotypes of ectomycorrhizal fungi protect plants from heavy metal pollution. Annals of Forest Science, 2011, 68 (1): 17–24. DOI:10.1007/s13595-010-0003-9 |
| [39] | Roy S, Khasa DP, Greer CW. Combining alders, frankiae, and mycorrhizae for the revegetation and remediation of contaminated ecosystems. Botany, 2007, 85 (3): 237–251. |
| [40] | Gonzalez-Chavez M, Carrillo-Gonzalez R, Wright S, et al. The role of glomalin, a protein produced by arbuscular mycorrhizal fungi, in sequestering potentially toxic elements. Environmental Pollution, 2004, 130 (3): 317–323. DOI:10.1016/j.envpol.2004.01.004 |
| [41] | Gonzalez-Guerrero M, Melville LH, Ferrol N, et al. Ultrastructural localization of heavy metals in the extraradical mycelium and spores of the arbuscular mycorrhizal fungus Glomus intraradices. Canadian Journal of Microbiology, 2008, 54 (2): 103–110. DOI:10.1139/W07-119 |
| [42] | Krupa P, Kozdrój J. Ectomycorrhizal fungi and associated bacteria provide protection against heavy metals in inoculated pine (Pinus sylvestris L.) seedlings. Water, Air, and Soil Pollution, 2007, 182 (1-4): 83–90. DOI:10.1007/s11270-006-9323-7 |
| [43] | Acosta J, Faz A, Kalbitz K, et al. Partitioning of heavy metals over different chemical fraction in street dust of Murcia (Spain) as a basis for risk assessment. Journal of Geochemical Exploration, 2014, 144 (part B): 298–305. |