2. 海南大学环境与植物保护学院,海口 570228
2. College of Environment and Plant Protection, Hainan University, Haikou 570228
木薯(Manihot esculenta Crantz)亦称树薯,属大戟科木薯属,具有粗生粗长,耐贫瘠、干旱、高产、淀粉含量高等特点[1],是世界8亿人口的主粮和我国热带地区重要的工业原料、饲料、生物质能源和救荒作物,是仅次于水稻、玉米、甘蔗、甘薯的第五大作物,因其可在山地、坡地等随处种植,“不与人争粮,不与粮争地”,在热带地区农民增收方面发挥着极其重要的作用。近年来木薯在热区的种植面积不断增加,并逐渐成为我国热区农业的支柱产业之一[2]。
朱砂叶螨(Tetranychus cinnabarinus Boisduval)是危害木薯最严重的世界危险性害螨,自2005年以来,该螨在广西、广东、海南、云南、江西等地严重发生与成灾,导致当地木薯减产20%-30%,严重危害时可造成减产50%-70%[3],已成为严重制约木薯产业可持续发展的主要因子之一。目前,各木薯产区对于朱砂叶螨的防治仍依赖于化学药剂防治,但朱砂叶螨一般于木薯种植后6-8个月暴发成灾,此时的木薯地已封行很难喷施药剂,同时由于其个体小、繁殖能力强、世代短、发育快等特点,比其他害虫容易产生抗药性,在化防过程中因施药技术落后和药剂难以靶标所致农药的有效利用率不足、使用频率与剂量不断加大导致“3R”等问题日趋严重[4]。因此,寻求新的有效地控制朱砂叶螨的策略和方法成为当前木薯产业发展中亟待解决的重要问题。
当前,培育抗螨木薯是防治朱砂叶螨最经济、有效、简便的方法,而抗螨基因的挖掘及其功能研究是采用分子育种手段获得抗螨木薯的关键[5]。害虫为害寄主作物时,造成的组织创伤会在植物体内产生过量的活性氧自由基,影响其正常生长。而害虫取食寄主植物时摄入的次生代谢物质同样会造成虫体内活性氧的累积,不利于取食为害。多酚氧化酶(Polyphenol oxiclase,PPO)是植物抵御植食性昆虫取食的重要保护酶,在抵御植食性昆虫取食中起关键作用[6]。例如,虫害胁迫的茶树叶片PPO活性增强,对昆虫及其诱发的一系列病害有防御作用[7, 8]。麦长管蚜为害可诱导抗性小麦叶组织中PPO活性显著升高,而敏感种质中却无显著变化[9]。桃蚜为害可诱导甘蓝体内PPO活性的升高,且随桃蚜为害时间的延长而增加。此外,蚜虫为害可诱导辣椒叶组织内PPO活性显著增强,其酶活性增强及与其同工酶谱的稳定性与辣椒抗蚜性显著相关[10]。然而迄今为止,研究者对PPO在木薯抗螨中的作用尚不知晓。本研究拟通过测定朱砂叶螨取食抗螨木薯种质C1115和感螨木薯种质BRA900后,保护酶PPO基因表达量和活性在木薯和朱砂叶螨中的变化情况,初步研究其在木薯种质抗螨中的功能,旨为将其作为基因资源应用于抗螨木薯种质创制奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 供试木薯种质抗螨木薯种质C1115,感螨木薯种质BRA900由中国热带农业科学院热带作物品种资源研究所国家木薯种质资源圃提供。
1.1.2 供试朱砂叶螨饲养参考李迁的方法[11]进行朱砂叶螨的室内饲养。朱砂叶螨为中国热带农业科学院环境与植物保护研究所农业昆虫研究室用健康、生长状况一致的采自田间6个月的面包木薯(感螨品种)叶片连续饲养。饲养条件为:温度28±2℃,相对湿度75 ± 5%光周期14(光):10(暗)。
1.1.3 器材Ultraspec 3000紫外可见光分光光度计(Pharmacia Biotech,Ltd.,Cambridge,UK)、MJ Research PTC-100 PCR仪(MJ Research Inc.)组织匀浆机、高速冷冻离心机、Bio-Rad iCycler & iQ RealTime PCR系统(Bio-Rad,USA)等。
1.1.4 药品配制缓冲液的相关试剂均为国产分析纯试剂,缓冲液按照分子克隆实验指南(第3版)配制。RNA提取及酶活测定相关试剂均购自Sigma公司(Sigma-Aldrich Company,USA)。Trizol试剂盒Invitrogen(Invitrogen Inc. USA),DNase Ⅰ试剂盒,cDNA合成试剂盒,Master mix,MaximaTM SYBR Green qPCR Master Mix试剂盒均为Fermentas公司产品(Fermentas,Glen Burnie,MD)。
1.2 方法 1.2.1 PPO酶液提取及活性测定测定木薯叶片的PPO酶活时,将50头朱砂叶螨雌成螨接种于室内种植3个月的木薯顶芽下方的3张叶片上,分别在取食1 d、8 d后将朱砂叶螨从接种叶片上移除。分别取100 mg接种前、为害1 d、8 d后的叶片组织用于酶活分析。测定朱砂叶螨PPO酶活时,将大约200头朱砂叶螨雌成螨接种于采自田间生长6个月的健康木薯叶片上,并按照1.1.2的方法室内饲养,分别取200头取食前,取食抗、感木薯叶片1 d、8 d后的成螨用于酶活分析。上述各个木薯或朱砂叶螨处理均设置3个重复。PPO活性测定参照参考Lu[12]的方法。在小试管中依次加入0.02 mol/L邻苯二酚溶液0.4 mL,0.05 mol/L pH6.8磷酸缓冲液0.4 mL,酶液0.1mL作为测定管;另外取一个小试管,只加前2种溶液,不用加酶液作为对照管。在30℃下反应2 min,398 nm波长下测OD值。由于在本研究中我们着重关注抗、感螨木薯在受朱砂叶螨为害时,PPO酶活提升以清除活性氧的能力是否存在显著差别,而通过比较为害前后比活力倍数变化的方法更能够凸显出这种差异[12]。
1.2.2 保护酶基因PPO表达量的定量PCR测定木薯叶片和朱砂叶螨的RNA样品采集方法与酶活分析相同。木薯和朱砂叶螨总RNA的提取参照Trizol RNA提取试剂盒进行。总RNA经gDNA Eraser(TaKaRa Biochemicals,Dalian,China)处理去除基因组DNA后,取1.0 μg用于cDNA的合成。cDNA样品经nuclear-free水10倍稀释后作为荧光定量PCR的模板,分别以木薯和朱砂叶螨各自的actin基因为管家基因,相关基因的引物信息如表 1[13]所示。PCR反应条件为:95℃预温育1 min后,以40个循环完成如下程序:95℃变性15 s,60℃退火15 s,72℃延伸20 s。根据Pfaffl[14]的2-ΔΔCt方法计算处理前后PPO基因的相对表达量的变化倍数,以反映木薯或朱砂叶螨应对氧化损伤的转录水平的差异。
1.2.3 数据分析采用SPSS软件进行数据分析,显著性差异分析采用Student’s t-test,所有数据均为3个生物学重复的平均值±标准(x±s),显著性检测水平为P < 0.05。
从图 1可以看出,朱砂叶螨为害前后抗、感木薯种质叶组织中MePPO基因表达量变化存在显著差异。朱砂叶螨取食1 d和8 d后,感螨木薯种质BRA900叶组织中MePPO基因表达量仅分别是为害前的0.99和1.02倍,而抗螨木薯种质C1115叶组织中MePPO的基因表达量分别是为害前的1.78和1.74倍,表明抗螨木薯种质C1115通过显著提高保护酶MePPO的转录水平启动活性氧清除机制,从而较感螨种质BRA900具有更强的抗螨害能力。

|
| 图 1 朱砂叶螨为害前后抗、感螨木薯保护酶MePPO基因表达量变化 木薯种质被朱砂叶螨为害1 d和8 d后基因表达量以为害前的倍数表示。“*”表示MePPO基因表达量在抗、感螨木薯种质上差异显著(Student’s t-test,P<0.05),下同 |
从图 2可以看出,朱砂叶螨为害前后抗、感螨木薯种质叶组织中PPO酶活力存在显著差异。朱砂叶螨取食1 d和8 d后,感螨木薯种质BRA900叶组织中PPO酶活力较为害前提高1.05和1.03倍,而抗螨木薯种质C1115叶组织中PPO酶活力较为害前分别提高1.74和1.72倍,表明木薯叶片中PPO酶活力的变化趋势与基因水平相一致,抗螨木薯种质C1115通过显著提高保护酶PPO的活力启动活性氧清除机制,从而较感螨种质BRA900具有更强的抗螨害能力。

|
| 图 2 朱砂叶螨为害前后抗、感木薯保护酶PPO活性变化 |
从图 3可以看出,取食抗、感螨木薯种质前后朱砂叶螨体内TcPPO基因表达量变化存在显著差异。朱砂叶螨取食感螨木薯种质BRA900 1d,8d后体内保护酶TcPPO的表达量分别是取食前的0.98和0.97倍,而取食抗螨木薯种质C1115 1 d,8 d后TcPPO的表达量降低至取食前的0.52和0.64倍。上述结果表明与取食感螨种质BRA900相比,取食抗螨木薯种质C1115后,朱砂叶螨体内的TcPPO表达受到了显著抑制,不利于其为害抗螨种质C1115。
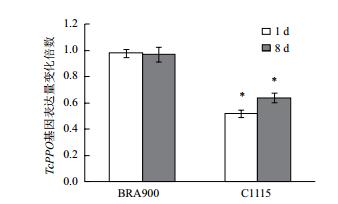
|
| 图 3 取食抗、感木薯种质前后朱砂叶螨体内TcPPO基因表达量变化 |
从图 4可以看出,取食抗、感螨木薯种质前后朱砂叶螨体内PPO酶活力变化存在显著差异。朱砂叶螨取食感螨木薯种质BRA900 1 d,8 d后体内PPO酶活力分别是为害前的0.98和1.10倍,而取食抗螨木薯种质C1115 1 d,8 d后PPO酶活力降低至为害前的0.54和0.57倍。上述结果表明朱砂叶螨取食抗、感螨木薯种质后酶活的变化趋势与基因水平一致,取食抗螨种质C1115后PPO酶活力被显著抑制削弱了朱砂叶螨修复自身氧化损伤能力,不利于其为害抗螨种质C1115。
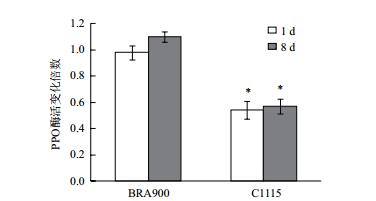
|
| 图 4 取食抗、感木薯种质前后朱砂叶螨体内PPO酶活差异 |
保护酶活性增强能够有效减轻活性氧导致的细胞氧化损伤[15]。多酚氧化酶PPO作为重要的保护酶,不仅可通过清除活性氧而抵御害虫对寄主植物的侵害,还可作为次生代谢途径中的重要酶,调控和影响寄主植物次生代谢物质的产生。例如,PPO能把植物组织中的一些酚类物质氧化成毒性物质[16, 17],从而参与植物防御害虫的反应,增强植物的抗虫性。测定分析寄主植物和害虫互作时PPO基因表达量和酶活力的变化情况将有助于研究PPO在作物抗虫中的功能。
PPO参与植物的防御反应,其基因表达和活性显著升高可有效提高植物抗虫性水平[18-20]。虫害会诱导植物体内PPO基因的过量表达,例如马铃薯和番茄经虫害诱导后,PPO基因可高水平表达,且可受茉莉酮酸酯(JA)的进一步诱导[18]。Franzen[19]等研究表明,蚜虫取食抗性小麦15 d后,包括PPO在内的5个氧化酶基因显著表达,而在敏感小麦种质中却没有表达。虫害同样会导致PPO酶活性的变化。还有研究表明[7-9],茶树、甘蓝和小麦体内PPO活性的显著升高可以形成对茶尺蠖、桃蚜和麦长管蚜的抗性。本研究获得的结果与前人相似,抗螨木薯种质C1115被朱砂叶螨为害1 d、8 d后,MePPO基因表达量较为害前提高幅度较大,并且显著高于感螨种质BRA900受害后的变化水平,而为害1 d和8 d的PPO基因表达量或酶活无显著差异,表明抗螨木薯PPO对螨害的响应快,并且能够长时间维持在较高水平。以上这些结果表明对于抗螨种质C1115,保护酶PPO能够有效缓解朱砂叶螨取食后造成的氧化损伤,从而增强其抗虫性。
害虫取食寄主植物时,害虫体内保护酶PPO被抑制也是形成寄主植物抗虫性的重要因素[21-22]。Krishnan等[21]发现棉贪夜蛾取食番茄后体内PPO的活性显著高于取食半人工饲料,并推断抗氧化酶活性增强是形成其对番茄寄主适应性的主要因素。对森林天幕毒蛾和白斑毒蛾的研究发现[22],寄主植物的单宁酸能够显著抑制中肠抗坏血酸PPO的活性从而形成较强的抗虫能力。本研究中,朱砂叶螨取食抗螨木薯种质C1115 1 d和8 d后,体内PPO的表达量和活性与取食前相比降低幅度较大,并且显著低于取食感螨木薯种质BRA900的对应水平,而取食1 d和8 d的害螨体内PPO基因表达量或酶活无显著差异,表明朱砂叶螨取食抗螨木薯后体内PPO受到长时间持续抑制。以上结果说明抗螨木薯抑制了朱砂叶螨PPO修复自身氧化损伤的功能,不利于被朱砂叶螨为害形成适宜寄主;相反,朱砂叶螨取食感螨木薯种质BRA900后,体内PPO的表达量和活性与取食前相比显著升高,说明朱砂叶螨能够正常启动活性氧清除机制以应对摄入的次生代谢物质造成的氧化损伤,从而易于在感螨木薯上为害。
PPO在木薯和朱砂叶螨中均起到清除活性氧减少氧化损伤的作用。抗螨木薯一方面通过提高自身PPO的活性来抵御螨害造成的植株氧化损伤,另一方面朱砂叶螨取食抗螨木薯后自身的PPO受到了显著抑制,不利于其继续取食为害。因此,PPO在木薯抗螨中的作用是体现在寄主-害螨两个层面的,是两者互作的结果。本研究初步证实保护酶PPO在木薯抗螨中的功能,具有作为有效基因资源应用于抗螨木薯分子育种的应用潜力,但其功能有待进一步研究与验证。
4 结论本研究发现受朱砂叶螨为害后,抗螨木薯种质C1115体内MePPO的基因表达量和PPO酶活较感螨木薯种质BRA900显著提高,而取食抗螨木薯种质C1115后朱砂叶螨体内TcPPO的基因表达量和PPO酶活较取食感螨木薯种质BRA900显著被抑制。
| [1] | Cock JH. Cassava :a basic energy source in the tropics. Science, 1982, 218 (4574): 755–762. DOI:10.1126/science.7134971 |
| [2] | 伍薇, 柯佑鹏. 中国木薯产业发展现状及前景展望. 中国热带农业, 2011, 1(3): 6–9. |
| [3] | 陈青, 卢芙萍, 黄贵修, 等. 木薯害虫普查及其安全性评估. 热带作物学报, 2010, 31(5): 819–827. |
| [4] | Smith CM. Plant resistance to insects[M]. A fundamental approach: John Wiley and Sons Ltd, 1989. |
| [5] | Taylor N, Chavarriaga M, Raemakers K, et al. Development and application of transgenic technologies in cassava. Plant Molecular Biology, 2004, 56 (4): 671–688. DOI:10.1007/s11103-004-4872-x |
| [6] | Felton GW, Donato KK, Broadway RM, et al. Impact of oxidized plant phenolics on the nutritional quality of dietary protein to a noctuid herbivore, Spodoptera exigua. Journal of Insect Physiology, 1992, 38 (4): 277–285. DOI:10.1016/0022-1910(92)90128-Z |
| [7] | Yang ZW, Duan XN, Jin S, et al. Regurgitant derived from the tea geometrid Ectropis obliqua suppresses wound-induced polyphenol oxidases activity in tea plants. Journal of Chemical Ecology, 2013, 39 (6): 744–751. DOI:10.1007/s10886-013-0296-x |
| [8] | 王丹, 陈亮. 茶树对茶尺蠖抗性机制研究. 茶叶科学, 2014, 34(6): 541–547. |
| [9] | Han Y, Wang Y, Bi JL, et al. Constitutive and induced activities of defense-related enzymes in aphid-resistant and aphid-susceptible cultivars of wheat. Journal of Chemical Ecology, 2009, 35 (2): 176–182. DOI:10.1007/s10886-009-9589-5 |
| [10] | 陈青, 张银东. 3种氧化酶与辣椒抗蚜性的相关性. 热带作物学报, 2004, 25(3): 42–46. |
| [11] | 李迁, 卢芙萍, 陈青, 等. 木薯种质对朱砂叶螨的抗性评价. 热带作物学报, 2015, 36(1): 143–151. |
| [12] | Lu FP, Chen Q, Chen ZS, et al. Effects of heat stress on development, reproduction and activities of protective enzymes in Mononychellus mcgregori. Experimental and Applied Acarology, 2014, 63 (2): 267–284. DOI:10.1007/s10493-014-9784-0 |
| [13] | Xu J, Duan X, Yang J, et al. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots. Plant Physiology, 2013, 161 (3): 1517–1528. DOI:10.1104/pp.112.212803 |
| [14] | Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research, 2001, 29 (9): e45–e45. DOI:10.1093/nar/29.9.e45 |
| [15] | Ray PD, Huang BW, Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling. Cell Signal, 2012, 24 (5): 981–990. DOI:10.1016/j.cellsig.2012.01.008 |
| [16] | Marco H, Gregg AH. Host plant-specific remodeling of midgut physiology in the generalist insect herbivore Trichoplusia ni. Insect Biochemistry and Molecular Biology, 2014, 50 (3): 58–67. |
| [17] | Juan MA, Bernardus CJ.Schimmel, Joris JG, et al. Spider mites suppress tomato defenses downstream of jasmonate and salicylate independently of hormonal crosstalk. New Phytologist, 2015, 205 (2): 828–840. DOI:10.1111/nph.13075 |
| [18] | Gregg AH and Georg J. Plant immunity to insect herbivores. Annual Review of Plant Biology, 2008, 59 (1): 41–66. DOI:10.1146/annurev.arplant.59.032607.092825 |
| [19] | Franzen, L D, Gutsche AR, Heng-Moss T, et al. Physiological and biochemical responses of resistant and susceptible wheat to injury by Russian wheat aphid. Journal of Economic Entomology, 2007, 100 (5): 1692–1703. DOI:10.1093/jee/100.5.1692 |
| [20] | 张春妮. 甘蓝苗期对桃蚜抗性的生化机制研究[D]. 杨陵: 西北农林大学, 2005. |
| [21] | Krishnan N, Kodrík D. Antioxidant enzymes in Spodoptera littoralis (Boisduval), are they enhanced to protect gut tissues during oxidative stress. Journal of Insect Physiology, 2006, 52 (1): 11–20. DOI:10.1016/j.jinsphys.2005.08.009 |
| [22] | Barbehenn RV. Gut-based antioxidant enzymes in a polyphagous and a graminivorous grasshopper. Journal of Chemical Ecology, 2002, 28 (7): 1329–1347. DOI:10.1023/A:1016288201110 |





