2. 山西省农业科学院农业资源与经济研究所,太原 030031
2. Institute of Agricultural Resource and Economic, Shanxi Provincial Academy of Agricultural Sciences, Taiyuan 030031
西瓜枯萎病是由西瓜专化型尖孢镰刀菌(F. oxysporum f. sp. niveum)侵染所引起的土传性病害[1, 2],在西瓜种植过程中特别是连作条件下会大规模爆发,减产甚至绝收的情况时有发生,是西瓜产业化发展的瓶颈[3, 4]。利用农药防治植物病害带来的污染和残留问题日益受到重视,而利用功能微生物进行生物防治无污染,无残留,绿色环保,是综合防治植物病害的最有效措施[5-7]。王小慧等[8]筛选到一株类芽胞杆菌将其制成新型生物有机肥,西瓜枯萎病防治率达75%。吴洪生[9]筛选到一株哈茨木霉,将其有机肥(菜子饼发酵产物)混和处理,进行温室条件下西瓜枯萎病的防治实验,防治效果良好。
山西省农业科学院生物技术研究中心微生物研究室经多年实验,从田间分离筛选到一株芽胞杆菌Lh-1。对菌株Lh-1进行了鉴定和抑菌谱检测。在温室条件下进行盆栽防治西瓜枯萎病试验并对各项指标进行检测评价,以期为菌株Lh-1的进一步推广应用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 供试拮抗菌株菌株Lh-1,由山西省农业科学院生物技术研究中心微生物实验室分离保存。
1.1.2 供试病原菌株西瓜枯萎病菌由山西省农业科学院农产品质量安全与检测研究所提供;番茄灰霉病菌、草莓灰霉病菌、黄瓜枯萎病菌、大白菜黑腐病菌和辣椒炭疽病菌由中国微生物菌种保藏管理委员会普通微生物中心提供。
1.1.3 供试土壤试验所用土壤来自山西省农业科学院东阳基地(山西省晋中市)从未种植西瓜的地块(上一季种植玉米)。
1.1.4 供试作物西瓜种子为当地主流品种“京欣”,由山西省农业科学院生物技术研究中心西甜瓜研究室提供。
1.1.5 供试培养基、试剂与肥料PDA培养基、NA培养基、高氏一号培养基、马丁氏培养基与尖孢镰刀菌选择性培养基配方见参考文献[10]。细菌基因组DNA提取试剂盒购自上海生工生物工程有限公司。有机肥由永济市天力生物肥料制造有限公司提供(有机质>30%、N 54 g/kg、P2O5 49 g/kg和K2O 23 g/kg)。
1.2 方法 1.2.1 菌株Lh-1的鉴定对菌株Lh-1进行形态观察及生理生化检测,参考文献[11]。
16S rRNA基因的序列分析:用基因组DNA提取试剂盒提取菌株Lh-1的基因组DNA,以其为模板采用16S rDNA通用引物(24f)AGAGTTTGATCCTGGCTCAG与(1492r)TACGGYTACCTTGTTACGACTT扩增16S rDNA基因片段[12]。PCR反应采用25 μL体系:10×缓冲液2.5 μL;2 μL(25 mmol/L)MgCl2;4 μL(1.25 mmol/L)dNTP;2 μL(100 μmol/L)引物;0.4 μL(5 U/μL)Taq酶;DNA模板1 μL(0.05-1 μg/μL);去离子水13.1 μL。PCR扩增条件:94℃预变性3 min;94℃变性1 min;50℃退火1 min;72℃延伸3min,共30个循环,72℃延伸5 min。PCR扩增序列由上海生工生物工程有限公司进行测序。将测定得到的16S rDNA的序列与NCBI数据库中的相关序列用Clustal X1.8进行比对分析,并利用Mega4.0构建进化树[13, 14]。
1.2.2 菌株Lh-1的抑菌谱测定选择西瓜枯萎病菌、番茄灰霉病菌、草莓灰霉病菌、黄瓜枯萎病菌、大白菜黑腐病菌和辣椒炭疽病菌作为指示病原菌,利用平板对峙培养法检测菌株Lh-1的植物病原菌抑制能力。具体方法:将保藏的植物病原菌进行活化并转接到PDA培养基平板上,用灭菌打孔器(直径5 mm)在病原菌菌落边缘打孔,菌片转接至新的PDA培养基平板中央,30℃静置培养24 h,将菌株Lh-1点接在距离病菌片20 mm处,做4个重复,同时设空白对照(不接种拮抗菌)。28℃静置培养2 d,观察拮抗效果,计算抑菌率[15]。
抑菌率(%)=(对照病原菌直径-对峙拮抗菌的病原菌直径)/对照病原菌直径×100%
1.2.3 防治西瓜枯萎病盆栽实验西瓜枯萎病菌F. oxysporum f. sp. niveum(FON)孢子悬液制备:将FON接种到PDA培养基平板上,30℃,培养5 d。在平板内加入10 mL无菌水,然后收集保存孢子悬液,悬液中FON孢子终浓度为5×106 CFU/mL[16]。Lh-1发酵液制备:向NA液体培养基中接种Lh-1,28℃,200 r/min摇床培养48 h,菌体浓度大于109 CFU/mL。
实验设计:营养钵育苗后移栽盆钵培养,营养钵装土300 g,盆钵装土10 kg,盆钵中按1%(V/W)的接菌量向土壤中接入FON孢子悬液(土壤终浓度>104 CFU/g)。设3个试验组,每组3个小区,试验组各小区随机分布,每个小区20个重复:1)对照组(CK),向土壤中施入化肥;2)试验组1(T1)向土壤中施入有机肥;3)实验组2(T2)向土壤中施入有机肥,按1%(V/W)的接菌量向土壤中接入Lh-1发酵液。其中,有机肥按2%(W/W)的施肥量施入,CK中等量添加化肥,不足的部分以尿素、硫酸钾及过磷酸钙补足。每个营养钵中播种1粒西瓜种子,待瓜苗长出3-4片真叶后移栽,常规管理进行盆栽实验[17]。
1.2.4 评价指标测定西瓜枯萎病病情的调查统计:从各小区出现第一株枯萎病株开始,统计枯萎病的发病情况,西瓜移栽35 d后,计算发病率、病情指数和防治效果。
发病率=发病株数/总重复株数×100%
病情指数计算:0级为整株无症状;1级整株无变黄叶片;2级为1-2个叶片萎蔫;3级为全株>1/3叶片萎蔫;4级为全株>1/2叶片萎蔫;5级为全株>3/4叶片萎蔫或死亡[18]。
DSI=Σ(病害等级×该级对应植株数)/供试植株数
防治率=(对照组发病率-处理组发病率)/对照组发病率×100%
西瓜植株生物量及生理生化检测:西瓜移栽35 d后,每个小区随机选择5株瓜苗,测定植株株高、鲜重及干重,其中干重测量方法为:105℃条件下杀青30 min,75℃条件下烘干至衡重。每株采集5片叶片测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性及丙二醛(MDA)含量,方法参见文献[19]。
西瓜植株根际微生物区系调查:西瓜移栽35 d后,每个小区随机选择5株瓜苗根际土壤,混匀后4℃保存于自封袋内运回。采用梯度稀释法,分别对样品中的细菌、放线菌、真菌和尖孢镰刀菌统计计数[20]。
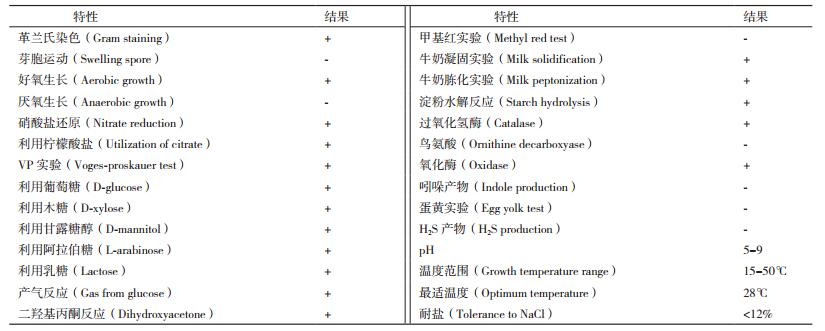
2 结果 2.1 菌株Lh-1的形态特征及生理生化特性菌株Lh-1革兰氏染色呈阳性,菌体为杆状,有鞭毛,具有运动性,好氧生长,可形成内生芽胞,在NA培养基上呈黄褐色不透明菌落,表面褶皱,边缘不规则。菌株Lh-1的各项生理生化指标检测结果如表 1所示。
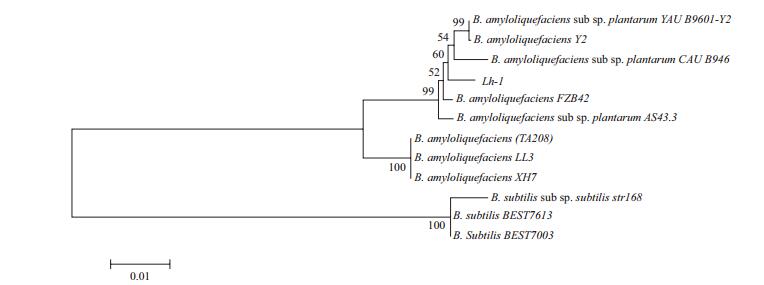
经测序分析菌株Lh-1的16S rDNA的序列长度为1 490 bp。在GenBank数据库中,以16S rDNA序列同源性为基础构建系统发育树(图 1)。如图所示,菌株Lh-1与解淀粉芽胞杆菌聚为一群,具有99%的相似性,综合形态特征与生理生化特性分析,将菌株Lh-1鉴定为解淀粉芽胞杆菌。
|
| 图 1 基于16S rDNA部分序列构建的系统发育树 |
利用平板对峙培养法检测菌株Lh-1的植物病原菌抑制能力。结果(表 2,图 2)显示,解淀粉芽胞杆菌Lh-1对西瓜枯萎病菌、番茄灰霉病菌、草莓灰霉病菌、黄瓜枯萎病菌、大白菜黑腐病菌和辣椒炭疽病菌均具有抑制作用,说明解淀粉芽胞杆菌Lh-1具有广谱抗菌性能。
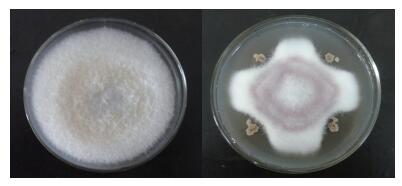
|
| 图 2 解淀粉芽胞杆菌Lh-1拮抗西瓜枯萎病菌 |
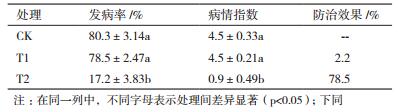
盆栽试验中,不同处理对西瓜枯萎病的防治情况如图 3所示。统计不同处理中西瓜枯萎病的发病率与病情指数可知(表 4),与对照CK相比施加有机肥后瓜苗发病率(78.5%)没有显著降低,病情指数与CK相当;而添加Lh-1的T2与CK相比瓜苗发病率仅为17.2%,病情指数下降3.6,防治效果高达78.5%。T2实验组能显著降低西瓜枯萎病的发病率,防治效果突出。

|
| 图 3 不同处理对西瓜枯萎病的防治效果 |
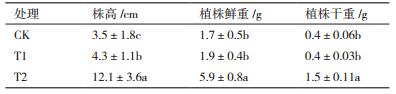
不同处理对瓜苗生物量的影响显著(表 5)。由表可知,T2(添加Lh-1)的生长情况最好,植株高度、鲜重和干重指标均显著高于CK;有机肥处理(T1)次之,但是除株高指标外植株鲜重与干重与CK相比差别不大;而T2处理的各项指标均显著高于T1。
盆栽结果显示(表 6),不同处理间瓜苗抗性相关酶的差异显著。其中,SOD、POD和CAT活性以T2最高,T1次之,CK最低;MDA含量以CK最高,T1与CK相比差别不大,T2明显低于CK。
盆栽试验结果显示(表 7),瓜苗移栽35 d后,T1与T2根际的细菌与放线菌数量与对照相比都有显著提高,其中T1最高,T2次之;T2根际的真菌数量尤其是尖孢镰刀菌数量明显少于T1与CK,而T1与CK相比,差别不大。结果说明,与对照相比添加Lh-1显著改变了瓜苗根际的微生物区系组成,抑制了病原菌尖孢镰刀菌的生长。
根际-土壤中生命活动最为活跃的关键区域,是“土壤-植物”生态系统物质和能量交换的界面,而根际微生物的活动是“土壤-植物”物质和能量循环的重要介质[21]。西瓜枯萎病的爆发,正是由于尖孢镰刀菌激增导致根际微生物区系结构失衡引起的。当根际微生态区系结构越合理,物种越丰富,多样性越高时,植株抵御病害侵染的综合能力就越强[22]。向根际中添加功能微生物可在一定程度上改善微生物区系结构,增加有益微生物,抑制病原微生物,提高微生物群落多样性,提高植物的抗病能力。
本课题组经多年试验筛选到一株对西瓜枯萎病菌具有强烈抑制作用的菌株Lh-1(抑菌率65.25%),经鉴定为解淀粉芽胞杆菌,其在pH5-9,温度15-50℃的范围内均能生长对环境要求不严苛。该菌对西瓜枯萎病菌、番茄灰霉病菌、草莓灰霉病菌、黄瓜枯萎病菌、大白菜黑腐病菌和辣椒炭疽病菌等多种植物病原菌均有拮抗作用,具有广谱抗菌活性。作为一种拮抗功能菌,解淀粉芽胞杆菌可以保护植株免受多种病原菌的侵染。张亮等[23]分离到一株解淀粉芽孢杆菌SR22,该菌具有杆菌溶素基因(bacA)和脂肽基因(srfAA)能有效拮抗番茄枯萎病。Jiang等[24]得到一株解淀粉芽胞杆菌,对细菌性果斑病有显著防治效果。
解淀粉芽胞杆菌Lh-1对西瓜枯萎病的防治效果显著。盆栽实验中,添加Lh-1后发病率仅为17.2%,与对照相比防治效果达到78.5%。解淀粉芽胞杆菌Lh-1对瓜苗的促生作用明显,T2的植株高度、鲜重和干重指标均为最高;许多文献报道有机肥对西瓜等作物也有一定的促生作用[25, 26],但在本实验中,由于添加有机肥后T1的发病率(78.5%)和病情指数(4.5)与CK相比没有明显差异,发病情况较为严重导致在植株高度、鲜重和干重指标上T1与CK没有显著差异。添加Lh-1后瓜苗中的SOD、POD和CAT活性显著提高而MDA含量明显下降,说明瓜苗的抗逆能力显著增强。韦巧婕等[10]通过盆栽实验也证明,施用芽孢杆菌B显著提高黄瓜植株的生物量及其体内SOD、POD及CAT的活性,植株系统抗性明显提高。通过分析瓜苗根际的微生物区系可知,当西瓜枯萎病爆发时,根际微生物区系中的真菌尤其是尖孢镰刀菌显著增加而细菌含量明显下降(表 7),根际微生物区系由“细菌型”向“真菌型”转变[27];而添加Lh-1后细菌与放线菌含量上升,有效抑制了尖孢镰刀菌的数量,瓜苗根际微生物区系结构得到明显改善,植株抗病能力进一步增强。Shen等[28]通过分析连续2年种植香蕉的根际土壤微生物区系结构也得到相同结果。
4 结论本研究对菌株Lh-1进行鉴定、测定了抑菌谱,并通过盆栽试验对其防治西瓜枯萎病的效果进行评价。结果表明添加Lh-1后发病率仅为17.2%,与对照相比防治效果达到78.5%,植株高度、鲜重和干重指标均为最高;瓜苗中的SOD、POD和CAT活性显著提高而MDA含量明显下降;瓜苗根际的微生物区系中细菌与放线菌含量上升,真菌特别是尖孢镰刀菌的数量下降,瓜苗根际微生物区系结构得到明显改善。菌株Lh-1能够有效防治西瓜枯萎病。
| [1] | Faheem M, Raza W, Wei Z, Xu YC. Evaluation of the biocontrol potential of Streptomyces goshikiensis YCXU against Fusarium oxysporum f. sp. niveum. Biological Control, 2015, 81 : 101–110. DOI:10.1016/j.biocontrol.2014.11.012 |
| [2] | 解静, 杨凤丽, 陈丽萍, 等. 施用不同微生物菌肥对设施连作西瓜农艺性状的影响. 浙江农业科学, 2014(11): 1709–1711. DOI:10.3969/j.issn.0528-9017.2014.11.020 |
| [3] | 赵萌, 李敏, 王淼焱, 等. 西瓜连作对土壤主要微生物类群和土壤酶活性的影响. 微生物学通报, 2008, 35(8): 1251–1254. |
| [4] | 郝文雅, 沈其荣, 冉炜, 等. 西瓜和水稻根系分泌物中糖和氨基酸对西瓜枯萎病病原菌生长的影响. 南京:南京农业大学学报, 2011, 34(3): 77–82. |
| [5] | 梁运江, 李伟, 张凤, 等. 保护地连作障碍的生物防治和物理防治方法. 江苏农业科学, 2012(6): 604–605. |
| [6] | Armengol J, Jose CM, Moya MJ, et al. Fusarium solani f sp. cucurbitaerace, a potential pathogen of grafted watermelon production. Spain Bull OEPP, 2000, 30 (2): 179–183. DOI:10.1111/j.1365-2338.2000.tb00875.x |
| [7] | 郎娇娇, 王丽丽, 胡江, 等. 微生物有机肥防治棉花黄萎病机制研究. 土壤学报, 2011, 48(6): 1298–1305. DOI:10.11766/trxb201012130527 |
| [8] | 王小慧, 张国漪, 李蕊, 等. 拮抗菌强化的生物有机肥对西瓜枯萎病的防治作用. 植物营养与肥料学报, 2013, 19(1): 223–231. |
| [9] | 吴洪生. 西瓜连作土传枯萎病微生物生态学机理及其生物防治[D]. 南京: 南京农业大学, 2008. |
| [10] | 韦巧婕, 郑新艳, 邓开英, 等. 黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效. 南京农业大学学报, 2013, 36(1): 40–46. DOI:10.7685/j.issn.1000-2030.2013.01.008 |
| [11] | 冬秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [12] | Wilson KH, Blitchington RB, Greene RC. Amplification of bacterial 16S ribosomal DNA with polymerase chain reaction. Journal of Clinical Microbiology, 1990, 28 (9): 1942–1946. |
| [13] | Zang JC, Luo WD, Meng ZP, et al. Occurrence, damage and comprehensive control of watermelon blight. Plant Prot, 2001, 27 (5): 48–49. |
| [14] | 黄静, 梁宏, 赵佳, 等. 一株拮抗棉花黄萎病的菌株的分离鉴定及诱变选育. 中国农业信息, 2015, 11: 53–54. DOI:10.3969/j.issn.1672-0423.2015.01.050 |
| [15] | 纪莉景, 王连生, 栗秋生, 等. 西瓜枯萎病菌分离及致病力测定. 河北农业科学, 2010, 14(8): 137–149. |
| [16] | Anith KN, Radhakrishnan NV, Manomohandas TP. Screening of antagonistic bacteria for biological control of nursery wilt of black pepper. Microbiological Research, 2003, 158 (2): 91–96. DOI:10.1078/0944-5013-00179 |
| [17] | 宋荣浩, 顾卫红, 戴富明, 等. 国外西瓜抗病种质在我国抗病西瓜育种中的应用. 上海农业学报, 2009, 25(1): 124–128. |
| [18] | 王燕华. 上海地区西瓜枯萎病病原菌鉴定. 上海农业学报, 1988, 4(1): 25–29. |
| [19] | 罗佳, 赵爽, 袁玉娟, 等. 施用微生物有机肥对棉花抗病性相关酶活性的影响. 南京农业大学学报, 2011, 34(3): 89–91. DOI:10.7685/j.issn.1000-2030.2011.03.016 |
| [20] | 程凯, 江欢欢, 沈标, 等. 棉花黄萎病拮抗菌的筛选及其生物防治效果. 植物营养与肥料学报, 2011, 17(16): 166–173. |
| [21] | 雷娟利, 寿伟松, 董文其, 等. 抗感枯萎病西瓜根际细菌群落多样性比较. 微生物学通报, 2008, 35(12): 1905–1908. |
| [22] | 赵佳, 孙毅, 梁宏, 等. 现代生物技术在根际微生物群落研究中的应用. 生物技术通报, 2012, 12: 65–70. |
| [23] | 张亮, 王改兰, 段建南, 等. 广谱生防菌对番茄枯萎病的防病效果及其机理. 中国生物防治学报, 2015, 31(6): 897–906. |
| [24] | Jiang CH, Wu F, Yu ZY, et al. Study on screening and antagonistic mechanisms of Bacillus amyloliquefaciens 54 against bacterial fruit blotch (BFB) caused by Acidovorax avenae subsp. citrulli. Microbiological Research, 2015, 170 : 95–104. DOI:10.1016/j.micres.2014.08.009 |
| [25] | 陈巧玲, 胡江, 汪汉成, 等. 生物有机肥对盆栽烟草根际青枯病原菌和短短芽胞杆菌数量的影响. 南京农业大学学报, 2012, 35(1): 75–79. DOI:10.7685/j.issn.1000-2030.2012.01.013 |
| [26] | 朱震, 陈芳, 肖同建, 等. 拮抗菌生物有机肥对番茄根结线虫的防治作用. 应用生态学报, 2011, 22(4): 1033–1035. |
| [27] | Xu Z, Shao J, Li B, et al. Contribution of bacillomycin D in Bacillus amyloliquefaciens SQR9 to antifungal activity and biofilmformation. Applied and Environmental Microbiology, 2013, 79 (3): 808–815. DOI:10.1128/AEM.02645-12 |
| [28] | Shen Z, Ruan Y, Chao X, et al. Rhizosphere microbial community manipulated by 2 years of consecutive biofertilizer application associated with banana Fusarium wilt disease suppression. Biology and Fertility of Soils, 2015, 51 : 553–562. DOI:10.1007/s00374-015-1002-7 |