5-烯醇式丙酮酰莽草酸-3-磷酸合酶(5-enolpyruvyl-shikimate-3-phosphate synthase,EPSPS)在高等植物莽草酸途经中催化磷酸烯醇式丙酮酸(PEP,phosphoenolpyruvate)和莽草酸-3-磷酸(Shikimate-3-phosphate,S3P)合成的5-烯醇式丙酮莽草酸-3-磷酸(EPSP),是合成芳香族氨基酸(苯丙氨酸、酪氨酸、色氨酸)的前体物质[1-3]。而草甘膦作为磷酸烯醇式丙酮酸(PEP)的结构类似物,可首先与S3P、EPSPS结合形成复合物从而抑制EPSP合成[4-6]。CP4-EPSPS是从土壤农杆菌CP4菌株中克隆的EPSPS基因,美国孟山都公司于1996年将其导入大豆,获得抗草甘膦转基因大豆并实现商业化种植[7]。近年来,随着转基因技术的高速发展及成熟,许多科研工作者将CP4-EPSPS作为筛选标记基因与其他目的外源基因一起整合到多种农作物中[8-10],如水稻[11]、玉米[12]、棉花[13]、小麦[14]等。在便于后期筛选的同时也赋予转基因作物具备抗草甘膦特性,方便利用草甘膦消除田间杂草以降低人工成本。
目前,转CP4-EPSPS基因植株的筛选与检测方法多种多样,包括:PCR扩增、Southern blot、Northern blot、ELISA、Western blot、试纸条和抗性筛序等[15],其中最常用的分别是PCR、ELISA、CP4-EPSPS蛋白检测试纸条及草甘膦抗性筛选,这四种方法各有其优缺点,常使初入门的研究工作者难以抉择。本研究以转CP4-EPSPS基因抗草甘膦棉花为材料,以求在此基础上,探索出一种比较方便和准确的CP4-EPSPS转基因植物筛选方法,供本领域的研究人员参考使用。
1 材料与方法 1.1 材料抗草甘膦转CP4-EPSPS基因棉花由本实验室保存,非转基因棉花受体材料R15由山西省农科院运城棉花所焦改丽老师提供。引物由上海生工合成;Taq聚合酶购自北京全式金公司;CP4-EPSPS蛋白ELISA检测试剂盒及检测试纸条购自美国Agdia公司;草甘膦(农达)购自北京拜尔迪公司。
1.2 方法 1.2.1 PCR检测取实验室保存的转CP4-EPSPS基因棉花纯合株系种子,播种3组幼苗,每组成苗50株。利用优化的CTAB法[16],提取转基因棉花幼嫩叶片基因组DNA。以CP4-5'(ATGGCACAAATTAACATGGCACAAGGGATACAAACC)和CP4-3'(TCAGGCAGCCTTCGATCGGAGAGTTCGATCTTCG)分别作为上下游引物扩增CP4-EPSPS目的基因,利用引物NPT-5'(ATGATTGAACAAGATGGATTGCACGCAGGT)和NPT-3'(TCAGAAGAACTCGTCAAGAAGGCGATAGAA)扩增标记基因NPT Ⅱ。1%琼脂糖凝胶电泳检测PCR产物。
1.2.2 酶联免疫吸附测定法取0.1 g幼嫩叶片加200 μL提取缓冲液,钢珠震荡研磨破碎,12 000 r/min离心5 min,抗体包被好的ELISA板每孔加入100 μL上清液,室温下反应1 h,经过多次洗涤,加入酶反应,再次洗涤,最后黑暗条件下显色反应。酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测详细步骤参考Agdia公司说明书,660 nm波长下读取OD值。
1.2.3 试纸条检测法取0.1 g棉花幼嫩叶片于密封研磨袋中研磨,放入试纸条1 min后观察检测结果,CP4-EPSPS抗性试纸条具体使用说明参见Agdia公司说明书。
1.2.4 草甘膦抗性筛选在大田中,分别用0.2%、0.3%、0.4%的草甘膦各喷洒150株CP4-EPSPS转基因棉株幼苗及野生型棉株幼苗(3-5片真叶期),5-7 d后观察棉花叶片颜色及生长受抑制情况。
2 结果 2.1 PCR方法检测结果图 1-A为部分植株PCR结果,由图 1-A可以看出,靶标基因扩增产物(CP4-EPSPS)与阳性对照目的条带大小完全一致。图 1-B为3组棉花幼苗两个靶标基因的扩增结果,CP4-EPSPS靶标基因扩增结果与NPT Ⅱ无明显区别。PCR筛选靶标基因的方法准确性很高,但其耗时较长,工作量大,需要相应的配套设备,不适用于大量样品的筛选鉴定,也不适用于在田间做出快速筛选。

|
| 图 1 PCR筛选结果 A:转基因部分植株PCR电泳结果,1:阴性对照(空白对照);2:WT阴性对照;3:阳性对照(植物表达载体);M:DNA Marker。B:PCR筛选结果转基因阳性统计结果 |
利用ELISA检测试剂盒,对上述经PCR鉴定为阳性的部分转基因棉株进行筛选鉴定,共检测转基因棉株100株和受体野生型棉花材料30株,根据阳性及阴性对照OD660吸光值判断鉴定结果,OD660值大于0.3为被认为阳性植株,OD660值小于0.1为阴性植株。从图 2可以看出,转基因棉花有27株的OD660吸光值大于0.3,有3株OD660的吸光值低于0.1,表现为阴性。ELISA比PCR方法更可信,筛选准确度更高,原因在于ELISA是从蛋白水平检测转基因植株中外源蛋白表达的情况,可将含有CP4-EPSPS基因(PCR检测为阳性)但不表达目标蛋白的植株排除掉。ELISA操作过程较PCR简单,但试剂成本却高于PCR,另外,它比PCR方法更耗时,也需要相应的配套设备。

|
| 图 2 ELISA筛选鉴定结果 A:部分转基因植株ELISA筛选结果。B:相应的OD660吸光值统计结果,D8:阳性对照,D7:阴性对照(R15),其余孔为转基因植株。 |
将ELISA筛选鉴定后的转基因阳性植株97株以及阴性植株3株,分别利用CP4-EPSPS蛋白检测试纸条进行检测,其中阳性植株中试纸条检测为阳性的有95株,有2株及3株阴性植株表现为阴性。试纸条检测结果准确度较ELISA低,操作失误、叶片研磨情况以及试纸条质量等因素都可能会影响检测结果。试纸条法操作简便,适用于在田间做出大规模快速筛选,单人就可完成全部操作,但其检测成本却是所有方法中最高的。国产CP4-EPSPS蛋白检测试纸条价格比较低,但灵敏度也比较低,无法用于本研究中CP4-EPSPS转基因棉株的检测。
2.4 草甘膦抗性筛选结果在大田间分别用不同浓度草甘膦喷施棉花幼苗并观察结果。如表 1,0.4%浓度草甘膦下,棉花受体材料R15所有植株成熟叶片出现大面积坏死斑块,生长点全部枯死;而在转基因植株中,有极少植株叶片出现小面积坏死枯斑且生长点枯死的情况,约占到全部检测植株的6%。喷洒0.2%浓度草甘膦,转基因植株全部成活,但棉花受体植株中也有约34%的比率能存活下来,对低浓度草甘膦也表现出一定的抗性。在喷洒0.3%浓度草甘膦下,转基因棉株有4%的顶端枯死情况发生,但野生型棉花植株的存活率也比较低(图 3)。草甘膦抗性筛选因植物不同需要事先确定合适的喷洒浓度,它的准确率在上述4种筛选鉴定方法中是最低的,容易出现漏选和假阳性的现象,但因其操作简单且成本极低,特别适合大田抗草甘膦转基因植物的初筛。

|
| 图 3 0.3%草甘膦浓度喷洒棉株7d后表现 A为野生型棉株;B为转CP4-EPSPS基因棉株 |
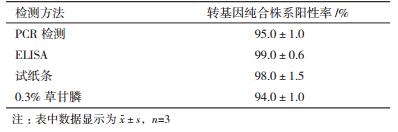
在大田内播种CP4-EPSPS转基因棉花纯合株系300棵棉苗,每百棵随机分配为一个处理。待棉苗长至4叶期,分别用上述4种方法检测并比较其阳性检出率,鉴定结果见表 2。由表 2可以看出,ELISA、试纸条筛选结果显著高于PCR、0.3%草甘膦(P < 0.05),但ELISA与试纸条筛选结果没有显著差异(P=0.095),由于ELISA操作复杂建议采用试纸条检测,若考虑检测成本可先喷洒0.3%草甘膦再结合试纸条进行筛选。
转基因植物后期筛选鉴定是转基因作物新品种培育中最关键的环节,为便于转基因植株的筛选,研究人员在导入目的基因的同时,通常也会导入其他选择标记基因,其中最常用的就是抗草甘膦基因CP4-EPSPS,在后期筛选时可利用一定浓度的草甘膦筛选转基因阳性植株,方便快捷。但是本研究发现简单的草甘膦抗性筛选不能得到准确结果,可能存在假阳性或漏选的转基因阳性植株。本文以获得的CP4-EPSPS转基因棉花为材料,对4种转基因鉴定方法进行了比较分析,我们发现,若在实验室内检测少量样品,推荐使用PCR方法,它操作方便、耗时短且准确性较高,出现假阳性的几率很低,一般不会丢失转基因阳性植株[17]。ELISA方法比PCR更加准确,它不仅能筛选出阳性转基因植株,而且能够将虽含有目标基因但却不表达的植株淘汰出局,这对于转基因植株生物学性状的稳定遗传具有十分重要的意义[18]。ELISA方法的缺点是成本比较高、耗时长,需配套使用相应的设备。
当面对田间的大规模筛选鉴定时,草甘膦抗性筛选就成为一个不二的选择,它不仅操作简便,而且成本极低[10],但草甘膦抗性筛选存在着一定的局限性,首先要确定工作浓度进行预处理,太高会使部分转基因植株失去抗性,太低则假阳性出现的几率会非常高,另外,阳光、温度等也会对筛选结果产生非常大的影响,如在高温下,同浓度的草甘膦致死率就比较高。若不考虑成本的话,可以选择CP4-EPSPS蛋白检测试纸条,它不仅准确,而且快速,单人就可在短时间内完成大规模的田间检测工作,试纸条检测方法的缺点是成本比较高。
4 结论综合上述4种检测方法的优缺点,我们建议将草甘膦抗性与试纸条检测方法结合起来使用,首先通过草甘膦抗性进行大规模初选,然后再用试纸条对表现草甘膦抗性的植株进行抽检,这样不仅能节约研究成本、时间,也能提高检测结果的准确性。
| [1] | Maeda H, Dudareva N. The shikimate pathway and aromatic amino Acid biosynthesis in plants. Annu Rev Plant Biol, 2012, 63 : 73–105. DOI:10.1146/annurev-arplant-042811-105439 |
| [2] | Steinrucken HC, Amrhein N. The herbicide glyphosate is a potent inhibitor of 5-enolpyruvylshikimic acid-3-phosphate synthase. Biochem Biophys Res Commun, 1980, 94 (4): 1207–1212. DOI:10.1016/0006-291X(80)90547-1 |
| [3] | Ghanizadeh H, Harrington KC, James TK, et al. Mechanisms of glyphosate resistance in two perennial ryegrass (Lolium perenne) populations. Pest Manag Sci, 2015, 71 (12): 1617–1622. DOI:10.1002/ps.2015.71.issue-12 |
| [4] | González-Torralva F, Brown AP, Chivasa S. Comparative proteomic analysis of horseweed (Conyza canadensis) biotypes identifies candidate proteins for glyphosate resistance[J]. Sci Rep, 2017 Feb 15;7 :42565. doi:10.1038/srep42565. |
| [5] | Molin WT, Wright AA, Lawton-Rauh A, et al. The unique genomic landscape surrounding the EPSPS gene in glyphosate resistant Amaranthus palmeri :a repetitive path to resistance. BMC Genomics, 2017, 18 (1): 91. DOI:10.1186/s12864-016-3336-4 |
| [6] | Gaines TA, Barker AL, Patterson EL. EPSPS Gene Copy Number and Whole-Plant Glyphosate Resistance Level in Kochia scoparia. PLoS One, 2016, 11 (12): e0168295. DOI:10.1371/journal.pone.0168295 |
| [7] | Harrison LA, Bailey MR, Naylor MW, et al. The expressed protein in glyphosate-tolerant soybean 5-Enolypyruvylshikimate-3-Phosphate synthase from Agrobacterium sp. strain CP4, is rapidly digested in vitro and is not toxic to acutely gavaged mice?. J Nutr, 1996, 126 (3): 728–740. |
| [8] | Marani MM, Costa J, Mafra I, et al. In silico peptide prediction for antibody generation to recognize 5-enolpyruvylshikimate-3-phosphate synthase (EPSPS) in genetically modified organisms. Biopolymers, 2015, 104 (2): 91–100. DOI:10.1002/bip.v104.2 |
| [9] | Yin KF, Liu AR, Li SG, Li Mi, et al. Construction of iron-polymergraphene nanocomposites with low nonspecific adsorption and strong quenching ability for competitive immunofluorescent detection of biomarkers in GM crops. Biosens Bioelectron, 2017, 90 : 321–328. DOI:10.1016/j.bios.2016.11.070 |
| [10] | 王文治, 杨本鹏, 蔡文伟, 等. 抗除草剂bar基因与EPSPS基因在转基因甘蔗中的应用研究. 生物技术通报, 2016, 32(3): 73–78. |
| [11] | Chhapekar S, Raghavendrarao S, Pavan G, et al. Transgenic rice expressing a codon-modified synthetic CP4-EPSPS confers tolerance to broad-spectrum herbicide, glyphosate. Plant Cell Rep, 2015, 34 (5): 721–731. DOI:10.1007/s00299-014-1732-2 |
| [12] | Howe AR, Gasser CS, Brown SM, et al. Glyphosate as a selective agent for the production of fertile transgenic maize (Zea mays L.) plant. Mol Breeding, 2002, 10 (3): 453–164. |
| [13] | Zhao FY, Li YF, Xu P, et al. Agrobacterium-mediated transformation of cotton (Gossypium hirsutum L. cv. Zhongmian 35) using glyphosate as a selectable marker. Biotechnol Lett, 2006, 28 (15): 1199–1207. DOI:10.1007/s10529-006-9078-7 |
| [14] | Zhou H, Arrowsmith JW, Fromm ME, et al. Glyphosatetolerant CP4 and GOX genes as a selectable marker in wheat transformation. Plant Cell Reports, 1995, 15 (3-4): 159–163. DOI:10.1007/BF00193711 |
| [15] | 刘建强, 孙仲序, 赵春芝. 转基因植物鉴定方法的研究概况. 山东林业科技, 2002, 5: 39–43. DOI:10.3969/j.issn.1002-2724.2002.01.020 |
| [16] | Paterson HA, Brubaker LC, Wendel FJ. A rapid method for extraction of cotton (Gossypium spp.) genomic DNA suitable for RFLP or PCR analysis. Plant Mol Biol Reptr, 1993, 11 : 122–127. DOI:10.1007/BF02670470 |
| [17] | 盖树鹏, 孟祥栋. 转基因植物的筛选与检测. 山东农业大学学报:自然科学版, 2000, 31(1): 95–100. |
| [18] | Kamle S, Ojha A, Kumar A. Development of enzyme-linked immunosorbent assay for the detection of Bt protein in transgenic cotton. Methods Mol Biol, 2013, 958 : 131–138. DOI:10.1007/978-1-62703-212-4 |