2. 郑州大学细胞生物研究室,郑州450008;
3. 河南省中医药研究院,郑州 450004
2. Laboratory for Cell Biology of Zhengzhou University, Zhengzhou 450008;
3. Henan Province Chinese Medicine Research Institute, Zhengzhou 450004
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)通过选择性降解目标底物来调节细胞内许多蛋白的稳定,在细胞内参与维持蛋白平衡和细胞活性,参与细胞周期的调控、凋亡、信号传导及病毒感染等[1, 2]。UPS是一个由多个亚基组成的降解复合体,由泛素结合体系和26S蛋白酶体两部分组成,底物蛋白的泛素化是被蛋白酶体降解的一个标志[3]。26S蛋白酶体由一个20S核心颗粒(core particle,CP)和两个19S调节颗粒(regulatory particle,RP)构成,可将泛素标记的蛋白水解成小的肽段。20S CP中含有蛋白水解活性位点,是蛋白酶体的降解部位,19S RP作为多泛素化蛋白的受体位于20S CP的两端,具有筛选泛素化底物并使其进入20S CP的作用[4]。
19S RP中有4个去泛素化酶亚基来调控泛素标记底物的降解,分别为USP14、UCHL5/Uch37、PSMD14/RPN11和PSMD7/RPN8[5],其中PSMD14和PSMD7属于JAMM家族的去泛素化酶位于19S RP的lid中[6]。组织结构学研究表明,19S RP的lid亚复合体由9个亚基组成,PSMD7位于中央核心位置[7],说明PSMD7在形成19S蛋白酶体lid亚复合体中起重要的作用,然而它在细胞内的具体功能尚不完全清楚。
纤毛/鞭毛是进化上保守的具有特殊功能的细胞器,来源于细胞质膜下的基体向上突出于细胞表面。实质上纤毛和鞭毛的结构基本相同:均由微管蛋白的轴丝及其外部包裹的与细胞膜相连的纤毛膜组成[8]。在鞭毛的解聚过程中,远端的鞭毛蛋白被泛素化标记,通过IFT机制运输至基体而被蛋白酶体降解[9]。前期实验中本课题组已用shotgun strategy对盐藻鞭毛蛋白组学进行了分析,发现了大量参与泛素结合过程的蛋白质[10],并且通过酵母双杂交实验证实了盐藻鞭毛相关蛋白KCBP和蛋白酶体亚基PSMD7相互作用,并且蛋白酶体参与KCBP蛋白的降解[11, 12]。作为蛋白酶体19S RP的lid中的核心蛋白,PSMD7在纤毛/鞭毛解聚后的表达情况还不清楚,因此本文通过3-异丁基-1-甲基黄嘌呤(IBMX)诱导盐藻鞭毛的解聚,用实时荧光定量PCR检测PSMD7在鞭毛解聚后mRNA的表达变化,同时构建原核表达载体pET28a(+)-PSMD7,利用大肠杆菌BL21(DE3)进行His-PSMD7融合蛋白的表达并进行了蛋白纯化,制备盐藻PSMD7的多克隆抗体,研究PSMD7蛋白在鞭毛解聚后的表达情况,旨在为研究PSMD7生物学功能及其应用奠定基础。
1 材料与方法 1.1 方法 1.1.1 材料与试剂质粒pET28a(+)由本实验室保存;感受态大肠杆菌BL21(DE3)、感受态大肠杆菌DH5α、胶回收试剂盒、蛋白提取试剂盒和Bradford蛋白定量试剂盒购自生工生物工程(上海)股份有限公司;限制性内切酶Nde Ⅰ和Hind Ⅲ、T4 DNA连接酶、蛋白Marker等购自TaKaRa;异丙基β-D-硫代半乳糖苷(IPTG)、3-异丁基-1-甲基黄嘌呤(IBMX)、弗氏完全佐剂(CFA)和弗氏不完全佐剂(IFA)购自Sigma;HisTrap column购自Amersham;AKTA Purifier购自GE;Quant SYBR Green PCR试剂盒购自Qigen。
亲和层析Buffer A:Tris 50 mmol/L(pH 8.0)、NaCl 500 mmol/L、咪唑20 mmol/L;亲和层析Buffer B:Tris 50 mmol/L(pH 8.0)、NaCl 500 mmol/L、咪唑1 mol/L;Hepes缓冲液:Hepes 0.04 mol/L、KCl 0.01 mol/L、CaCl2 0.01 mol/L、NaCl 1 mol/L、山梨醇0.04 mol/L、甘露醇0.04 mol/L,用NaOH调节pH为7.2;鞭毛银染液:将50 mL 5% AgNO3溶液置三角瓶内,缓慢加入5%氨水,直至溶液变为透明即可。
1.1.2 实验动物波尔山羊一只,雄性,体重35 kg,购自河南省郑州大学医学动物实验中心。
1.2 方法 1.2.1 实时荧光定量PCR参照Hirono等[13]的方法用IBMX诱导盐藻鞭毛解聚,操作如下:收集500 mL对数生长期杜氏盐藻细胞,1 200 r/min离心4 min,用无菌培养基清洗3次,将细胞用500 mL含0.1 mol/L IBMX的培养基光照培养诱导鞭毛解聚。分别在诱导后30、60和90 min收集藻体,并用改进的银染法[10]观察盐藻鞭毛解聚后的形态变化。用Trizol法提取盐藻细胞总RNA,琼脂糖凝胶电泳和紫外分光光度计法A260/A280检测所提取RNA的质量和浓度。根据反转录试剂盒说明书合成cDNA,保存于-20℃备用。用Primer Premier 6.0设计一对PSMD7特异性引物(上游引物:ATGGCACCGGCTCCGGACAG,下游引物:ATGACCAGCACTGGAGACAC),同时设计GAPDH引物作为内参(上游引物:CAAGTTCTCCGCCGATGTGA,下游引物:GAACACGCCTGTGCCCTCAA)。先用普通PCR对退火温度、引物浓度和模板浓度等实验条件进行优化,确保PCR产物中没有非特异产物扩增及引物二聚体。然后用Quant SYBR Green PCR试剂盒进行实时荧光定量PCR,反应体系:cDNA模板0.3 µL,上下游引物(10 µmol/L)各0.3 µL,2.5×Real Master Mix 35.7 µL,20×SYBR solution 29.25 µL,H2O 35.15 µL,反应程序为:95℃预变性5 min;95℃ 30 s,58℃ 30 s,72℃ 5 min,共30个循环;72℃ 10 min;4℃终止反应。反应结束后观察扩增曲线和熔解曲线,进行1%琼脂糖凝胶电泳鉴定PCR产物的特异性。所有反应重复3次,采用2-ΔΔCT计算法分析数据[14]。
1.2.2 融合载体pET28a(+)-PSMD7的构建以杜氏盐藻cDNA为模板,设计引物序列,上游引物:5' -AGCCATATGATGGCACCGGCTCCG-3' ;下游引物:5' -CCCAAGCTTTTACTTCTTGCTCTC-3' (下划线分别为Nde Ⅰ和Hind Ⅲ限制性内切酶序列),PCR扩增获得PSMD7基因片段,将PCR产物进行1%琼脂糖凝胶电泳并回收目的片段,目的片段和pMD19-T载体相连转化大肠杆菌DH5α化学感受态细胞,挑取阳性克隆并提取质粒,用Nde Ⅰ和Hind Ⅲ双酶切后进行琼脂糖凝胶电泳,回收PSMD7目的片段与双酶切(Nde Ⅰ和Hind Ⅲ)后的pET28a(+)连接,转化DH5α化学感受态细胞,提取阳性克隆的质粒双酶切鉴定并进行测序。
1.2.3 融合载体的表达将构建成功的融合载体转化大肠杆菌BL21(DE3)细胞,挑取阳性菌落至试管,37℃,220 r/min振荡培养至菌液OD值约0.6。从试管中取200 μL菌液至1.5 mL离心管进行离心(12 000 r/min,1 min),弃上清后菌体冻存于-20℃作为诱导前样品。将菌液分为两管,加入终浓度为0.2 mmol/L的IPTG,分别在37℃下诱导4 h和16℃下诱导8 h,取诱导后上清与沉淀进行SDS-PAGE电泳检测。
1.2.4 融合蛋白的纯化PSMD7原核表达的融合蛋白上带有His标签可用HisTrap column进行纯化。每升菌体加入40 mL Buffer A充分悬浮菌体,超声破碎菌体,振幅为40%,工作6 s间歇6 s,共20 min,然后12 000 r/min离心20 min,上清用0.45 μm滤膜过滤备用。用AKTA Purifier蛋白纯化系统进行融合蛋白的纯化,具体操作如下:将HisTrap column接入系统,设定系统流速为5 mL/min,压限0.25 MPa,先用去离子水清洗柱中的乙醇,接着用Buffer A平衡柱子,然后将样品接入super loop中,每次约50 mL,紫外检测系统显示有吸收峰时便开始收集穿透液,上样结束后用8% Buffer B平衡柱子洗去与HisTrap column结合力较弱的杂蛋白,再用30% Buffer B洗脱目的蛋白并收集洗脱峰,结束后取20 μL洗脱峰蛋白进行SDS-PAGE检测融合蛋白纯度。
1.2.5 山羊抗盐藻PSMD7多克隆抗体的制备为研究盐藻鞭毛解聚后PSMD7蛋白的表达情况,本实验制备了山羊抗盐藻PSMD7多克隆抗体。首先测定纯化后PSMD7的蛋白浓度,与CFA等体积混合,在震荡混合器上剧烈振荡混匀,用超声法短时间充分乳化抗原,功率为200 W,脉冲2 s,间歇59 s,工作5次。首次免疫时用CFA乳化抗原,加强免疫时均采用IFA乳化抗原。免疫程序如下:
波尔山羊免疫方案(图 1):首次免疫:400 μg/0.5 mL+0.5 mL CFA/只;第2次免疫:200 μg/0.5 mL+0.5 mL IFA/只;第3次免疫:200 μg/0.5 mL+0.5 mL IFA /只;第4次免疫:200 μg/0.5 mL+0.5 mL IFA /只;第5次免疫:200 μg/0.5 mL+0.5 mL IFA /只。抗原经颈部皮下注射免疫,其中首次和第2次免疫间隔14 d,其余每次免疫间隔时间均为7 d。第5次免疫7 d后静脉采血检测抗血清滴度。检测前先确定最佳抗原包被浓度,方法为在第3次免疫后耳静脉采血,用间接ELISA法检测抗体滴度,正常山羊血清作为阴性对照。

|
| 图 1 波尔山羊免疫方案 |
分别在IBMX诱导盐藻鞭毛解聚后30、60和90 min收集藻体,用蛋白提取试剂盒提取盐藻蛋白,根据Bradford蛋白质定量试剂盒的说明书测定蛋白浓度。将各组蛋白与5×SDS上样缓冲液按5:1的比例混合,沸水浴10 min使蛋白完全变性,进行SDS-PAGE电泳,电压调至80 V,待溴酚蓝通过浓缩胶后,改用120 V电压继续电泳2-3 h,直至溴酚蓝刚跑出即终止电泳。用Bio-Rad半干式电转仪进行转膜,ECL发光液进行显影,将X胶片放在PVDF膜上曝光,然后进行定影,胶片用扫描仪扫描,目标条带和内参条带的净光密度值用Image J软件进行分析。
2 结果 2.1 融合载体pET28a(+)-PSMD7的构建PCR扩增杜氏盐藻PSMD7基因片段为993 bp,与pMD19-T载体相连转化DH5α化学感受态细胞后,提取阳性克隆质粒,Nde Ⅰ和Hind Ⅲ双酶切后得到2 700 bp和993 bp的两个片段(图 2-A),回收PSMD7目的片段与Nde Ⅰ和Hind Ⅲ双酶切后的pET28a(+)相连构建融合载体,转化大肠杆菌DH5α化学感受态细胞后,质粒的双酶切后结果如图 2-B所示,含有预期大小的片段,测序结果显示为杜氏盐藻PSMD7序列,表明PSMD7融合载体构建成功。

|
| 图 2 pET28a(+)-PSMD7融合载体的构建 A:PSMD7与pMD19-T载体的双酶切图,M:DNA Marker,1:酶切前质粒,2:Nde Ⅰ和Hind Ⅲ双酶切后pMD19-T载体和PSMD7片段。B:PSMD7与pET28a(+)载体的双酶切图,M:DNA Marker,1:酶切前质粒,2:Nde Ⅰ和Hind Ⅲ双酶切后pET28a(+)载体和PSMD7片段 |
将构建成功的融合载体转化大肠杆菌BL21(DE3),加入终浓度为0.2 mmol/L的IPTG进行融合蛋白的诱导表达,分别在37℃下诱导4 h和16℃下诱导8 h。诱导前和诱导后的上清与沉淀进行SDS-PAGE电泳检测。结果如图 3所示,0.2 mmol/L的IPTG在37℃和16℃都能成功诱导融合蛋白His-PSMD7的表达,分子量为36 kD,但表达量存在差异。37℃诱导4 h的His-PSMD7多以包涵体形式存在于沉淀中,而16℃诱导8 h的则多以可溶性蛋白存在于上清中,故选取16℃诱导8 h进行大量表达,为后期抗体的制备提供足够的蛋白。

|
| 图 3 SDS-PAGE检测融合蛋白的表达 M:蛋白Marker;1,4:诱导前;2,3:16℃诱导8 h后的上清和沉淀;5,6:37℃诱导4 h后的上清和沉淀 |
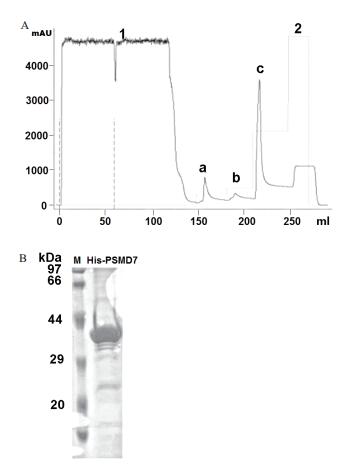
大量诱导融合蛋白的表达后,超声裂解细菌并离心得到大量上清蛋白,用HisTrap column对融合蛋白进行亲和纯化。首先用含20 mmol/L咪唑的Buffer A将收集的上清液打入上样环,分别用6.5%和8% Buffer B洗脱杂蛋白,最后用30% Buffer B从镍柱上洗脱目的蛋白(图 4-A)。SDS-PAGE检测纯化后融合蛋白的纯度,结果显示融合蛋白His-PSMD7纯度较好(图 4-B),经Image J软件灰度分析显示,纯化后融合蛋白的纯度高达为96%,满足了后期抗体制备的要求。
|
| 图 4 融合蛋白His-DsPSMD7的亲和纯化 (A)1:紫外吸收峰;2:Buffer B的梯度洗脱;a:6.5% Buffer B洗脱峰;b:8% Buffer B洗脱峰;c:30% Buffer B洗脱峰;(B)亲和纯化后的融合蛋白 |
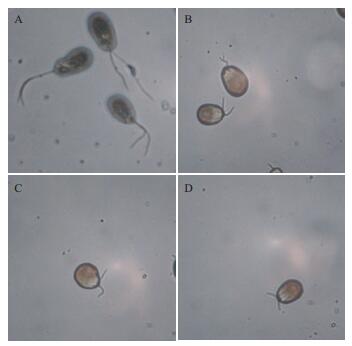
作为19S蛋白酶体中的一个去泛素化酶亚基,PSMD7和鞭毛解聚的关系仍不清楚。本实验用IBMX诱导盐藻鞭毛的解聚,如图 5所示,在IBMX处理后30,60和90 min盐藻鞭毛发生明显缩短。从鞭毛长度变化曲线(图 6)中可以看出,IBMX处理盐藻30 min后,鞭毛长度由~11.0 μm缩短到~7.5 μm,缩短约30%。本研究通过IBMX诱导盐藻鞭毛的解聚来观察PSMD7表达水平的变化,结果显示PSMD7在鞭毛解聚后的mRNA表达量增高,与对照组相比差异显著(P < 0.05),其中在鞭毛解聚后30 min的表达量最高(图 7-A)。本实验用纯化的PSMD7蛋白制备了山羊多克隆抗体,ELISA法检测所制备抗体的滴度高达1:256K-1:512K,Western blots结果显示该抗体可以特异识别PSMD7,说明该抗体效价高、特异性强。从图 7-B和7-C可以看出鞭毛解聚后PSMD7蛋白的表达量增加,其中鞭毛解聚后60 min表达量最高。
|
| 图 5 IBMX诱导盐藻鞭毛的解聚 A:对照组;B、C、D:IBMX诱导鞭毛解聚30、60和90 min |

|
| 图 6 盐藻鞭毛解聚曲线(n=50) |

|
| 图 7 PSMD7在鞭毛解聚过程中的表达 A:实时荧光定量PCR结果,Control:对照组;Disassembly:鞭毛解聚组(*P < 0.05);B和C:Western blot结果 |
泛素结合体系不仅参与植物的免疫应答和非生物胁迫(干旱、低温、盐胁迫)[15-17],而且参与纤毛/鞭毛的解聚[19]。不论是衣藻和盐藻细胞上的鞭毛,还是哺乳动物细胞上的纤毛,都是通过轴丝微管的组装来进行延长,通过轴丝微管的解聚来缩短,纤毛/鞭毛的组装和解聚受细胞周期和外界信号的调节[19]。有研究表明,衣藻的鞭毛中存在着完整的泛素结合系统,包括E1、E2和E3[16]。这些系统在其他可动纤毛和初级纤毛中也都存在,如泛素、E1和E2在线虫、果蝇、小鼠和人类的纤毛蛋白质组都已被鉴定出来[5, 20, 21]。游离的泛素蛋白和泛素结合酶CrUbc13已在衣藻鞭毛中鉴定出来,并且当加入外源泛素和腺苷三磷酸酶的时候,在分离的鞭毛中多个蛋白被泛素化,说明鞭毛中泛素结合体系在发挥作用。此外,在交配的早期泛素结合体系的底物(α-tubulin、dynein亚基IC2、两个参与衣藻交配过程的信号蛋白、依赖环鸟苷酸的激酶和多囊肾离子通道2)泛素化增强,说明泛素化在调节鞭毛信号通路中非常活跃[18],然而有关蛋白酶体是否参与鞭毛的解聚未见报道。
鞭毛的解聚伴随着鞭毛蛋白的降解,鉴于PSMD7在19S蛋白酶体lid结构中的重要位置,我们推测PSMD7表达与鞭毛的解聚有关。杜氏盐藻PSMD7含有331个氨基酸(42-1 034 bp),与莱茵衣藻、拟南芥等其他物种的同源度较高,约为60%,说明PSMD7与26S蛋白酶体的其他亚基一样在进化上高度保守。此外,PSMD7的C末端含有大量带正电的(如赖氨酸)和带负电的(如谷氨酸)氨基酸构成的KEKE基序,这个基序在20S和19S亚基中的多个蛋白中都存在[7]。为了深入研究PSMD7的功能,本文构建了融合表达载体pET28a(+)-PSMD7,在大肠杆菌BL21(DE3)中诱导了PSMD7-His融合蛋白的表达,并用HisTrap column对融合蛋白进行了纯化并制备了多克隆抗体,为后期深入研究PSMD7蛋白的功能奠定了基础。
本实验用0.2 mmol/L IPTG成功诱导了His-PSMD7在BL21(DE3)中的表达。当在37℃下诱导时融合蛋白多为包涵体,而在16℃诱导时则表达的大部分是可溶性蛋白。载体pET28a(+)上含有6×His标签,可以用HisTrap column进行目的蛋白的亲和纯化。亲和层析柱中的填料螯合Ni2+金属离子,带His标签的融合蛋白与Ni2+相互作用被吸附在层析柱上,而杂蛋白可以被洗脱下来。高浓度的咪唑溶液可竞争性与Ni2+结合,使目的蛋白被洗脱下来,从而达到纯化的目的。本实验结果显示His-PSMD7与镍柱的结合非常强,在洗脱过程中当咪唑浓度达到80 mmol/L时,杂蛋白几乎完全被洗脱,再用300 mmol/L咪唑洗脱目的蛋白。经SDS-PAGE检测纯化后的His-PSMD7纯度较高为96%,满足后续制备多克隆抗体的实验要求。本实验利用纯化的PSMD7蛋白和免疫佐剂混合后作为抗原免疫波尔山羊,经过多次免疫后获得了高效价的山羊抗PSMD7蛋白的多克隆抗体,其滴度为1:256K-1:512K,同时Western blot也证实该抗体识别抗原时具有特异性,为后续检测PSMD7蛋白的表达奠定了基础。本实验结果发现鞭毛解聚后PSMD7的表达量增高,其mRNA水平在鞭毛解聚后30 min达到最大值。同时用Western blot检测了鞭毛解聚后PSMD7蛋白的表达情况,结果表明鞭毛解聚后PSMD7蛋白的表达量增高,说明PSMD7参与盐藻鞭毛的解聚。
4 结论成功构建融合表达载体pET28a(+)-PSMD7,用0.2 mmol/L IPTG在16℃诱导8 h可使融合蛋白以可溶形式表达,用HisTrap column亲和纯化得到高纯度的目的蛋白,SDS-PAGE检测结果显示目的蛋白纯度较高,制备的抗体效价高特异性强。鞭毛解聚后PSMD7的mRNA和蛋白的表达水平增高,说明蛋白酶体亚基PSMD7参与鞭毛的解聚。
| [1] | Gate D, Danielpour M, Bannykh S, et al. Characterization of cancer stem cells and primary cilia in medulloblastoma. CNS Neurol Disord Drug Targets, 2015, 14 : 600–611. DOI:10.2174/1871527314666150429113851 |
| [2] | 赵朴, 郑玉姝, 刘兴友. 泛素-蛋白酶体在病毒感染中的作用. 生物技术通报, 2007(6): 48–50. |
| [3] | Walsh CK, Sadanandom A. Ubiquitin chain topology in plant cell signaling:a new facet to an evergreen story. Front Plant Sci, 2014, 5 : 122. |
| [4] | D'Arcy P, Linder S. Proteasome deubiquitinases as novel targets for cancer therapy. Int J Biochem Cell Biol, 2012, 44 (11): 1729–1738. DOI:10.1016/j.biocel.2012.07.011 |
| [5] | Obin M, Lee BY, Meinke G, et al. Ubiquitylation of the transducin betagamma subunit complex. Regulation by phosducin. J Biol Chem, 2002, 277 (46): 44566–44575. DOI:10.1074/jbc.M205308200 |
| [6] | Sowa ME, Bennett EJ, Gygi SP, et al. Defining the human deubiquitinating enzyme interaction landscape. Cell, 2009, 138 (2): 389–403. DOI:10.1016/j.cell.2009.04.042 |
| [7] | Sharon M, Taverner T, Ambroggio XI, et al. Structural organization of the 19S proteasome lid:insights from MS of intact complexes. PLoS Biol, 2006, 4 (8): e267. DOI:10.1371/journal.pbio.0040267 |
| [8] | Fisch C, Dupuis-Williams P. The rebirth of the ultrastructure of cilia and flagella. Biol Aujourdhui, 2011, 205 (4): 245–267. DOI:10.1051/jbio/2011023 |
| [9] | Marshall WF, Rosenbaum JL. Intraflagellar transport balances continuous turnover of outer doublet microtubules:implications for flagellar length control. J Cell Biol, 2001, 155 : 405–414. DOI:10.1083/jcb.200106141 |
| [10] | Jia Y, Xue L, Li J, et al. Isolation and proteomic analysis of the halotolerant alga Dunaliella salina flagella using shotgun strategy. Mol Biol Rep, 2010, 37 (2): 711–716. DOI:10.1007/s11033-009-9563-x |
| [11] | Shi K, Li J, Han K, Jiang H, et al. The degradation of kinesin-like calmodulin binding protein of D. salina(DsKCBP) is mediated by the ubiquitin-proteasome system. Mol Biol Rep, 2013, 40 (4): 3113–3121. DOI:10.1007/s11033-012-2385-2 |
| [12] | 石科.蛋白酶体亚基PSMD7在纤毛/鞭毛解聚及食管癌发生发展中的作用[D].郑州:郑州大学, 2013. |
| [13] | Hirono M, Uryu S, Ohara A, et al. Expression of conventional and unconventional actins in Chlamydomonas reinhardtii upon deflagellation and sexual adhesion. Eukaryot Cell, 2003, 2 (3): 486–493. DOI:10.1128/EC.2.3.486-493.2003 |
| [14] | Livak K, Schmittgen T. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 2001, 25 : 402–408. DOI:10.1006/meth.2001.1262 |
| [15] | 王安邦, 金志强, 刘菊华, 等. 香蕉泛素结合酶基因MaUCE2在非生物胁迫下的表达分析. 生物技术通报, 2013(5): 77–80. |
| [16] | 严金平, 杨华. 泛素化修饰与植物免疫应答. 生物技术通报, 2011(2): 18–22. |
| [17] | 王金利, 史胜青, 贾利强, 等. 植物泛素结合酶E2功能研究进展. 生物技术通报, 2010(4): 7–10. |
| [18] | Huang K, Diener DR, Rosenbaum JL. The ubiquitin conjugation system is involved in the disassembly of cilia and flagella. J Cell Biol, 2009, 186 : 601–613. DOI:10.1083/jcb.200903066 |
| [19] | Hu Z, Liang Y, Meng D, et al. Microtubule-depolymerizing kinesins in the regulation of assembly, disassembly, and length of cilia and flagella. Int Rev Cell Mol Biol, 2015, 317 : 241–265. DOI:10.1016/bs.ircmb.2015.01.008 |
| [20] | Inglis PN, Boroevich KA, Leroux MR. Piecing together a ciliome. Trends Genet, 2006, 22 (9): 491–500. DOI:10.1016/j.tig.2006.07.006 |
| [21] | Lutz MS, Burk RD. Primary cilium formation requires von hippel-lindau gene function in renal-derived cells. Cancer Res, 2006, 66 (14): 6903–6907. DOI:10.1158/0008-5472.CAN-06-0501 |



