半胱氨酸蛋白酶抑制剂(Cystatin,CYS),是一类可逆抑制半胱氨酸蛋白酶的超家族蛋白,广泛存在于动植物体内,其主要功能是与蛋白酶相互制约控制生物体内的多种生理过程,防止体内功能蛋白被外源蛋白酶降解[1, 2]。半胱氨酸蛋白酶抑制剂超家族根据氨基酸序列可分三大家族(Ⅰ、Ⅱ和Ⅲ),其分泌模式、糖基化、磷酸化、结构域、分子量等存在明显差异,但所有半胱氨酸蛋白酶抑制剂都具有QxVxG的基序,这一基序通常位于蛋白序列的中心区域[3-5]。
研究表明,植物半胱氨酸蛋白酶抑制剂在抗虫方面起重要作用,昆虫摄食抑制剂后,消化道蛋白水解酶受到抑制,导致昆虫的非正常发育或死亡[6-10]。除此之外,植物半胱氨酸蛋白酶抑制剂还参与植物生长发育,如种子萌发、幼苗生长、果实成熟以及细胞程序性死亡等[11-14],并在提高植物生物与非生物胁迫抗性方面均发挥重要作用[15-17]。目前,已从多种植物中克隆获得半胱氨酸蛋白酶抑制剂,如拟南芥[6]、水稻[18]、棉花[19]、大豆[20]、烟草[21]和荔枝[22]等,然而在橡胶树中对其研究相对较少。本研究根据已建立的橡胶树转录组及基因组数据库,获得橡胶树半胱氨酸蛋白酶抑制剂cDNA全序列,对基因结构及蛋白理化性质进行生物信息学分析,并运用Q-PCR分析该基因的表达模式,以期为橡胶树半胱氨酸蛋白酶抑制剂基因功能的研究提供理论依据及参考。
1 材料与方法 1.1 材料 1.1.1 材料与试剂在本研究中,多主棒孢霉菌侵染实验所用材料为热研7-33-97组培苗,其他处理实验所用材料为热研7-33-97成龄大树;中国热带农业科学院环境与植物保护研究所为本研究提供多主棒孢菌HccYN57菌种。E.coli JM109菌株由橡胶所胶乳代谢课题组保存。
克隆载体、普通PCR和实时荧光定量PCR试剂,DNA凝胶回收试剂盒,以及限制性内切酶与连接酶、反转录试剂分别购自于大连宝生物公司,爱思进生物技术(杭州)有限公司(AxyGen)及Fermentas公司;英骏生物技术有限公司(Introvigen)完成各类引物合成及克隆测序;其它生化试剂均为进口或国产分析纯试剂。
1.1.2 材料处理橡胶树不同处理(割胶、伤害及激素),以及不同组织(叶片、雄花、雌花、树皮、种子、芽及胶乳)的采集均按照文献[23-26]进行;多主棒孢菌HccYN57侵染参照梁启福等[27]的方法进行。
1.2 方法 1.2.1 HbCYS2基因的分离克隆橡胶树组织总RNA及DNA的提取参照文献[26, 28, 29]。采用Fementas公司反转录试剂盒合成橡胶树cDNA第一链,操作步骤按照公司说明书进行。基因克隆所用引物见表 1。
实时荧光定量PCR技术分析不同组织,以及割胶、伤害、激素、多主棒孢菌等处理下的HbCYS2表达模式,为了提高表达数据的准确性,采用3种不同的内参基因RH2b(DEAD/DEAH box helicase,RH2b)、RH8(DEAD/DEAH box helicase,RH8)及YLS8(mitosis protein YLS8)对样品进行均一化处理,目的基因及内参基因的荧光定量引物见表 1。荧光定量PCR采用罗氏公司LightCycler 2.0系统,采用系统自带软件进行数据处理及分析。
1.2.3 HbCYS2生物信息学分析HbCYS2基因序列分析和比对采用ProtParam tool和DNAMAN5.22软件;利用NCBI蛋白保守数据库(conserved domain database,CDD)分析保守结构域;采用在线软件(Http://web.expasy.org/protparam/)分析氨基酸成分、蛋白分子量、等电点;采用在线软件(Http://ipsort.hgc.jp/和Http://www.cbs.dtu.dk/services/TargetP/)进行信号肽预测和亚细胞定位;采用在线软件(Http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白质跨膜区预测;基因结构分析采用网址Http://gsds.cbi.pku.edu.cn/。
2 结果 2.1 HbCYS2基因克隆与序列分析在前期橡胶树胶乳再生的研究中筛选到一个差异蛋白点,根据质谱后的氨基酸序列,搜索橡胶树转录组数据库,拼接获得1条1 000 bp的核苷酸序列。以橡胶树cDNA为模板进行扩增测序,最终获得1条核苷酸序列949 bp,使用ORF Finder软件分析结果显示,该序列含有长度为687 bp的开放阅读框,以及29 bp的5' 端非编码区(5' UTR)和233 bp的3' 端非编码区(3' UTR);以橡胶树DNA为模板,获得1条5 240 bp的核苷酸序列,经GSDS软件比对cDNA及DNA序列,结果(图 1)显示该基因包含4个外显子和3个内含子。

|
| 图 1 HbCYS2基因结构图 |
HbCYS2基因编码一个由228个氨基酸残基组成的蛋白,分子量约为26.15 kD,理论等电点(pI)为8.87;氨基酸组成分析结果显示,HbCYS2编码蛋白富含亮氨酸Leu(10.1%)和赖氨酸Lys(10.1%),色氨酸Trp(1.8%)和半胱氨酸Cys(0.9%)含量较低。
HbCYS2编码蛋白拥有典型植物半胱氨酸蛋白酶抑制剂的保守N末端,以及由基因复制而引起的重复C末端,共2个CYS结构域:在N端含有3个保守的氨基酸结构域或活性中心元件,第56-65位F-A-R-F-A-V-Q-E-H-N,第73-77位Q-V-V-A-G,第105-114位Y-E-A-K-V-W-V-K-P-W;在C端保守氨基酸结构域第55-66位D-P-E-V-Q-D-A-A-N-H-A-V(图 2)。Blast比对结果表明,该蛋白的氨基酸序列与胡杨(Populus euphratica,XP_011041371),蓖麻(Ricinus communis,EEF36180),甜橙(Citrus sinensis,XP_006482025)和葡萄(Vitis vinifera,XP_002283400)半胱氨酸蛋白酶抑制剂序列一致性分别为67.97%、62.45%、61.40%和60.43%,除此之外,该蛋白序列与前期研究的橡胶树半胱氨酸蛋白酶抑制剂HbCYS1(Hevea brasiliensis)的一致性为50.41%。表明该蛋白为橡胶树半胱氨酸蛋白酶抑制剂家族中的一员,命名为HbCYS2(GenBank:KX161925)。

|
| 图 2 HbCYS2核苷酸及蛋白序列 实线代表信号肽;框格代表N端保守结构域;虚线代表C端保守结构域 |
HbCYS2蛋白N端存在1个由30个氨基酸残基组成的信号肽,肽段分子量约为3.6 kD,TMHMM软件预测HbCYS2第1-6位氨基酸残基为胞内,7-26位为膜上,而27-288位为胞外,根据信号肽类型预测HbCYS2蛋白为分泌型蛋白。
2.3 HbCYS2表达分析橡胶树不同组织表达分析结果(图 3)表明,HbCYS2基因在橡胶树8种组织(芽、叶、种子、老皮、雌花、幼皮、雄花和胶乳)中均被检测到,没有呈现组织表达特异性,在胶乳中的表达丰度最高,雄花和幼皮次之,芽中表达量最低。
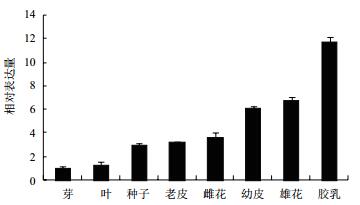
|
| 图 3 HbCYS2基因在橡胶树8种不同组织中的表达丰度 |
未开割树割胶处理,胶乳中HbCYS2基因受割胶调控明显,前3刀中HbCYS2基因表达丰度明显下将,第3刀降至最低点,第4、5刀中表达水平略有回升;伤害处理下,胶乳中HbCYS2基因表达丰度无明显变化,24 h处理后表达量有所下降(图 4)。

|
| 图 4 HbCYS2基因在割胶及伤害处理下的表达模式 |
在6种植物激素或激素类似物处理下,胶乳中HbCYS2基因受ET、GA及2,4-D刺激后呈先下降再上升的趋势,ET及2,4-D处理下3 h表达丰度最低,GA处理下12 h表达丰度最低;相反,JA刺激下该基因在前12 h呈上升趋势并达到峰值,随后在24 h恢复到初始值;ABA及SA刺激下该基因呈下降趋势,均在24 h表达丰度降至最低(图 5)。

|
| 图 5 HbCYS2基因表达对不同激素的响应 |
除此之外,叶片中HbCYS2基因对多主棒孢霉HccYN57侵染应答明显,侵染12 h后表达量明显下降,24 h降至最低值,此后随侵染时间的增加表达水平持续回升(图 6)。

|
| 图 6 多主棒孢菌侵染后HbCYS2基因的表达模式 |
巴西橡胶树(Hevea brasiliensis)为多年生的热带高大乔木,是天然橡胶的主要来源,具有重要的经济价值。在生产中,橡胶树面临多种生物与非生物逆境胁迫,如病害、虫害、风害、寒害及旱害,直接影响橡胶树胶乳产量[30]。植物半胱氨酸蛋白酶抑制剂是重要的组织防御应激蛋白,同时参与植物生长发育的相关调节[31]。本研究通过橡胶树转录组及基因组数据库分离得到HbCYS2,利用生物信息学分析其核苷酸序列,推论该蛋白含有228个氨基酸残基,分子量约为26.15 kD,含有2个CYS结构域,在N端存在典型的保守序列基序(F-A-R-F-A-V-Q-E-H-N,Q-V-V-A-G,Y-E-A-K-V-W-V-K-P-W),C端典型的保守序列基(D-P-E-V-Q-D-A-A-N-H-A-V),除此之外,该蛋白还具有30个氨基酸残基组成的信号肽,且为分泌蛋白,根据上述特征推论HbCYS2属于植物半胱氨酸蛋白酶抑制剂Ⅱ型。Ⅱ型半胱氨基酸蛋白酶抑制剂分子量大约23 kD左右,拥有和Ⅰ型相似的保守N末端以及由基因复制而引起的重复C末端,为二结构域(CYS)分泌蛋白,与前期研究的HbCYS1属于同类型蛋白[32, 33]。对HbCYS1与HbCYS2序列进行比较发现,尽管他们的氨基酸序列一致性不高,但仍可以清晰的辨认出N端的3个保守序列基序,特别是活性中心元件Q-x-V-x-G,进一步说明这些保守结构域可以直接与半胱氨酸蛋白酶的活性中心进行连接,使其催化活性受到破坏[34]。
在橡胶树中,乳管细胞是天然橡胶的合成场所,其胞质(胶乳)是橡胶树生产中的中重要防御组织。橡胶树割胶是一种典型的伤害处理,同时也可以促进胶乳再生与排胶,割胶应答也是橡胶树产胶潜力的重要评价指标[33]。本研究表达分析结果显示,HbCYS2在胶乳中高表达,受割胶调控明显,对伤害处理也产生一定的应答。另外,胶乳中HbCYS2受多种激素调控,特别是橡胶树产量调节剂ET,与割胶应答模式相似。由此推测,胶乳高表达HbCYS2在胶乳再生,以及割胶伤害刺激中发挥一定的应答调控作用。除此之外,叶片中HbCYS2对多主棒孢侵染产生明显应答,参与橡胶树棒孢霉落叶病的防御或抵抗。
4 结论本研究成功分离了橡胶树半胱氨酸蛋白酶抑制剂HbCYS2,具有CYSⅡ型的典型特征,该基因参与橡胶树的胶乳再生调控和病害胁迫应答过程,丰富了橡胶树半胱氨酸蛋白酶抑制剂基因家族,为揭示蛋白酶抑制剂基因家族在橡胶树生长发育、生物与非生物胁迫中的作用提供相关信息。
| [1] | 杨瑞芳. 半胱氨酸蛋白酶抑制剂的研究进展. 世界最新医学信息文摘, 2015, 15(105): 43–44. |
| [2] | 李凤梅, 盖雪梅. 半胱氨酸蛋白酶抑制剂的系统发生分析. 安徽农业科学, 2010, 38(10): 4972–4974. |
| [3] | Turk V, Bode W. The cystatins:protein inhibitors of cysteine proteinases. FEBS Lett, 1991, 285 (2): 213–219. DOI:10.1016/0014-5793(91)80804-C |
| [4] | van Wyk SG, Kunert KJ, Cullis CA, et al. Review:The future of cystatin engineering. Plant Science An International Journal of Experimental Plant Biology, 2016, 246 : 119–127. |
| [5] | Martínez M, Abraham Z, Carbonero P, et al. Comparative phylogenetic analysis of cystatin gene families from arabidopsis, rice and barley. Molecular Genetics & Genomics, 2005, 273 (5): 423–432. |
| [6] | Belenghi B, Acconcia F, Trovato M, et al. AtCYS1, a cystatin from Arabidopsis thaliana, suppresses hypersensitive cell death. European Journal of Biochemistry, 2003, 270 (12): 2593–2604. DOI:10.1046/j.1432-1033.2003.03630.x |
| [7] | Lei JJ, Yang WJ, Yuan SH, et al. Study on transformation of cysteine proteinase inhibitor gene into cabbage (Brassica oleracea var. capitata L.). Acta Horticulturae, 2006, 706 (706): 231–238. |
| [8] | Edith B, Dominique M, Conrad C. Molecular interactions between an insect predator and its herbivore prey on transgenic potato expressing a cysteine proteinase inhibitor from rice. Molecular Ecology, 2003, 12 (9): 2429–2437. DOI:10.1046/j.1365-294X.2003.01918.x |
| [9] | Gholizadeh A. The possible involvement of D-amino acids or their metabolites in Arabidopsis, cysteine proteinase/cystatin-dependent proteolytic pathway. Cytology & Genetics, 2015, 49 (2): 73–79. |
| [10] | Irie K, Hosoyama H, Takeuchi T, et al. Transgenic rice established to express corn cystatin exhibits strong inhibitory activity against insect gut proteinases. Plant Molecular Biology, 1996, 30 (1): 149–157. DOI:10.1007/BF00017809 |
| [11] | Rassam M, Laing WA. Purification and characterization of phytocystatins from kiwifruit cortex and seeds. Phytochemistry, 2004, 65 (1): 19–30. DOI:10.1016/j.phytochem.2003.09.019 |
| [12] | Tan Y, Wang S, Dong L, et al. Genome-wide identification and expression profiling of the cystatin gene family in apple (Malus × domestica, Borkh. Plant Physiology & Biochemistry, 2014, 79 (s 7-8): 88–97. |
| [13] | Zhao P, Zhou X, Zou J, et al. Comprehensive analysis of cystatin family genes suggests their putative functions in sexual reproduction, embryogenesis, and seed formation. Journal of Experimental Botany, 2014, 65 (17): 5093–5107. DOI:10.1093/jxb/eru274 |
| [14] | Hwang JE, Hong JK, Ji HJ, et al. Regulation of seed germination and seedling growth by an Arabidopsis, phytocystatin isoform, AtCYS6. Plant Cell Reports, 2009, 28 (11): 1623–1632. DOI:10.1007/s00299-009-0762-7 |
| [15] | Pernas M, Sánchez-Monge R, Salcedo G. Biotic and abiotic stress can induce cystatin expression in chestnut. Febs Letters, 2000, 467 (2-3): 206–210. DOI:10.1016/S0014-5793(00)01157-1 |
| [16] | Vyver CVD, J?rg Schneidereit, Driscoll S, et al. Oryzacystatin I expression in transformed tobacco produces a conditional growth phenotype and enhances chilling tolerance. Plant Biotechnology Journal, 2003, 1 (2): 101–112. DOI:10.1046/j.1467-7652.2003.00010.x |
| [17] | Papolu PK, Tyagi N, Urwin PE, et al. Expression of a cystatin transgene in eggplant provides resistance to root-knot nematode, Meloidogyne incognita. Front Plant Sci, 2016 . |
| [18] | Wang W, Zhao P, Zhou XM, et al. Genome-wide identification and characterization of cystatin family genes in rice (Oryza sativa L.). Plant Cell Reports, 2015, 34 (9): 1579–1592. DOI:10.1007/s00299-015-1810-0 |
| [19] | 潘正, 李生伟, 陈敏, 等. 棉花半胱氨酸蛋白酶抑制剂基因的克隆、表达与活性研究. 四川大学学报:自然科学版, 2010, 47(6): 1441–1446. |
| [20] | 谢翎, 金正俊, 汪章勋, 等. 大豆CYS家族基因的鉴定、启动子分析及EST表达研究. 大豆科学, 2014, 33(5). |
| [21] | 林世锋, 元野, 任学良, 等. 烟草半胱氨酸蛋白酶抑制剂 (CPI) 基因家族的克隆及组织表达谱分析. 中国烟草学报, 2014(4): 79–87. |
| [22] | 刘兴地, 刘娜, 李明芳, 等. 无核荔枝半胱氨酸蛋白酶抑制剂基因克隆及序列分析. 安徽农业科学, 2012, 40(10): 5782–5785. |
| [23] | Long X, He B, Wang C, et al. Molecular identification and characterization of the pyruvate decarboxylase gene family associated with latex regeneration and stress response in rubber tree. Plant Physiology & Biochemistry, 2014, 87C : 35–44. |
| [24] | Qin Y, Feng S, Tang C. Molecular characterization and expression analysis of cDNAs encoding four Rab and two Arf GTPases in the latex of Hevea brasiliensis. Plant Physiology & Biochemistry, 2011, 49 (7): 729–737. |
| [25] | 何向东, 陆行正, 陈宝三, 等.华南热带作物科学研究院橡胶栽培研究所.橡胶树增产素:中国, 90107763[P]. 1991-02-20. |
| [26] | Tang C, Qi J, Li H, et al. A convenient and efficient protocol for isolating high-quality RNA from latex of Hevea brasiliensis(para rubber tree). J Biochem Biophys Methods, 2007, 70 (5): 749–754. DOI:10.1016/j.jbbm.2007.04.002 |
| [27] | 梁启福, 辛鲁生, 龙翔宇, 等. 橡胶树半胱氨酸蛋白酶基因 (HbCP2和HbCP3) 的克隆与表达分析. 农业生物技术学报, 2014, 22(6): 690–702. |
| [28] | Kiefer E, Heller W, Ernst D. A simple and efficient protocol for isolation of functional RNA from plant tissues rich in secondary metabolites. Plant Mol Biol Rep, 2000, 18 : 33–39. DOI:10.1007/BF02825291 |
| [29] | 黄炎, 郭庆水, 徐立新, 等. 三种天然橡胶树DNA提取方法的比较研究. 安徽农学通报, 2008, 14(7): 53–55. |
| [30] | Long XY, He B, Fang YJ, et al. Identification and characterization of the glucose-6-phosphate dehydrogenase gene family in the Para Rubber Tree, Hevea brasiliensis. Frontiers in Plant Science, 2016, 7 : 215. |
| [31] | Botella MA, Xu Y, Prabha TN, et al. Differential expression of soybean cysteine proteinase inhibitor genes during development and in response to wounding and methyl jasmonate. Plant Physiology, 1996, 112 (3): 1201–1210. DOI:10.1104/pp.112.3.1201 |
| [32] | Christeller JT. Evolutionary mechanisms acting on proteinase inhibitor variability. Febs Journal, 2005, 272 (22): 5710–5722. DOI:10.1111/j.1742-4658.2005.04975.x |
| [33] | 戚继艳, 李和平, 等. 橡胶树cystatin基因HbCYS1的克隆及割胶应答. 热带作物学报, 2011, 32(5): 833–839. |
| [34] | Turk B, Turk V, Turk D. Structural and functional aspects of papain-like cysteine proteinases and their protein inhibitors. Biological Chemistry, 1997, 378 (3-4): 141–150. |





