2. 中国热带农业科学院热带作物品种资源研究所 农业部木薯种质资源保护与利用重点实验室,儋州 571737
2. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory of Conservation and Utilization of Cassava Genetic Resources Ministry of Agriculture, Danzhou 571737
木薯(Manihot esculenta Crantz)是世界上重要的粮食作物,块根可为非洲、亚洲以及中美洲提供粮食安全保障[1]。木薯较其它作物的优势为产量高,抗旱能力强[2]。在热带地区,木薯是继水稻和玉米之后重要的膳食来源,是全世界8亿人的主要食物来源[3]。2014年我国木薯种植面积为38万hm2,鲜薯总产量约780万t;单产约20 t/hm2,离木薯理论产量的90 t/hm2还有很大的增长空间。因此研究影响木薯产量的因素,为进一步提高我国木薯单产提供理论依据是必要的。
木薯基因组高度杂合,后代性状分离严重,还具有自交不亲和、种子数量少等特性,导致杂交选育种效率低,这些特性已经严重阻碍木薯选育高产品种的进程[4]。目前仅依靠传统的杂交育种手段很难快速提高木薯的选育种周期,近年来利用高通量测序技术开展野生木薯近缘种M. esculenta ssp. flabellifolia(W14)与栽培品种M. esculenta ssp. esculenta(KU50)比较基因组学研究,完成了W14和KU50的全基因组草图,注释了碳流、淀粉积累和氢氰酸合成代谢通路关键基因的生物学功能,并成功开发出数百万个全基因组分子标记[5],为选育种提供全基因组的平台。但通过全基因组数据只能间接推测蛋白质的功能,因为从基因表达的mRNA水平到最终合成蛋白质水平,其中包含着蛋白质翻译的调控、糖基化、磷酸化等诸多因素,这些因素都有可能改变作为直接作用因子的蛋白质功能,因而直接研究蛋白质变化具有不可替代的意义[4]。
目前对木薯全蛋白质水平的研究还很不全面,因此本研究选用木薯高产栽培种ZM-Seaside和低产种质花叶变种作为研究材料,从全蛋白质的角度揭示这两个种质块根产量差异的主要原因,挖掘影响木薯产量的关键蛋白质,为选育高产木薯品种提供基础数据。
1 材料与方法 1.1 材料本试验研究材料木薯高产栽培种质ZM-Seaside和低产种质花叶变种均来自中国热带农业科学院热带作物品种资源研究所木薯种质资源圃[6]。以种植10个月后收获的木薯块根作为研究对象。
1.2 方法 1.2.1 产量的测定种植后10个月,测定花叶变种和木薯栽培种ZM-Seaside的单株鲜薯重。每个品种选取15株。
1.2.2 木薯块根淀粉含量的测定淀粉测定采用旋光法[7];应用W ZZ-1型旋光仪测定旋光物的旋光度。按照公式SC=(a×100)×100/(L×203×m)计算木薯的淀粉含量,式中SC为鲜薯粗淀粉含量(%),a为旋光度读数(度),L为观测管长度(2 dm),m为样品质量(g),203为淀粉的比旋光度。
1.2.3 木薯块根氢氰酸含量的测定氢氰酸含量的测定采用硝酸银滴定法[8]。使木薯浸水过夜发酵析出氢氰酸,然后将此溶液通入蒸汽蒸馏出氢氰酸,用过量的硝酸银标准溶液吸收蒸馏出来的氢氰酸,最后以标定好的硫氰化钾滴定多余的硝酸银溶液;由硝酸银用量与剩余硝酸银之差即可算出样品中氢氰酸(HCN)含量。
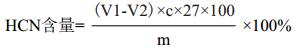
式中,V1为用硫氰化钾滴定25 mL硝酸银时消耗的体积(mL);V2为滴定剩余硝酸银时消耗的体积(mL);c为标准硫氰酸钾的浓度(mol/L);27为氢氰酸的摩尔质量(g/mol);m为木薯样品质量(g)。
1.2.4 木薯块根干物质率的测定根据国际热带农业科学院中心制定的公式计算干物率[9]。取一定质量的鲜薯于烧杯中,放在60℃干燥箱里烘干,大约4-5 d后每天测定重量直至衡重,记录衡重时木薯的重量。干物率=薯干重/鲜薯重
1.2.5 木薯块根蛋白质表达水平的分析利用Western blot方法[10]对3种与淀粉积累相关的蛋白质UGPase(购自Agrisera公司,货号AS05086,分子量:51.6 kD)、AGPase(购自Agrisera公司,货号AS111739,分子量:49.4 kD)和SPS(购自Agrisera公司,货号AS03035A,分子量:120-130 kD)进行表达水平分析,用Actin(购自Agrisera公司,货号AS132640,分子量:45kD)作为对照。利用ChemiImager 4400软件计算蛋白质的相对表达含量。
1.2.6 木薯块根全蛋白质的提取、分离和鉴定木薯ZM-Seaside和花叶变种块根全蛋白质的提取均采用Chen等[11]苯酚提取法,溶解后用Bradford试剂盒进行定量,后参照Chen等[11]双向电泳技术将蛋白质进行分离。以花叶变种块根全蛋白质图谱为对照,采用Delta2D软件确定ZM-Seaside块根的差异蛋白质点,对平均差异表达量在±2.0以上的蛋白质进行标记[12]。蛋白质的鉴定参照An等[2]方法。本研究设3个生物学重复进行数据统计分析。
1.2.7 木薯蛋白质互作网络构建采用String软件对鉴定出的差异蛋白质构建蛋白质互作网络[13]。
1.3 数据统计分析数据处理及统计学分析采用Excel 2010和DPS v7.55软件,差异显著性分析采用新复极差法(Duncan)[14, 15]。
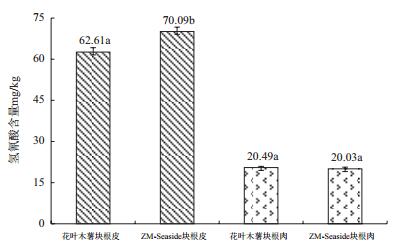
2 结果 2.1 木薯块根氢氰酸含量、淀粉含量及干物率将花叶变种以及ZM-Seaside块根的薯肉跟薯皮分开处理,分别测定它们的氢氰酸含量。结果(图 1)显示,ZM-Seaside块根皮中氢氰酸含量(70.09 mg/kg)要高于花叶变种块根皮(62.61 mg/kg)中的氢氰酸含量,两种木薯块根薯肉的氢氰酸含量均较低,且没有显著差异。同时由图 1可知木薯氢氰酸主要存在于木薯块根皮中,根据NY/T 875规定食用木薯鲜薯薯肉中氢氰酸残留量不能超过50 mg/kg,因此这两种木薯块根均可食用。木薯收获后,测定得到花叶变种粗淀粉含量(25.83%)显著低于ZM-Seaside粗淀粉含量(29.18%)(图 2);两种木薯的干物率为分别为37.16%及40.28%,栽培种ZM-Seaside的干物率显著高于花叶变种。由此可知,栽培种ZM-Seaside淀粉含量和干物率均显著高于花叶变种,进而导致其产量显著高于花叶变种。
|
| 图 1 花叶变种和栽培种ZM-Seaside块根氢氰酸含量 |

|
| 图 2 木薯花叶变种和栽培种ZM-Seaside块根产量相关参数分析 |
本研究利用Western blot方法研究与淀粉积累相关的蛋白质UGPase、AGPase和SPS分别在花叶变种和ZM-Seaside块根的表达水平(图 3)。将Western blot中每一种蛋白质在两个木薯种质中的总量定为100%,计算同一种蛋白质在两个木薯种质间的相对表达量。同时以Actin作为对照,确保两个木薯种质块根的上样量一致(图 3-A)。研究结果表明ZM-Seaside块根UGPase(图 3-B)、SPS(图 3-C)和AGPase(图 3-D)的表达水平显著高于花叶变种(P < 0.05)。该研究结果与木薯块根产量分析结果相一致,因而从与淀粉积累相关蛋白质水平进一步验证2种木薯块根产量的差异。

|
| 图 3 Actin(A)、UGPase(B)、SPS(C)和AGPase(D)分别在花叶变种及ZM-Seaside块根中的表达水平分析 M:蛋白质分子量标准1:ZM-Seaside;2:花叶变种 |
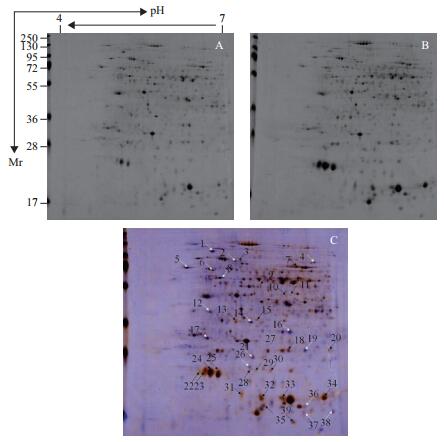
通过苯酚沉淀法提取块根全蛋白质,后经定量以及双向电泳分离、染色后,得到重复性较好的花叶变种及ZM-Seaside块根蛋白质双向电泳图谱(图 4-A和4-B)。以花叶变种为对照,经过Delta 2D软件分析块根的电泳图谱,得到平均差异表达量在2.0倍[11]以上的蛋白质点39个(图 4-C),包括上调表达23个(黑色箭头所指),下调表达16个(白色箭头所指)。通过差异蛋白质点的质谱分析及NCBI数据库搜索比对,成功匹配到其中28个蛋白质(表 1)。
|
| 图 4 花叶变种(A)及ZM-Seaside(B)叶片双向蛋白图谱及其叠加图(C) 黑色箭头表示上调;白色箭头表示下调 |
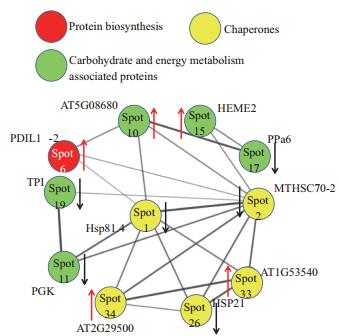
将匹配得到的11个蛋白质通过String在线软件构建蛋白质互作调控网络,由图 5可知11个蛋白质节点共有47种蛋白质互作关系,其中互作最多的蛋白质是Heat shock protein(点2),它同9种蛋白质发生互作;其次是Molecular chaperone Hsp90-1(点1),含7种蛋白质互作关系,且这两种蛋白质均下调。再次是Heat-shock protein(点33,上调),含6种蛋白质互作关系,ATP synthase(点10,上调)、Small heat-shock protein(点26,下调)、18.1 kDa class I heat shock protein(点34,上调)均含4种蛋白质互作关系。Protein disulfide-isomerase(点6,下调)和Phosphoglycerate kinase,putative-R. communis(点11,上调)含3种蛋白质互作关系。Uroporphyrinogen decarboxylase,putative-R. communis(点15,上调)、Putative inorganic pyrophosphatase-Oryza sativa Japonica Group(点17,下调)、Predicted protein -P. trichocarpa(点19,下调)均有2种互作关系。
|
| 图 5 差异蛋白质互作网络的构建 红色箭头表示上调,黑色箭头表示下调。蛋白质节点的连线表示两个蛋白质间的互作,粗线条表示强互作能力 |
在前期研究中已经证明栽培种ZM-Seaside叶片的光合作用要显著优于花叶变种[16],而ZM-Seaside的块根产量、淀粉含量干物质率均显著高于花叶变种。由此可知叶片的光合作用能力能显著影响木薯块根的产量。前期也已经证明花叶变种叶片中与光合作用相关的蛋白质均下调[16],而本研究以花叶变种为对照,证明花叶变种块根中与淀粉积累相关的蛋白点也均下调。UGPase即尿苷二磷酸葡萄糖焦磷酸化酶,1953年由Munch-Petersen、Kalckar和Cutolo在酵母细胞中发现[17, 18]。它催化反应UTP+葡萄糖-1-P生成UDP-葡萄糖+ PPi,而在高等植物中,产物UDPG被发现作为主要的葡萄糖基供体参与蔗糖、糖蛋白、纤维素等许多糖类代谢[19]。吴晓俊等[20]早已在黄芪中发现UGPase是合成多糖的关键酶,在黄芪中总多糖和可溶性多糖积累量均与UGPase的活性呈正相关,相关系数均高于0.9。UGPase被证明与AGPase相偶联形成ADPG,参与淀粉的合成[21, 22]。而AGPase在植物淀粉合成中作为关键的限速酶,催化1-磷酸葡萄糖与ATP作用生成ADPG,为淀粉合成提供葡萄糖基,进而决定作物的产量[23],因而AGPase控制着淀粉的合成[24],是影响作物产量的关键酶。1955年SPS由Leloir和Cardini在小麦胚芽中发现[25]。SPS是以UDPG为供体,以6-磷酸果糖(F-6-P)为受体的糖转移酶,6-磷酸蔗糖在磷酸蔗糖磷酸化酶的作用下脱磷酸并水解形成蔗糖和磷酸根离子[26]。SPS是蔗糖合成过程中的限速酶[27]。蔗糖是高等植物光合作用的主要产物,是碳运输的主要形式,也是“库”代谢的主要基质[28]。Hubbard等[29]证实网纹甜瓜果实蔗糖积累与SPS活性上升相关。这3种与产量相关的主要蛋白质在花叶变种中的下调与花叶变种的低产量结果一致。
以花叶变种为对照,比较栽培种ZM-Seaside块根的全蛋白质变化,成功鉴定出的39个差异蛋白质中,23个上调表达,16个下调表达。同时本研究还利用String在线软件构建差异蛋白质互作的生物调控网络,揭示了块根代谢的调控关系。在整个互作调控网络中热激蛋白Heat shock protein和分子伴侣Molecular chaperone Hsp90-1互作关系最多,这2种蛋白质是伴侣蛋白,伴侣蛋白参与到每一个生命活动中,因此伴侣蛋白的互作关系最多。Carvallo等[30]曾报道他在研究类胡萝卜素的时候发现具有类胡萝卜素复合物和缺失类胡萝卜素复合物的两个品种中鉴定到大量差异伴侣蛋白。以及吕亚等[31]也曾报道研究木薯叶片与光合作用日变化相关的差异蛋白的时候鉴定到大量伴侣蛋白,指出伴侣蛋白参与到各个生命活动中,在各种生命活动中起辅助作用。辅助作用的伴侣蛋白互作关系较多,其次是能量代谢ATP synthase(点10)互作关系最多。ATP用于能量供应,在栽培种ZM-Seaside块根中ATP合成酶的上调表明ZM-Seaside块根整个生命代谢活动旺盛,能量供应充足。因而其产量较花叶变种也高。本研究从蛋白质互作水平揭示了花叶变种块根产量低于ZM-Seaside的分子机理。这几个关键蛋白质有可能成为筛选木薯高产种质的标记蛋白质。后续将进一步通过酵母双杂等技术验证对这几个蛋白的互作水平进行验证。
4 结论本研究通过直接田间测产测定高产种质和低产种质木薯块根的产量,确定两种木薯块根产量有较大差异,进而从全蛋白质水平揭示高产栽培种质ZM-Seaside块根产量显著高于低产种质花叶变种的分子机理。通过蛋白质互作调控网络推测淀粉合成相关蛋白质参与多个代谢途径,它们使各个代谢通路的蛋白质紧密相连,构成一个相互作用的生物调控网络。本研究通过蛋白质互作调控网络筛选出的关键蛋白质有可能成为选育丰产木薯品种的标记蛋白质。
| [1] | Nassar NMA. Wild and indigenous cassava, Manihot esculenta Crantz diversity:An untapped genetic resource. Genetic Resources and Crop Evolution, 2007, 54 (7): 1523–1530. DOI:10.1007/s10722-006-9144-y |
| [2] | An F, Chen T, Stéphanie DMA, et al. Domestication syndrome is investigated by proteomic analysis between cultivated cassava (Manihot esculenta Crantz) and its wild relatives. PLoS One, 2016, 11 (3): e0152154. DOI:10.1371/journal.pone.0152154 |
| [3] | Gomes PTC, Nassar NMA. Cassava interspecific hybrids with increased protein content and improved amino acid profiles. Genetics and Molecular Research, 2013, 12 (2): 1214–1222. DOI:10.4238/2013.April.12.8 |
| [4] | 陈松笔, 安飞飞, 朱文丽, 等. 蛋白质组学在木薯育种中的应用. 生物技术通报, 2015, 31(11): 18–26. |
| [5] | Wang W, Feng B, Xiao J, et al. Cassava genome from a wild ancestor to cultivated varieties. Nat Commun, 2014, 5 : 5110. DOI:10.1038/ncomms6110 |
| [6] | 徐娟, 黄洁. 自然低温条件下木薯种质出苗率和株高的调查评价. 广东农业科学, 2013, 40(1): 16–18. |
| [7] | 陈旭红. 旋光法测定木薯粗淀粉的含量. 食品工业科技, 2000, 21(2): 66–67. |
| [8] | 蒋治国, 何飞燕, 李兴芳. 饲料中氢氰酸含量测定方法的研究. 饲料工业, 2005, 26(22): 47–48. |
| [9] | 安飞飞, 陈松笔, 李庚虎, 等. 华南8号木薯及其四倍体块根淀粉及蛋白表达谱的差异分析. 中国农业科学, 2015, 48(13): 2656–2665. |
| [10] | Li K, Zhu W, Zeng K, et al. Proteome characterization of cassava (Manihot esculenta Crantz) somatic embryos, plantlets and tuberous roots. Proteome Science, 2010, 8 : 10. DOI:10.1186/1477-5956-8-10 |
| [11] | Chen S, Glazer I, Gollop N, et al. Proteomic analysis of the entomopathogenic nematode steinernema feltiae IS-6 IJs under evaporative and osmotic stresses. Molecular and Biochemical Parasitology, 2006, 145 (2): 195–204. DOI:10.1016/j.molbiopara.2005.10.003 |
| [12] | 安飞飞, 凡杰, 李庚虎, 等. 华南8号木薯及其四倍体诱导株系叶片蛋白质组及叶绿素荧光差异分析. 中国农业科学, 2013, 46(19): 3978–3987. |
| [13] | Khan S, Ahmad K, Alshammari EMA. Implication of caspase-3 as a common therapeut target for multineurode generative disorders and its inhibition using nonpeptidyl natural compounds. BioMed Research International, 2015, 175 (2): 235–244. |
| [14] | 李永宏, 黄清臻. 新复极差法在生物统计中的应用. 医学动物防制, 2002, 18(5): 270–272. |
| [15] | 关海宁, 刁小琴, 徐桂花, 等. Duncar新复极差法优化特色"明目"花草茶工艺的研究. 饮料工业, 2010, 13(6): 30–33. |
| [16] | 宋雁超, 姚惠, 吕亚, 等. 花叶木薯变种和木薯栽培种ZM-Seaside叶片光合参数及蛋白组学分析. 植物遗传资源学报, 2016, 17(5): 935–941. |
| [17] | 李健, 古碧, 龙罡, 等. 广西食用木薯淀粉卫生质量检测结果分析. 农业研究与应用, 2014, 3: 41–46. |
| [18] | Munch-Petersen A, Kalckar HM, Cutolo E, et al. Uridyl transferases and the formation of uridine triphosphate; enzymic production of uridine triphosphate:uridine diphosphoglucose pyrophosphorolysis. Nature, 1953, 172 (4388): 1036–1037. DOI:10.1038/1721036a0 |
| [19] | Daran JM, Dallies N, Thines-Sempoux D, et al. Genetic andbiochemical characterizarion of the UGP1 gene encoding theUDP-glucose pyrophosphorylase from Saccharomyces cerevisiae. European of Journal Biochemistry, 1995, 233 (2): 520–530. DOI:10.1111/ejb.1995.233.issue-2 |
| [20] | 吴晓俊, 刘涤, 胡之璧. 尿苷二磷酸葡萄糖焦磷酸化酶. 植物生理学通讯, 2000, 36(3): 193–200. |
| [21] | Eimert K, Villand P, Kilian A, Kleczkowski LA. Cloning and characterization of several cDNAs for UDP-glucose pyrophosphorylase from barley (Hordeum vulgare) tissues. Gene, 1996, 170 (2): 227–232. DOI:10.1016/0378-1119(95)00873-X |
| [22] | Ap Rees T, Leja M, Macdonald FD, Green JH. Nucleotide sugars and starch synthesis in spadix of Arum maculatum and suspension cultures of Glycine max. Phytochemistry, 1984, 23 (11): 2463–2468. DOI:10.1016/S0031-9422(00)84076-5 |
| [23] | 姚庆荣.木薯遗传转化体系的建立与优化及转AGPase基因的研究[D].海口:华南热带农业大学, 2007. |
| [24] | Sweetlove LJ, Müller-Röber B, Willmitzer L, et al. The contribution of adenosine 5' -diphosphoglucose pyrophosphorylase to the control of starch synthesis in potato tubers. Planta, 1999, 209 (3): 330–337. DOI:10.1007/s004250050640 |
| [25] | Leloir LF, Cardini CE. The biosynthesis of sucrose phosphate. Journal of Biological Chemistry, 1955, 214 (1): 157–165. |
| [26] | 刘凌霄, 沈法富, 卢合全, 等. 蔗糖代谢中蔗糖磷酸合成酶 (SPS) 的研究进展. 分子植物育种, 2005, 3(2): 275–281. |
| [27] | 李永庚, 于振文, 姜东, 等. 冬小麦旗叶蔗糖和籽粒淀粉合成动态及与其有关的酶活性的研究. 作物学报, 2001, 27(5): 658–664. |
| [28] | Farrar J, Pollock C, Gallagher J. Sucrose and the integration of metabolism in vascular plants. Plant Science, 2000, 154 (1): 1–11. DOI:10.1016/S0168-9452(99)00260-5 |
| [29] | Hubbard NL, Huber SC, Pharr DM. Sucrose phosphate synthase and acid invertase as determinants of sucrose concentration in developing muskmelon (Cucumis melo L.) fruits. Plant Physiol, 1989, 91 (4): 1527–1534. DOI:10.1104/pp.91.4.1527 |
| [30] | Carvalho LJ, Lippolis J, Chen S, et al. Characterization of carotenoid-protein complexes and gene expression analysis associated with carotenoid sequestration in pigmented cassava (Manihot esculenta Crantz) storage root. Open Biochem J, 2012, 6 : 116–130. DOI:10.2174/1874091X01206010116 |
| [31] | 吕亚, 安飞飞, 宋雁超, 等. 木薯叶片光合作用日变化的差异蛋白分析. 湖南农业大学学报:自然科学版, 2016, 42(3): 256–261. |





