2. 武汉大学生命科学学院,武汉 430072
2. College of Life Science, Wuhan University, Wuhan 430072
所谓细胞程序性死亡(Programmed cell death,PCD)是指细胞在内在或者外在因素的诱导下,通过一系列复杂的调控网络产生特定的死亡信号来控制细胞走向主动死亡的现象。在植物的整个生命周期中包含了营养生长和生殖生长两个连续的过程,在这两个过程中植物细胞PCD都参与其中,例如,导管分子的形成、根冠细胞的更替、叶片的脱落、花器官的发育、糊粉层的降解和胚胎的发生等,此外PCD还涉及到植物抗逆的超敏反应[1]。
众所周知,植物激素在细胞分裂分化,器官形态建成和种子脱水成熟等许多方面扮演着重要的角色。它们是在内部或外部环境的刺激下,通过自身的生理代谢而产生的一类小分子化合物,广泛参与调控植物生长发育的各个方面。目前的研究表明在植物细胞PCD中同样也不乏植物激素的参与。例如,赤霉素(GA)和脱落酸(ABA)作为两种重要的植物激素,对大麦糊粉层细胞的PCD能够产生诱导与抑制作用[2]。经GA处理的糊粉层原生质体能够产生一系列PCD事件,如质膜完整性的丧失,细胞高度液泡化,DNA降解等,而GA信号通路的抑制剂LY83583及ABA则能够抑制PCD的发生[2]。同样在小麦的糊粉层细胞中,GA能够诱导Ca2+/Mg2+依赖的的核酶的表达,而后者可能直接参与了PCD相关的DNA片段化[3]。此外GA对水稻和拟南芥花粉绒毡层PCD的启动也很重要[4]。除了GA,乙烯也是诱导植物细胞PCD的重要激素。在玉米胚乳的发育中,乙烯和ABA的平衡被认为是胚乳细胞PCD正常启动与进行的关键[5]。而在配子成功融合的拟南芥中未接受花粉管的助细胞会在乙烯的调控下执行PCD[6]。同时,乙烯还被发现参与番茄叶片和花的离区细胞的PCD过程,这些组织中与PCD相关的水解酶的表达是由乙烯诱导产生,且可被乙烯的抑制物下调[7]。即使是在导管分子的形成中,除了已知的生长素和细胞分裂素调控途径,油菜素内酯和乙烯也已被证明与导管分子的特化和PCD密切相关[8]。此外,在水稻不定根的发生中,乙烯和GA可参与启动表皮细胞的PCD,ABA则起到拮抗作用[9]。
植物激素对于植物细胞PCD的发生相当重要。尽管有关植物激素参与植物细胞PCD的报道已有不少,但是目前关于植物激素对胚柄细胞PCD的调控作用仍未可知。胚柄细胞的发育与退化是一次非常有意思的PCD事件。精、卵细胞受精后形成合子,合子随后不等分裂产生发育命运完全不同的顶细胞和基细胞。基细胞经过一系列横向分裂产生一纵列细胞,这一纵列细胞就被称为胚柄。虽然胚柄作为一个短命的结构对于胚胎晚期发育毫无作用,但是在胚胎发育早期,它不仅帮助胚胎保持极性,还为胚体提供营养[10, 11]和激素[12-15]。这些营养和激素通过细胞间的物质交换由胚柄进入胚体,从而促进胚体的生长发育[16, 17]。在此之后胚柄细胞借助PCD逐步消亡,以帮助胚胎顺利的形成成熟结构。因此胚柄细胞PCD的有序进行是植物正常发育中不可或缺的一环。
本研究试图通过建立烟草胚珠和胚胎的离体培养体系,以研究外源GA对胚柄细胞PCD的影响。研究中同时使用了两种PCD检测方法:一种是TUNEL检测(terminal deoxynudeotidyl transferases mediated dUTP nick end labeling,TUNEL),也叫作末端脱氧核苷酸转移酶介导的dUTP(脱氧尿苷三磷酸)原位切口末端标记。由于细胞执行PCD的过程中其核基因组DNA会首先发生断裂,因此会产生诸多暴露的3' OH。这些3' OH可以在末端脱氧核苷酸转移酶的催化下加上带有荧光素标记的dUTP,从而可以通过荧光显微镜对细胞是否发生PCD进行检测;另一种对细胞中半胱氨酸蛋白酶(caspase)家族蛋白进行检测。该家族是一类以半胱氨酸作为催化基团,能对底物的天冬氨酸位点进行特异切割的蛋白酶。在细胞PCD的调控途径中,该家族蛋白酶一般处于下游,可影响凋亡小体的形成。通过对上述技术方法的综合应用,本研究可望为全面认识植物细胞PCD的分子机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 植物材料实验所用材料为野生型烟草(Nicotiana tabacum var. SR1),种植于武汉大学温室,光照时间16 h/d,温度25±1℃。
1.1.2 主要试剂常规药品(国药集团化学试剂有限公司),纤维素酶R-10、离析酶R-10(YaKult公司),矿物油、MES、Triton X-100(BIOSHARP公司),微室MILICELL(Millipore公司),DeadEndTM Fluorometric TUNEL System试剂盒(Promega公司)
1.1.3 培养基与酶解液胚珠离体培养基:MS,6%蔗糖,pH 5.8,过滤灭菌。胚胎离体培养基:(1)微室内培养基:MS大量+ Km8P-Vitamin + Km8P-微量+ Km8P-有机+ Km8P-铁盐+ 3 mmol/L MES + 0.5 mg/L NAA + 0.25 mg/L 6-BA,0.5 mol/L蔗糖,pH5.8,过滤灭菌;(2)微室外培养基:MS大量+ Km8P-Vitamin + Km8P-微量+ Km8P-有机+ Km8P-铁盐+ 3 mmol/L MES,0.5 mol/L蔗糖,pH5.8,过滤灭菌。酶解液:1%纤维素酶,0.8%离析酶,11%甘露醇,pH5.8,过滤灭菌。
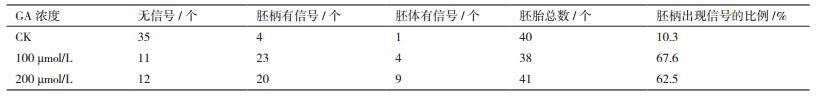
1.2 方法 1.2.1 烟草胚珠离体培养取人工授粉96 h的烟草子房(合子时期),75%酒精消毒10 min,无菌水清洗3次,每次5 min。使用无菌牙签剥开子房表皮,将胚珠挑至预先放置有胚珠培养基和GA的培养皿中,25℃暗培养后进行观察。
1.2.2 烟草胚胎离体培养取人工授粉132 h的烟草子房(8胞胚时期)用于分离胚胎,75%酒精消毒10 min,无菌水清洗3次,每次5 min。使用无菌牙签剥开子房表皮,将胚珠从子房挑至无菌酶解液中,28℃酶解30 min。利用酶解时间在Φ3.5 cm的培养皿中加入室外培养基,再将微室MILICELL置于培养皿中央,在微室MILICELL中加入室内培养基。待酶解完成后,分离烟草胚胎转入微室MILICELL中。再取人工授粉144 h的烟草子房(16胞胚时期)用于分离胚珠做饲养物,75%酒精消毒10 min,无菌水清洗3次,每次5 min。使用无菌牙签剥开子房表皮,将胚珠从子房挑至加有GA的室外培养基中(约150个胚珠/皿),25℃暗培养后进行观察。烟草胚胎的分离按照文献[18-20]方法进行。
1.2.3 TUNEL反应使用4%多聚甲醛固定胚胎,按照DeadEndTM Fluorometric TUNEL System试剂盒的要求进行操作。之后将10 mg/mL 4’,6-diamidino-2-phenylindole(DAPI)加入11%甘露醇中用以对胚胎的细胞核进行染色。染色15-20 min后,再用11%甘露醇清洗两次即可进行荧光观察。
1.2.4 酶活检测用自制的微吸针将培养1 d的胚胎转移到准备好的1 μL保存液中(15 mmol/L磷酸钠加上0.1% Brij-35)。底物VEID-AMC的酶活检测反应体系如下:样品2 μL,10 mmol/L EDTA 1 μL,400 μmol/L底物2 μL,50 mmol/L半胱氨酸(CYS)2 μL,15 mmol/L PBS(PH5.0)3 μL,总体积10 μL,30℃反应16 h。其中EDTA、底物和半胱氨酸用15 mmol/L PBS(pH5.0)配制使用。反应后使用毛细管电泳对荧光基团AMC的荧光值进行检测。
1.2.5 图像观察与处理胚胎分离在普通倒置显微镜下(Olympus IMT-2)下进行,胚珠在体视显微镜(Olympus)下观察并采集图像,TUNEL反应的检测在激光共聚焦扫描显微镜(Olympus FluoView FV1000)下观察并采集图像,Photoshop和Core l DRAW用于图像处理。
2 结果 2.1 烟草胚珠和胚胎离体培养体系的建立本研究建立了两种培养体系:胚珠离体培养利用普通MS培养基在培养皿中暗培养;胚胎离体培养通过微室饲养培养(图 1)。
|
| 图 1 烟草胚珠和胚胎离体培养示意图 |
利用建立的烟草胚珠体外培养体系进行实验。选择人工授粉96 h的胚珠(合子时期)分别用于不同GA浓度的离体培养,浓度梯度为50、100、200、400和500 μmol/L。1周后对不同GA浓度培养的胚珠进行观察发现未受GA处理的胚珠绝大多数能够发育膨大,与自然条件下相同发育时间的胚珠一样呈现为白色,只有少数胚珠褐化并且败育(图 2)。而在GA处理组中,大部分胚珠虽然褐化,但仍能发育膨大,不过败育胚珠的数量有所增加。统计结果表明,在GA浓度超过50 μmol/L的情况下,随着GA浓度的增加,胚珠的败育比例逐步提高(图 3)。由于400 μmol/L和500 μmol/L的GA处理组中的胚珠败育比例高达50%以上,因此该浓度的GA可能对胚珠的正常生长有较大影响,后续实验不再将其列入考察范围。

|
| 图 2 烟草胚珠离体培养1周后的表现 A:无GA处理离体培养1周的烟草胚珠;B:50 μmol/L的GA处理下离体培养1周的烟草胚珠;C:100 μmol/L的GA处理下离体培养1周的烟草胚珠;D:200 μmol/L的GA处理下离体培养1周的烟草胚珠。标尺为2 mm,箭头所指为败育的胚珠 |

|
| 图 3 烟草胚珠离体培养1周和2周后的败育比例 |
对培养2周后的胚珠的发育情况继续进行观察发现,未经GA处理以及经过GA处理的胚珠此时绝大多数都已经褐化。统计结果表明此时的败育胚珠的比例虽然也有所上升,但与一周前相比未表现出明显增量(图 3)。因此实验结果说明100 μmol/L的GA即可影响离体培养的烟草胚珠的正常发育。在离体培养的第一周GA对胚珠发育的影响更加明显,随着时间的增加,影响逐步降低。这为后续实验选择合适的GA浓度和处理时间提供了依据。
2.3 离体培养条件下GA对胚柄细胞PCD的诱导为分析外源GA对胚柄细胞PCD的诱导作用,拟通过整体透明法和酶解分离法对离体培养中的胚珠的胚胎进行研究。但这两种方法的观察结果都不理想,故直接采用胚胎离体培养的方式进行研究。
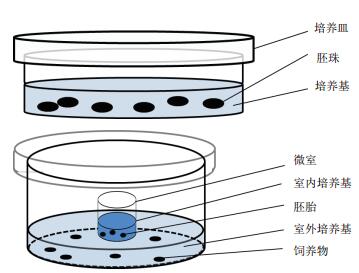
前期研究已证实烟草SR1的胚胎在8胞时期即拥有胚柄细胞,随后胚柄细胞会在32胞时期开始执行PCD[21],因此本研究选择烟草8胞时期的胚胎(此时胚柄还未出现PCD)进行离体培养。由于2.2的结果表明GA在早期培养时对胚胎发育的影响较大,以及考虑到离体培养对胚胎发育的影响,实验选择对离体培养3 d后的胚胎进行TUNEL反应检测。实验结果表明经GA处理的胚胎的胚柄细胞中出现了明显的TUNEL信号(图 4,表 1);而在未经GA处理的胚胎的胚柄细胞中只出现了极少量的TUNEL信号(表 1),这可能是离体培养环境造成的异常。

|
| 图 4 GA处理下离体培养3 d的烟草胚胎TUNEL检测 A:未经GA处理的胚胎;B:经100 μmol/L的GA处理的胚胎;C:经200 μmol/L的GA处理的胚胎。星号所指为胚柄细胞中的TUNEL荧光信号。标尺为20 μm |
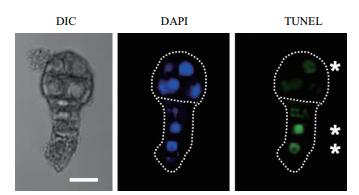
此外观察亦发现有少量胚胎的胚体细胞中也出现了TUNEL信号(图 5),而自然状态下胚体细胞不会出现PCD现象[21],这可能是由于异常的外界环境导致的胚胎发育障碍。表 1结果也表明100 μmol/L和200 μmol/L的GA的处理组中,胚柄细胞出现TUNEL信号的比例没有明显区别,但是200 μmol/L的GA的处理组中胚体细胞出现TUNEL信号的比例高出约一倍。这说明离体培养条件下200 μmol/L的GA对烟草胚胎的正常发育影响较大,因此选择100 μmol/L的GA进行胚胎离体培养更合适。
|
| 图 5 GA处理下离体培养3 d后的胚体细胞中出现TUNEL信号 图片从左至右依次为明视野、DAPI荧光和TUNEL荧光,星号所指为胚柄细胞中的TUNEL荧光信号。标尺为20 μm |
为了解培养时间对胚柄细胞PCD的影响,使用100 μmol/L的GA对8胞时期的胚胎进行不同天数的离体培养。结果表明胚胎离体培养过程中,胚柄细胞出现TUNEL信号的比例会随着培养时间的增加而增加。表 2结果显示培养3 d的胚胎的胚柄细胞出现TUNEL信号的比例为67.6%,超过培养1 d的胚胎的胚柄细胞出现TUNEL信号的比例25%大约1.5倍。然而对比培养3 d和培养5 d的胚胎的胚柄细胞出现TUNEL信号的比例发现,TUNEL信号的比例仅由67.6%提高到75%,增量相对较低。而随着培养时间的增加,胚体细胞出现异常TUNEL信号的比例逐渐提高。因此实验结果表明,外源GA对胚柄细胞的影响主要体现在离体培养的前3 d,过长的培养时间会逐渐干扰胚体的正常发育。
依照以往实验结果,caspase家族蛋白caspase 6-like可能参与了胚柄细胞PCD[21],故使用caspase 6-like的特异底物VEID-AMC以检测经外源GA诱导的胚柄细胞中caspase 6-like的酶活是否升高。由于胚体和胚柄不易分离,酶活检测使用的是整个胚胎。根据2.4中的结果,经100 μmol/L的外源GA离体培养一天的胚胎较适于检测,因为此时胚体细胞几乎不受影响,且胚柄细胞已被诱导产生PCD(表 2)。
检测的结果(图 6)表明在GA处理组中底物经caspase 6-like切割而释放的AMC基团的荧光值要比对照组的荧光值高出约1倍,这说明在100 μmol/L GA处理下,细胞中caspase 6-like的酶活有了明显的提高,这从另一方面暗示GA诱导了胚柄细胞PCD的发生。

|
| 图 6 VEID-AMC即caspase 6-like的检测底物 100 μmol/L GA和非GA处理下离体培养1 d的胚胎细胞中caspase 6-like的酶活 |
目前在动物[22-25]和微生物[26, 27]中,对PCD相关的调控、介导和效应因子的研究已颇为深入,但对植物中相似过程的了解远远不够,尽管PCD对于植物的营养和生殖生长也不可或缺[28]。与动物不同的是,植物有两种产生能量的细胞器,线粒体和叶绿体,这可能更增加了了解植物PCD机制的难度[29]。
本研究利用离体培养技术对外源GA在植物胚柄PCD中发挥的作用进行了初步探索。实验中运用了两种离体培养技术:胚珠离体培养和胚胎离体培养。前者操作相对简单,可培养大量胚珠进行实验条件的摸索,但由于珠被组织的干扰,难以对胚胎进行直接观察和检测。反而是后者虽然操作过程较为复杂,培养的胚胎数量较少,但是胚胎清晰可见,可方便的对其进行细胞学和分子生物学检测。
胚珠离体培养表明外源的GA可影响烟草胚珠的正常发育,浓度越高影响越大。而胚胎离体培养更证实外源GA能够诱导胚柄细胞TUNEL反应的发生以及提高细胞中caspase 6-like的酶活。这些都清楚的暗示外源GA也处在胚柄PCD的调控途径中,并作为上游调控因子启动其发生。当然目前对GA参与植物细胞PCD的分子调控机制仍然所知有限,比如GA调控绒毡层的PCD主要是通过水稻的GA-regulated myeloblastosis(GAMYB)转录因子和拟南芥中的同源基因MYB33和MYB65来进行[4];另外谷物糊粉层细胞的PCD也受到GA的诱导[2],虽然还不知道这些糊粉层细胞的PCD是如何启动,但信号通路中的一些二级信使包括Ca2+、NO和ROS都已被确认[30];其他实验还表明大麦和独行草的胚乳发育中GA处理可诱导一些天门冬氨酸和半胱氨酸蛋白酶的上调[30, 31]。因此本研究对培养方式、培养材料、培养时间和培养物浓度的选择为今后深入探索烟草胚柄细胞PCD中GA相关的分子调控网络奠定了基础。
4 结论本研究建立了一套可靠的烟草胚胎和胚珠体外培养体系。证实体外培养条件下,外源GA能够诱导植物胚柄PCD的发生,且发生频率与浓度之间呈现正相关。100 μmol/L的GA浓度和3 d以内的培养时间对于烟草胚柄PCD的诱导较为合适。
| [1] | Blanvillain R, Young B, Cai YM, et al. The Arabidopsis peptide kiss of death is an inducer of programmed cell death. EMBO J, 2011, 30 : 1173–1183. DOI:10.1038/emboj.2011.14 |
| [2] | Behke PC. Hormonally regulated programmed cell death in barley aleurone cells. The Plant Cell, 1999, 11 : 1033–1045. DOI:10.1105/tpc.11.6.1033 |
| [3] | Van Hautegem T, Waters AJ, Goodrich J, et al. Only in dying, life:programmed cell death during plant development. Trends Plant Sci, 2015, 20 (2): 102–113. DOI:10.1016/j.tplants.2014.10.003 |
| [4] | Plackett AR, Ferguson AC, Powers SJ, et al. DELLA activity is required for successful pollen development in the Columbia ecotype of Arabidopsis. New Phytol, 2014, 201 : 825–836. DOI:10.1111/nph.12571 |
| [5] | Young TE, Gallie DR. Regulation of programmed cell death in maize endosperm by abscisic acid. Plant Mol Bio, 2000, 42 : 397–414. DOI:10.1023/A:1006333103342 |
| [6] | Völz R, Heydlauff J, Ripper D, et al. Ethylene signaling is required for synergid degeneration and the establishment of a pollen tube block. Dev Cell, 2013, 25 : 310–316. DOI:10.1016/j.devcel.2013.04.001 |
| [7] | Bar-Dror T, Dermastia M, Kladnik A, et al. Programmed cell death occurs asymmetrically during abscission in tomato. Plant Cell, 2011, 23 : 4146–4163. DOI:10.1105/tpc.111.092494 |
| [8] | Milhinhos A, Miguel CM. Hormone interactions in xylem development:a matter of signals. Plant Cell Rep, 2013, 32 : 867–883. DOI:10.1007/s00299-013-1420-7 |
| [9] | Steffens B, Wang J, Sauter M. Interactions between ethylene, gibberellin and abscisic acid regulate emergence and growth rate of adventitious roots in deepwater rice. Planta, 2006, 223 : 604–612. DOI:10.1007/s00425-005-0111-1 |
| [10] | Yeung EC. Embryogeny of phaseolus:the role of the suspensor. Z Pflanzenphysiol, 1980, 96 : 17–28. DOI:10.1016/S0044-328X(80)80096-1 |
| [11] | Nagl W. Translocation of putrescine in the ovule, suspensor and embryo of Phaseolus coccineus. Plant Physiol, 1990, 136 : 587–591. DOI:10.1016/S0176-1617(11)80218-X |
| [12] | Picciarelli P, Ceccarelli N, Paolicchi F, et al. Endogenous auxins and embryogenesis in Phaseolus coccineus. Aust J Plant Physiol, 2001, 28 : 73–78. |
| [13] | Lorenzi R, Bennici A, Cionini PG, et al. Embryo-suspensor relations in Phaseolus coccineus:cytokinins during seed development. Planta, 1978, 143 : 59–62. DOI:10.1007/BF00389052 |
| [14] | Perata P, Picciarelli P, Alpi A. Pattern of variations in abscisic acid content in suspensors, embryos, and integuments of developing Phaseolus coccineus seeds. Plant Physiol, 1990, 94 : 1776–1780. DOI:10.1104/pp.94.4.1776 |
| [15] | Alpi A, Tognoni F, D'Amato F. Growth regulator levels in embryo and suspensor of Phaseolus coccineus at two stages of development. Planta, 1975, 127 : 153–162. DOI:10.1007/BF00388376 |
| [16] | Möller B, Weijers D. Auxin control of embryo patterning. Cold Spring Harb Perspect Biol, 2009, 100 : 15–45. |
| [17] | Kawashima T, Goldberg RB. The suspensor:not just suspending the embryo. Trend Plant Sci, 2009, 15 : 23–30. |
| [18] | Zhang JE, Luo A, Xin HP, et al. Genes of both parental origins are differentially involved in early embryogenesis of a tobacco interspecies hybrid. PLoS One, 2011, 6 : e23153. DOI:10.1371/journal.pone.0023153 |
| [19] | He YC, Chen JY, Guo JZ, et al. A high-frequency in vivo-in vitro experimental system for embryogenesis study. Journal of Wuhan Botanical Research, 2006, 24 (1): 6–11. |
| [20] | He YC, He YQ, Qu LH, et al. Tobacco zygotic embryogenesis in vitro:the original cell wall of the zygote is essential for maintenance of cell polarity, the apical-basal axis and typical suspensor formation. Plant J, 2007, 49 : 515–527. DOI:10.1111/tpj.2007.49.issue-3 |
| [21] | Zhao P, Zhou XM, Zhang LY, et al. A bipartite molecular module controls cell death activation in the Basal cell lineage of plant embryos. PLoS Biol, 2013, 11 : e1001655. DOI:10.1371/journal.pbio.1001655 |
| [22] | Vecino E, Acera A. Development and programed cell death in the mammalian eye. Int J Dev Biol, 2015, 59 (1-3): 63–71. |
| [23] | Yamaguchi Y, Miura M. Programmed cell death and caspase functions during neural development. Curr Top Dev Biol, 2015, 114 : 159–184. DOI:10.1016/bs.ctdb.2015.07.016 |
| [24] | De Felici M, Klinger FG. Programmed cell death in mouse primordial germ cells. Int J Dev Biol, 2015, 59 (1-3): 41–49. |
| [25] | Klinger FG, Rossi V, De Felici M. Multifaceted programmed cell death in the mammalian fetal ovary. Int J Dev Biol, 2015, 59 (1-3): 51–54. |
| [26] | Bidle KD. Programmed cell death in unicellular phytoplankton. Curr Biol, 2016, 26 (13): R594–607. DOI:10.1016/j.cub.2016.05.056 |
| [27] | Durand PM, Sym S, Michod RE. Programmed cell death and complexity in microbial systems. Curr Biol, 2016, 26 (13): R587–593. DOI:10.1016/j.cub.2016.05.057 |
| [28] | Van Hautegem T, Waters AJ, Goodrich J, et al. Only in dying, life:programmed cell death during plant development. Trends Plant Sci, 2015, 20 (2): 102–113. DOI:10.1016/j.tplants.2014.10.003 |
| [29] | Ambastha V, Tripathy BC, Tiwari BS. Programmed cell death in plants:A chloroplastic connection. Plant Signal Behav, 2015, 10 (2): e989752. DOI:10.4161/15592324.2014.989752 |
| [30] | Fath A, Bethke P, Lonsdale J, et al. Programmed cell death in cereal aleurone. Plant Mol Biol, 2000, 44 : 255–266. DOI:10.1023/A:1026584207243 |
| [31] | Morris K, Linkies A, Müller K, et al. Regulation of seed germination in the close Arabidopsis relative Lepidium sativum:a global tissue-specific transcript analysis. Plant Physiol, 2011, 155 : 1851–1870. DOI:10.1104/pp.110.169706 |