草莓属是蔷薇亚科(Rosoideae Focke)、蔷薇科(Rosaceae)、蔷薇目(Rosales),根据其形态特征、地理分布、倍性、杂交结实性和杂种状态一般可以将草莓分成24种[1]。目前,大部分科学研究中涉及到的栽培品种是八倍体Fragaria × ananassa,18世纪中期在欧洲被驯化,是由早期八倍体Fragaria chiloensis和Fragaria virginiana杂交而得。由于八倍体草莓品种Fragaria × ananassa的基因的多样性和高度的杂合性,使其在世界范围内具有广泛的分布区域,成为具有高度适应性的栽培品种[2]。
草莓红中柱根腐病又叫草莓红心根腐病,是冷凉和土壤潮湿地区草莓的主要病害,水旱轮作田和老产区发病偏重,已经成为草莓病害中难以防治的根部毁灭性病害之一。此病害主要是由宿主特异性的草莓疫霉菌侵染导致,根系先从幼根尖端开始变暗变软,解剖根部发现其根部的中柱变成红褐色并且腐烂,后期严重时整条根干枯,地上部叶片变黄或萎蔫,最后全株倒塌枯死。患病植株的生长发育受到了严重阻碍,极大的影响了草莓的产量。
1 草莓红中柱根腐病的发现及现状1940年,Hickman[3]报道了一种新的草莓土传病害,文章中称在英格兰南部和西南地区发现了草莓红中柱根腐病,初步证实引发这种病害的病原菌为疫霉菌Phytophthora fragariae。1949年,在日本静冈市也发现了小范围的草莓红中柱根腐病,这里的草莓通常种植在干旱的水稻田里。自发现之后,红中柱病根腐在静冈市的草莓种植区内快速传播,表现出症状的草莓植株,其根部都浸泡在水中,经检测根部含有大量的疫霉菌孢子囊。实验结果还发现,被感染的根部还可以分离出除疫霉菌之外的其他土传病原菌。例如,尖孢镰刀菌(Fusarium oxysporum)、立枯丝核菌(Rhizoctonia solani)等。不过实验证实,草莓红中柱根腐病仅仅是由疫霉菌感染所引起的,并且通过生理生化鉴定引起病害的疫霉菌为Phytophthora fragariae Hickman[4]。
草莓红中柱根腐病一旦发生,其发展速度惊人,若不采取措施并在短短几年之内就会毁灭整个草莓的种植区域,可以说红中柱根腐病是导致草莓果实减产的主要原因之一[5]。因此,在欧盟、欧洲和地中海植物保护组织、美国、澳大利亚、新西兰和中国等国家和地区,草莓红中柱根腐病很早就已经被官方认定为检疫性植物病害。草莓红中柱根腐病在土壤温度低、湿度高的条件下容易发病,地温6-10℃是发病的最适温度,可以称其为低温型病害。如果地温高于25℃则不会发病,一般来说春秋多雨年份易发病,低洼地区或者排水不良、大水温灌的地块发病会更重。
20世纪80年代,我国草莓种植业初具规模,此后发展十分迅速,形成了很多规模化生产的地区,分布于山东、河北、辽宁、江苏和山西等省。据文献报道,我国很多草莓种植区都有此病发生。2005年,草莓红中柱根腐病在烟台地区大棚草莓栽培中普遍发生,植株发病率5%-30%,而感病的草莓植株几乎没有产量[6]。2007年,在江西省宜春市草莓种植区调查显示,草莓红中柱根腐病的发病率高达20%-40%,有些田块则发生毁灭性危害[7]。
2 草莓红中柱根腐病的症状 2.1 大田症状对于任何一种作物,能否制定有效地有害生物综合治理策略关键取决于对于疾病的精准诊断。所以,治理草莓红中柱根腐病的首要条件就是精确判断草莓植株是否患病。
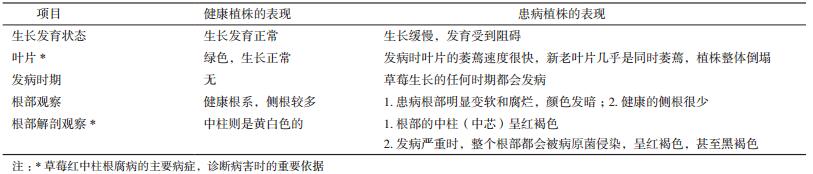
根据资料和田间观察,当草莓出现生长发育受阻、植株萎蔫倒塌时,很有可能已经感染了红中柱根腐病(图 1)。此病是一种传统的土传病害,与其他常见的土传病害相比较,疫霉菌引发的红中柱根腐病在田间症状上有较为明显的区别。根据资料比较了草莓植株在被疫霉菌、尖孢镰刀菌和大丽轮枝菌(Verticillium dahliae)3种土传病原菌感染后的症状。结果显示,这3种病原菌都能引发植株的生长缓慢、发育迟缓、叶片萎蔫且倒塌等症状,严重时都会导致植株死亡。草莓红中柱根腐病不同于其他两种土传病害之处在于:第一,植株发病后,叶片逐渐失去绿色的光泽,萎蔫速度很快,新老叶片几乎是一同萎蔫;第二,感病后,将植株根部挖出,发现患病根部明显变软和腐烂,侧根数量较少,解剖根部会发现根部中芯呈红褐色;第三,此病的发生通常和过于潮湿的土壤条件有关,这一特点主要取决于病原菌的生长特性。

|
| 图 1 草莓红中柱根腐病症状 |
在草莓感染红中柱根腐病的所有症状中,最直接的证据就是患病草莓的根部症状。这里要明确的是中柱的概念,蕨类以上的高等植物,其根、茎、叶有作为输导或支持器官的维管束,把内皮层以内的基本组织和维管束综合视为一个结构单位,称为中柱。观察解剖后患病植株根部,发现腐烂根部的中柱(中芯)是红褐色,而健康根部的中柱则是黄白色,这一症状是红中柱根腐病的有力证据,是明显区别于其他病症的特点。所以,如果要精确判断草莓红中柱根腐病,必须要将根部切开鉴定,不能仅仅依靠田间症状,应该将二者结合起来进行病情诊断。在表 1中详细总结了红中柱根腐病症状与健康草莓植株的对比,为病情判断提供了依据。
草莓盆栽实验的症状判断主要依据就是根部,需要将植株根部进行解剖后再诊断。一般会将发病根部的比例进行统计,根据比例的大小进行病情指数的划分,比例越大,病情指数越高[9]。
3 病原菌生物学特性、检测方式及基因组研究 3.1 疫霉菌生物学特性草莓红中柱根腐病是一种低温型病害,在土壤温度低、湿度高的条件下容易发病,造成这种现象的根本原因在于其病原菌的特性。
草莓红中柱根腐病是由草莓疫霉菌侵染引起,最早命名为Phytophthora fragariae Hickman,后面由于变种的出现,现在多用P. fragariae var. fragariae来给草莓疫霉菌命名。草莓疫霉菌属于鞭毛菌亚门(Mastigomycotina)、卵菌纲(Oomycetes)、霜霉目(Peronosporales)、腐霉科(Pythiaceae)、疫霉属(Phytophthora)。疫霉菌属是一类具有毁灭性的植物病原菌,减少植株产量,破坏自然生态系统[10]。疫霉菌属种大概包括超过100种[11],这一数字还在不断增加。
卵菌纲和常见的真菌有些明显不同[14]。常见的丝状真菌是单倍体,细胞有隔膜,细胞壁的主要成分是几丁质;而卵菌纲的真菌是二倍体,细胞无隔膜,细胞壁的成分主要包括1,3-b葡聚糖,还有一些1,6-葡聚糖和1,4-b葡聚糖[15]。目前市场上大多数的农药都是针对几丁质和甾醇合成的,所以对于卵菌纲病菌引起的病害,其控制效果并不明显。
草莓疫霉菌以休眠的厚壁孢子形式存活在土壤中。春季,当土壤条件处于寒冷潮湿的时候,部分孢子开始萌发形成孢子囊,后者充满了具有侵染性的游动孢子。当游动孢子被释放到水饱和土壤中后,部分孢子在化学感应的指引下,利用尾巴游动到最近的草莓根尖(短距离);另外一部分游动孢子则运动到土壤表面,通过地表径流被带到相对较远的地方。游动孢子侵染草莓根尖后,疫霉菌就会在根部定殖,引发红色中柱的症状。同时,新的孢子囊会沿着根部受感染的部分快速生长,释放更多的游动孢子到土壤中,当土壤中水分充足时,温度适宜时(一般是4-25℃之间,7-15℃时孢子更加有活力),游动孢子又会去感染更多的根,因此加速了红中柱根腐病的病情。所以说水旱轮作的地区更容易被疫霉菌感染,因为此类型的土壤中含水量很大,疫霉菌更容易萌发,孢子更容易通过地下水去感染更多的草莓植株。
1993年,Milholland等[16]叙述了草莓疫霉菌的感染草莓根部的过程,实验选取了3个草莓品种Beauty(易感型)、Surecrop(中间)和Climax(高抗),利用草莓疫霉菌菌株Pf-2对3个品种进行感染,在接种后的2、4、6、8及10 d之后显微镜下仔细观察。通过实验发现,疫霉菌最容易感染的地方是草莓根尖10 mm内(根冠后的分生区域)。对于易感品种Beauty,2 d后在根尖10 mm之后检测到菌丝的存在,6 d后扩展到40 mm处并在距根尖30 mm出观察到游动孢子,8 d后在根部定殖,10 d后在其感染根部每5 mm的片段最高科检测出25个卵原孢子;而实验中高抗品种Climax则能够完全抵抗疫霉菌的侵染,在其根部并没有发现感染的菌丝;介于二者之间的抗性品种Surecrop,比易感品种晚2 d观察到菌丝的生长,并且菌丝在其根部定殖和生长的速度都较缓慢,10 d后在距根尖40 mm处发现菌丝,在30 mm处发现游动孢子,但是并没有观察到孢子囊。
从上述实验中,不仅可以了解疫霉菌侵染草莓根部的过程,还可以得出一个结论:抗性品种在预防土传病害上有着巨大优势,而培育抗性品种将会是草莓种植业发展的重点方向之一。草莓疫霉菌具有很强的宿主特异性,一般只侵染草莓植株,对于其他品种几乎没有侵染性。如果土壤条件不合适,疫霉菌的菌丝会变成厚垣孢子休眠,后者可以在土壤中存活很多年,一旦等待时机成熟,就会再次萌发。所以预防红中柱根腐病发生的首要条件就是要保证草莓的种植环境,一般选择地势较高、排水良好、透气好和土质疏松的土壤环境,尽量避免将草莓种植在地势低洼、排水不良的地方。其实这也从另外一方面解释了目前草莓种植多采用基质栽培的原因。
3.2 检测方式早期的疫霉菌检测方法,主要是通过前面介绍的红中柱根腐病症状来进行判断,而目前检测病原菌P. fragariae的方法基本是以PCR为基础进行改良,从而找到合适有效灵敏度高的PCR检测实验方法。
表 2总结了使用率较高的几种方法[17],包括巢式PCR、PCR-ELISA、实时定量PCR、巢式实时定量PCR和传统的PCR方法等。传统的PCR方法[18, 19]是开发疫霉菌的不同单拷贝基因和rDNA沉默区,但是传统方法在检测灵敏度上可能有些欠缺,会出现矛盾的结果。还有人用RAS-like和TRP1 genes开发出一套针对草莓疫霉菌特异性的PCR引物对[18],经过实验检测发现改进的引物比报道的其他单循环PCR要更加灵敏。相比较之下,实时定量PCR和巢式实时定量PCR是灵敏度较高的两种检测方法。基于nested PCR的检测方法是单循环PCR灵敏度的1 000-10 000倍[20]。使用了荧光探针可以检测到病原菌0.1 fg的DNA含量。实验证实使用Molecular BeaconTM和TaqManTM探针的效果一样。同时,普通巢式PCR也能成功的检测到草莓组织中的病原菌[21],灵敏度是单循环PCR的1 000-10 000倍,较多人使用此方法。而PCR-ELISA方法[22]比较少报道,也可以用于检测,但是这种方法不推荐用于鉴定性的检测中,因为其灵敏度较低,仅仅相当于凝胶电泳和溴化乙锭-溴化凝胶染色的灵敏度[17]。
在实验中,可以根据实验需要以及实验室客观条件选择合适的检测手段,由于疫霉菌的宿主特异性,还有其生长萌发条件的局限性,限制了相关的分子研究,能查到的文献比起其他的土传病害来说数量较少。
3.3 疫霉菌的基因组2015年,草莓疫霉菌的基因组序列公布,这一有价值的生物信息学数据可以帮助我们了解病原菌的致病机理和宿主特性,有助于进行更深入的研究[5],用于分析的草莓疫霉菌来自荷兰的菌种保藏中心。草莓疫霉菌的全基因组大小是73.68 Mb,GC覆盖率为53.25%,总共有18 692个蛋白质编码基因。
草莓疫霉菌基因组的公布是对于鉴定病菌的致病性和进化地位的分子机制有着重要的价值,也有助于发现新的致病基因和无毒基因进行疫霉菌的宿主特异性鉴定,同样还有助于发掘疫霉菌杀菌剂的目标靶点,为将来防治病害提供分子学的理论基础,希望被用到分子辅助育种当中,发挥出更好的作用。
4 草莓红中柱根腐病的防治目前对已经患病植株没有特别有效的治疗手段,所以对于草莓红中柱根腐病管理的策略重点在于预防措施。有害生物综合治理方法是将抗病植株培养、对感染的土壤进行预处理、多种栽培管理方法等组合起来,共同达到防治草莓红中柱根腐病的目的,减少此病害带来的巨大损失[23]。
4.1 种植环境的选择由于草莓疫霉菌的游动孢子在土壤水饱和状态下会更加活跃,所以草莓种植的关键技术就是土壤排水问题。草莓不应该种植在低洼地或者黏重土壤中,避免在水分容易聚集又难以排掉的土壤中种植草莓,排水良好、土质疏松、透气性好的种植环境是首选。
为了尽可能降低红中柱根腐病的发生,不在发生过此病的土壤中再次种植草莓,因为草莓疫霉菌的生存能力非常强,能在土壤中存活多年。如果此条件不容易实现,可以将草莓的种植提高10 cm,这样草莓根系就会生长在病原菌最活跃地区的上面,红中柱根腐病的严重程度会显著降低;若是用基质种植,基质的高度需要达到25 cm,保证草莓根系在水位之上,这样也能防止病原菌的侵染。
虽然疫霉菌存活时间长,但是其萌发感染需要的生长条件也是比较苛刻的,如果能保持良好的种植环境,在很大程度上就能避免病害的发生。尽管现在一些草莓种植大户会选择基质栽培,但是地栽草莓种植户也是大量存在的,所以选择合适的土壤环境是其必须达到的首要条件,这样就可以从源头上避免病原菌的萌发及繁殖。
4.2 利用分子标记选择抗性品种草莓疫霉菌抗性植株的发现、发展和栽培是控制草莓疫霉菌最有效的方法,分子标记辅助育种是有效并且快速的筛选抗性品种的一种手段,而成功的在草莓体内找到关键的抗性基因是首要条件。
最初,草莓植株对于疫霉菌的抗性被认为是通过多基因遗传而获得[24],但是后来又有人发现,草莓植株的抗性基因和病原菌的非致病基因是通过基因-基因模式相互作用的[25],报道称至少有5个不同的抗性基因(R1-R5)和相应的非致病基因(Avr1-Avr5)存在,并且主要抗性基因Rpf1被成功的分离[26]。还有研究用Bulked segregant analysis(BSA)分离全体分组分析法鉴定了和Rpf1基因连锁的7个随机扩增多态性DNA标记[27],但是由于RAPD标记很难重复,因此有实验在RAPD标记的基础上构建了与抗性基因Rpf1连锁的SCAR标记,利用比标记来检测草莓植株体内是否存在抗性基因Rpf1。存在抗性基因的被认为是抗病品种,不存在的则认为是易感品种,将这两种品种在实验室和田间分别杂交育苗,分析后代发现抗病品种和易感品种的比例是1:1[23]。
抗性基因Rpf1的分子标记还在不断的被挖掘,结合已经公布的草莓疫霉菌基因组序列,有助于我们快速准确的进行草莓抗性品种的育种工作。
4.3 种植前的土壤处理由于草莓疫霉菌可以在土壤中存活多年,如果能够采取一定的方法将土壤中的病原菌杀死,就可以达到防治病害的效果。
早些时候人们采用化学方式对土壤进行处理,最早使用过溴化甲烷和三氯硝基甲烷[28],取得了良好的效果,一度成为防治草莓土传病害的主要手段。后因溴化甲烷对臭氧层有危害,许多国家禁止使用,故将其淘汰。于是出现了三氯硝基甲烷、氯化苦和异硫氰酸甲酯产物(如棉隆或者威百亩)等替代品,一般都采取提高种植床的高度,将化学试剂通过滴灌注入到土壤中以达到杀死病原菌的目的[29]。
随着保护环境意识的提高,一些处理土壤的非化学方法开始兴起,如土壤高温蒸汽消毒,此方法能够用高温快速杀死病原菌,起到良好的防治作用。但是,在大部分情况下,能够采用此方法的土壤环境需要具备一定的条件,并不是所有的土壤环境都适合用此方法。
有实验[30]将化学方法和非化学方法处理土壤的结果进行了比较发现,土壤高温蒸汽消毒效果最好,能将土壤中的草莓疫霉菌、大丽轮枝菌、立枯丝核菌3种病原菌完全杀死,而其余的5种化学方法,只有Dazomet棉隆能达到同样的效果,其他几种都不能将这3种菌同时杀死。仔细分析实验结果还发现,疫霉菌和其他两种菌存在差异,能够杀死疫霉菌的化学试剂并不能完全抑制其他两种菌,反之亦然,而且在对照组中,疫霉菌的感染率明显要比其他两种菌高出很多。
实验结果证实了防治红中柱根腐病的必要性,因为疫霉菌具有极大的危害性,感染速度很快,而且一般的化学试剂对其不起作用,所以必须在土壤选择及处理、抗性品种的培育方面下功夫,才能达到良好的防治效果。
4.4 生物防治生物防治是管理植物土传病害很重要的一个手段,也是目前土传病害研究的热点之一,包括生防菌的分离筛选鉴定,实验室拮抗机理研究、大田拮抗效果和微生物制剂的开发等。
已经有多种微生物被证实对草莓疫霉菌有拮抗作用,如解淀粉芽孢杆菌(Bacillus amyloliquefaci-ens)、荧光假单胞菌(Pseudomonas fluorescens)、丛枝根菌(Arbuscular mycorrhiza)等。但是由于实验室的环境较为理想,所以很多拮抗菌在田间的应用效果不如实验室的效果好。解淀粉芽孢杆菌(G-V1)和荧光假单胞菌(2R1-7)在温室盆栽实验中对草莓疫霉菌的抑制率能够与化学药剂的抑制率持平,可以达到59%;但是在大田试验(人工感染)中,二者的抑制率降到45%,而且在第2年时,只有解淀粉芽孢杆菌(G-V1)能够抑制红中柱根腐病,不过抑制率更低。同时,在另外一组大田实验(自然感病)中发现两种拮抗菌混合使用,抑制红中柱根腐病的效果更佳,最高能达到50%[31]。实验表示,丛枝真菌可以有效地抑制草莓疫霉菌的生长,无论体内实验还是体外实验,其在根部定殖后可以显著减少草莓根部的疫霉菌孢子,随着时间的增加,减少量越大,72 h后减少了80%左右[32]。
生物防治有很多优势,无毒无害、不损伤土壤环境,而且一些拮抗菌还具有促进植物生长的作用,所以微生物制剂的应用得到越来越多的重视。但是,微生物防治存在着一些劣势,微生物是在土壤环境中发挥作用,由于土壤环境的复杂多变,微生物的作用也会因土壤条件的变化而受到影响。最重要的一点是,微生物作用的关键是“防”,在病害还未发生时起到防护作用,定殖在植物根部或者根际周围的土壤中,从而保护植株根部不被侵染,维持土壤微生物环境的健康,不让病原菌大量繁殖。一旦病原菌在土壤中大量繁殖,或者病原菌已经侵染到植株根部,那么此时拮抗微生物的作用可能就远远不如化学试剂。尽管很多人意识到生物防治的重要性,但是由于实际问题,大面积的推广应用还是困难重重,需要多方面的共同努力。
4.5 总结对于防治草莓红中柱根腐病的各种措施,在种植时主要从两个方面考虑。
如果是首次种植草莓,要注意选择合适的种植环境,无论是地栽还是基质栽培都需要达到排水良好、土质疏松、透气性好的目标。此外,草莓品种的挑选还需要注意,挑选健康的无污染的草莓苗进行种植,首选抗病品种。在种植过程中杜绝一切可能的污染源出现,严格管理。
如果草莓种植地是再植的,必须要选择有抗性的草莓品种,同时还要进行土壤的前处理,根据土壤环境的客观条件选择合适的处理方式,如蒸汽、日晒和微生物防治等,在实际的处理过程中,可以将多种方式联合使用,会达到更好的效果。种植期间的管理同样要注意避免一切可能的污染源出现。
5 展望草莓红中柱根腐病是草莓根腐病的一类,后者是草莓土传病害中重要的病害,已报道的引起后者的病原菌达20多种,尖刀镰孢菌、腐皮镰刀菌(Fusarium solani)、链格孢属(Alternaria)、炭疽杆菌(Bacillus anthraci)、疫霉菌属、瓜果腐霉(Pythium aphanidermatum)、立枯丝核菌和大丽轮枝菌等。土壤环境的复杂性、病原菌的多样性及之间的关联性,加大了对于草莓根腐病研究的困难,也提高了对生产中防治措施的要求。因此,未来对于草莓红中柱根腐病的研究需要考虑整体的大环境。上述病原菌之间很可能存在着一些关联,不同的病原菌组合可能有不同的感染方式,包括感染的时间、顺序和强度都会改变,这将会是病原菌感染机理的研究热点,对于生产实践要在理论研究的基础上多思考,在种植过程中采用多种防治措施,最大限度的降低草莓被感染的几率,只有利用好基础研究为生产实践服务,才能在草莓生产过程中达到最好的防治效果,获得更好的经济效益。
| [1] | Dimeglio LM, Staudt G, Yu H, et al. A phylogenetic analysis of the genus Fragaria(strawberry) using intron-containing sequence from the ADH-1 gene. PLoS One, 2014, 9 (7): 454–455. |
| [2] | Mohamed AW, Jęcz T, Korbin M. The history if genome mapping in Fragaria spp.. Journal of Horticultural Research, 2014, 22 (2): 93–103. |
| [3] | Hickman CJ. The red core root disease of the strawberry caused by Phytophthora fragariae n. sp.. Journal of Pomology, 1940 : 89–118. |
| [4] | Morita H. Red stele root disease of strawberry caused by Phytopht-hora fragariae. Japanese Journal of Phytopathology, 1965, 30 (5): 239–245. DOI:10.3186/jjphytopath.30.239 |
| [5] | Gao R, Cheng Y, Wang Y, et al. Genome sequence of Phytophthora fragariae var. fragariae, a quarantine plant-pathogenic fungus. Genome Announcements, 2014, 3 (2): 25–30. |
| [6] | 李红斌. 草莓红中柱根腐病识别与综合防治技术. 浙江农业科学, 2016, 57(3): 376–377. |
| [7] | 王玉民, 陈奇强, 朱红梅. 草莓红中柱根腐病原致病性及杀菌剂毒力测定. 安徽科技学院学报, 2014, 28(6): 15–18. |
| [8] | Manici LM, Caputo F, Baruzzi G. Additional experiences to elucidate the microbial component of soil suppressiveness towards strawberry black root rot complex. Annals of Applied Biology, 2005, 146 (146): 421–431. |
| [9] | van de Weg WE, Wassenaar LM, van de Lindeloof CPJ. Inheritance of resistance to Phytophthora fragariae Hickman in strawberry. Euphytica, 1989, 42 (42): 25–30. |
| [10] | Meng Y, Zhang Q, Ding W, et al. Phytophthora parasitica:a model oomycete plant pathogen. Mycology, 2014, 5 (2): 43–51. DOI:10.1080/21501203.2014.917734 |
| [11] | Kroon LP, Brouwer H, de Cock AW, et al. The genus Phytophthora anno 2012. Phytopathology, 2012, 102 (4): 348–64. DOI:10.1094/PHYTO-01-11-0025 |
| [12] | Haas BJ, Kamoun S, Zody MC, et al. Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans. Nature, 2009, 461 (7262): 393–398. DOI:10.1038/nature08358 |
| [13] | Grünwald NJ, Garbelotto M, Goss EM, et al. Emergence of the sudden oak death pathogen Phytophthora ramorum. Trends in Microbiology, 2012, 20 (3): 131–138. DOI:10.1016/j.tim.2011.12.006 |
| [14] | Bertier L, Leus L, D'Hondt L, et al. Host adaptation and specia-tion through hybridization and polyploidy in Phytophthora. PLoS One, 2013, 8 (12): e85385. DOI:10.1371/journal.pone.0085385 |
| [15] | Latijnhouwers M, de Wit PJ, Govers F. Oomycetes and fungi:similar weaponry to attack plants. Trends in Microbiology, 2003, 11 (10): 462–469. DOI:10.1016/j.tim.2003.08.002 |
| [16] | Milholland RD, Daykin ME. Colonization of roots of strawberry cultivars with different levels of susceptibility to Phytophthora fragariae. Phytopathology, 1993, 83 (5): 538–542. DOI:10.1094/Phyto-83-538 |
| [17] | Mirmajlessi SM, Destefanis M, Gottsberger RA, et al. PCR-based specific techniques used for detecting the most important pathogens on strawberry:a systematic review. Systematic Reviews, 2015, 4 (1): 1–11. DOI:10.1186/2046-4053-4-1 |
| [18] | Stöger A, Ruppitsch W. A rapid and sensitive method for the detection of Xanthomonas fragariae, causal agent of angular leafspot disease in strawberry plants. Journal of Microbiological Methods, 2004, 58 (2): 281–284. DOI:10.1016/j.mimet.2004.04.002 |
| [19] | Grootveld M, Algeo D, Silwood CJL, et al. Development of a DNA-based method for detection and identification of Phytophthora species. Australasian Plant Pathology, 2006, 35 (2): 147–159. DOI:10.1071/AP06018 |
| [20] | Bonants PJM, Gent-Pelzer MPEV, Hooftman R, et al. A combination of baiting and different PCR formats, including measurement of real-time quantitative fluorescence, for the detection of Phytophthora fragariae, in strawberry plants. European Journal of Plant Pathology, 2004, 110 (7): 689–702. DOI:10.1023/B:EJPP.0000041551.26970.0e |
| [21] | Surhone LM, Tennoe MT, Henssonow SF, et al. Xanthomonas fragariae . Eppo Bulletin, 2006, 36 (1): 135–144. DOI:10.1111/j.1365-2338.2006.00926.x |
| [22] | López MM, Llop P, Olmos A, et al. Are molecular tools solving the challenge posed by detection of plant pathogenic bacteria and viruses?. Current Issues in Molecular Biology, 2008, 11 : 13–146. |
| [23] | Gelvonauskiene D, Rugienus R, Siksnianas T, et al. Screening of apple and strawberry plants carrying fungal disease resistance oligogenes using molecular markers. Agriculture, 2007, 94 (4): 139–145. |
| [24] | Scott DH, Draper AD, Galletta GJ. Breeding strawberries for red stele resistance. Plant Breeding Reviews, 2011, 2 : 195–214. |
| [25] | van de Weg WE. Cultivar-race interactions of the strawberry-Phytophthora fragariae system with regard to a gene-for-gene mode[C]. Acta Hortic, 1989, 265:203-206. |
| [26] | van de Weg WE. A gene-for-gene model to explain interactions between cultivars of strawberry and races of Phytophthora fragariae var fragariae. Theoretical & Applied Genetics, 1997, 94 (3-4): 445–451. |
| [27] | Haymes KM, Henken B, Davis TM, et al. Identification of RAPD markers linked to a Phytophthora fragariae resistance gene (Rpf1) in the cultivated strawberry. Theoretical & Applied Genetics, 1997, 94 (8): 1097–1101. |
| [28] | Johnson HJr, Holland AH, Paulus AO, et al. Soil fumigation found essential for maximum strawberry yields in southern Alifornia. California Agriculture, 1962, 16 (10): 5–6. |
| [29] | Koike ST, Gordon TR. Management of Fusarium wilt of strawberry. Crop Protection, 2015, 73 : 67–72. DOI:10.1016/j.cropro.2015.02.003 |
| [30] | Adela B, Alina I, Cristina P. Prevention and control of strawberry cultivars root diseases[J]. Fruit Growing Research, 2013, XXIX. |
| [31] | Anandhakumar J, Zeller W. Biological control of red stele (Phytophthora fragariae, var. fragariae) and crown rot (P. cactorum) disease of strawberry with rhizobacteria. Journal of Plant Diseases & Protection, 2008, 115 (2): 49–56. |
| [32] | Norman JR, Hooker JE. Sporulation of Phytophthora fragariae shows greater stimulation by exudates of non-mycorrhizal than by mycorrhizal strawberry roots. Mycological Research, 2000, 104 (5): 1069–1073. |