MiRNAs是Lee等[1]在秀丽线虫中首次发现的一类长度约22个碱基、具有转录调节功能的非编码小RNA(non-coding RNA,nc RNA),其在各种生理和病理过程中扮演重要角色,如基因表达、细胞增殖、分化、凋亡、组织代谢和肿瘤生成等[2-4]。近年来已有大量的文章涉及了这方面的研究。迄今为止,人类、果蝇、植物、动物等物种中数以百计的miRNA已被报道。miR-1246是被P53所调控的一个新miRNA,定位于人2q31.1。目前miR-1246的生物学功能已逐渐被各界学者所关注。关于miR-1246的研究主要集中在以下几个方面:(1)调控组织癌细胞的增殖、分化、凋亡、衰老及转移入侵,是多种癌症潜在的诊断与治疗靶标,如肝癌、宫颈癌。(2)参与多种生理疾病的形成与发展过程,如唐氏综合症、埃博拉病毒传染病、心血管疾病等。(3)是多种细胞分泌因子的重要调控因子,如B细胞、T细胞。本文就miR-1246的结构特点、作用机制及在疾病上的应用进行综述,旨为临床研究提供参考。
1 miR-1246的结构特点miRNA前体具有较保守的二级结构。与一级结构相比,在生物进化过程中,二级结构往往同生物功能联系紧密。通过RNA fold(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)预测出miR-1246的前体二级结构(图 1)发现,其具体典型的茎环结构,包含大量G/U碱基对,且5' 端起始碱基多数为A或U。图 1-A中黄色高亮表示miR-1246的成熟体序列(AAUGGAUUUUUGGAGCAGG),图 1-B中以A-U、G-C、G-U碱基互补配对形成的连续双螺旋区域为茎区,不构成互补配对的单链结构为环区,茎环结构复杂多变,折回长度变异明显,每个“茎环结构”由大约100个碱基折叠而成。“茎环结构”中环的大小约10个碱基,最大不超过30多个碱基,“环”两侧的碱基呈高配对性,不同颜色表示碱基配对的概率,颜色越红,表明对应碱基处于配对的概率越大。其具有自由能越低越稳定的结构特点,其二级结构自由能(MFE)较低,最大自由能为-19.77 kcal/mol。
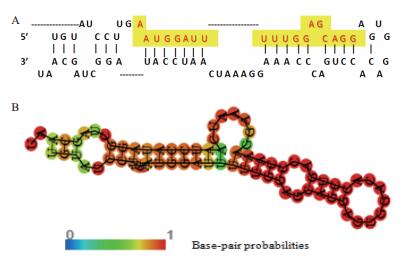
|
| 图 1 miR-1246的二级结构图 |
许多研究表明,miR-1246受控于P53通路。已有研究报道P53家族成员有抗癌活性,主要在转录水平上调控目标基因的表达[5]。P53在反馈调节通路中扮演着双重角色,一方面P53直接约束其靶miRNA,控制其转录,进而抑制靶基因翻译。如当P53正常的细胞受到DNA损伤(药物、辐射等应激)后,miR-34a、miR-22、miR-1246等表达增高,并诱导细胞凋亡、周期阻滞及细胞老化等[6];另一方面,P53还能调控miRNA的生成沉默复合物(RNA-inducing silencing complex,RISC)的功能,影响成熟miRNA的生成。成熟的miRNA双链(miRNA-miRNA*)与Ago蛋白结合后在解旋酶作用下双链很快被解开,miRNA*脱离并被降解,最后剩下成熟的miRNA与RISC形成RNA介导的沉默复合体,该复合体结合到与其互补的mRNA位点通过两种依赖于序列互补性的机制负调控靶基因[7](图 2)。
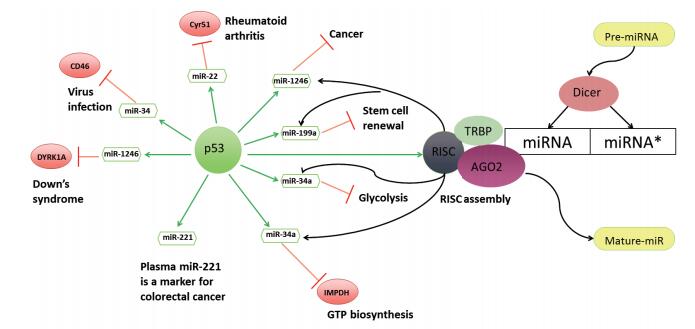
|
| 图 2 p53调控miRNAs的信号通路 绿色箭头:促进作用;红色箭头:抑制作用;绿色圆圈:抑癌基因;红色圆圈:癌蛋白 |
成熟的miR-1246通常与其互补的mRNA通过两种依赖于序列互补性的机制负调控靶基因。其作用方式是将miR-1246 5' apos; 端种子序列(第2-7nt)与靶基因mRNA 3' UTR区进行碱基配对,配对的紧密程度决定miRNA对靶基因蛋白的抑制程度。配对形式包括:(1)6mer site:即miRNA第2-7核苷酸与靶基因完全配对,此方式识别靶基因的敏感性更高,特异性低,抑制不完全,蛋白累积多。(2)7mer-1A site:即第2-7nt与靶基因呈互补配对,且靶基因对应miRNA第一位核苷酸处为A,此方式特异性高,抑制效果一般,较为通用。(3)7mer-m8 site:即miRNA第2-8nt与靶基因完全配对,此方式特异性第二高,保守性强,抑制效果一般;(4)8mer site:即miRNA第2-8nt与靶基因完全配对,且外加靶基因对应miRNA第一位核苷酸处为A,此方式特异性最高,完全抑制,蛋白累积最少[8](图 3)。
3 miR-1246与疾病研究 3.1 miR-1246与宫颈癌研究表明,miR-1246的异常表达或对下游靶基因的异常调控与宫颈癌的发生、细胞增殖和入侵紧密相关。Chen等[9]对宫颈鳞癌淋巴结转移患者的癌组织和血清进行检测发现,miR-1246表达异常升高,通过合成miR-1246 mimics(或inhibitor)转染宫颈癌SiHa细胞进行MTT、迁移、侵袭、划痕实验,结果发现,转染miR-1246 mimics的SiHa细胞生长速度明显增加了,侵袭和迁移能力也增加了。然而转染miR-1246 inhibitor的SiHa细胞生长速度变慢了,侵袭和迁移能力也减弱了。此外,血清miR-1246表达还可以预测病人与早期宫颈鳞状细胞癌淋巴节点转移情况。这一系列的细胞功能试验说明miR-1246确实能促进宫颈癌细胞的增殖和侵袭、迁移,具有致癌基因作用,能够加速癌变进程。值得注意的是,该研究还发现,THBS2是一个被miR-1246调控的靶基因,而THBS2在多种癌症(乳腺癌、结肠癌、卵巢癌)中存在特异性表达,可协同其他基因调节细胞外基质(extracellular matrixc,ECM)的水解,最终达到标记肿瘤的侵袭力和辅助癌症治疗的作用[10],但其具体机制尚为空白。Chen认为,可能是miR-1246与THBS2 3' -UTR区结合后,ECM受体信号途径被抑制。而miR-1246可能通过调控HPV癌蛋白(E6、E7),在宫颈癌的发生、发展中起主要作用。当HPV感染复层鳞状细胞后,在基底层表达E6、E7产物,并不断进行复制,E6、E7产物通过P53和Rb蛋白途径,改变细胞周期调控点并诱导宿主细胞增殖[11]。虽然此推论具有一定参考价值,但具体机制仍需要进一步的生物性试验验证。
3.2 miR-1246与肝癌据20世纪90年代统计,我国肝癌的年死亡率为20.37/10万,在恶性肿瘤死亡中排列第二[12]。肝癌早期无症状或症状不明显,但扩展非常迅速,治疗较困难。因此肝癌的预防控制及早期诊断是目前医学界亟待解决的科学难题。Sun等[13]利用qRT-PCR检测发现miR-1246在人肝癌细胞HCC的表达水平非常高,而后用生物信息学和双荧光素酶报告基因检测分析发现miR-1246通过特异性结合靶向细胞黏附分子1(intercellular adhesion molecule 1,CADM 1)的3' -UTR,以调控其表达,促进癌细胞的迁移和入侵。此外,研究报道,P53可以诱导miR-1246表达上调,进而抑制其下游靶基核转录因子(nuclear factor I/B,NFIB)表达,从而影响肝癌细胞的增殖[14]。NFIB为致癌因子,在细胞转化过程中主要影响细胞的活力及增殖效率[15]。但NFIB基因沉默可抑制细胞增殖,激活细胞凋亡通路。且在肝癌患者接受肝移植后,miR-1246与血清AST和ALT水平、肝细胞TNFα mRNA表达水平呈正相关(AST和ALTS是揭示肝损伤的两个重要指标,炎性细胞因子TNFα对肝缺血再灌注损伤(hepaticischemia-reperfusion injury,IRI)诊疗至关重要[16])。其主要原因可能是TNFα超表达M1巨噬细胞,而M1巨噬细胞导致炎症的主要细胞类型,当肝脏遭受IRI或短暂性氧化应激时,miR-1246在早期肝移植后的循环系统中不会出现上调,只有当M1巨噬细胞被激后,miR-1246才会显著上调,以上研究提示早期肝的循环miR-1246是肝损伤一个重要指标及肿瘤复发和肝移植术后肝细胞的生存的预后生物标记。
3.3 miR-1246与肺癌肺癌根据其临床特征分为多种亚型,各种亚型对应的治疗方法也不同。因此正确及时诊断出肺癌的类型对后期的临床治疗至关重要。有研究报道,肿瘤干细胞(concept of cancer stem cells,CSCs)标志物CD133、SOX2、OCT4、ALDH1(脑胶质瘤特征标记物CD133、诱导多能干细胞的标志物SOX2、OCT4、ALDH1)等在肺癌细胞中高度表达,可作为肺癌诊断的标志物。而其主要信号通路Wnt/β-catenin、Notch和Hedgehog会被miRNA所调控[17]。Huang等[18]对非小细胞肺癌(non-small cell lung cancer,NSCLC)病人的肿瘤样本和非癌变邻近组织检测发现,miR-1246在肿瘤样本中显著上调,且会促使肺癌侵袭和组织迁移。值得注意的是,当用miR-1246抑制剂和CPEB4小干扰RNA共同转染人肺腺癌细胞株A549细胞后,整个细胞的表达谱变得更接近正常细胞。而敲除CPEB4可促进NSCLC细胞的迁移和侵袭。这些结果表明,miR-1246是NSCLC的促癌基因,而其所调控的下游靶基因CPEB4又是很重要的抑癌基因,CPEB4下调归因于miR-1246的上调,miR-1246对CPEB4具有抑制作用。此外,Kim[19]等对人肺癌细胞HCC1588和人肺腺癌细胞株A549 miRNA芯片和通路分析发现9个miRNA(miR-1290、miR-1246、miR-574-5p、miR-4257、miR-1224-5p、miR-483-5p、miR-3195、miR-4274、miR-4324)与癌细胞迁移相关。结果提示可以通过抑制miR-1246和miR-1290抑制具备干细胞的功能的EMT和NSCLC的入侵和迁移。
3.4 miR-1246与唐氏综合症唐氏综合症(又称21三体综合征),是患者体细胞内多出一条完整染色体,有时是部分21号染色体(Hsa21)所致。唐氏综合征的发病率介于1/650-1 000之间,是最常见的常染色体异常疾病,目前已被广泛研究[20]。研究发现:双特异性络氨酸磷酸化调节激酶(dual-specificity yrosine-(Y)-phosphorylation regulated kinase 1A,DYRK1A)超表达于唐氏综合症病人中,并且与神经和大脑发育高度相关[21]。DYRK1A异常表达,导致发病的具体作用机制如下:首先DYRK1A通过循环的磷酸化AMP反应元件结合蛋白(分子)参与大鼠神经元分化的河马campal祖细胞分化,同时DYRK1A通过分子内机制,进行自设磷酸化,使5-苏氨酸和7-苏氨酸磷酸化[22];其次通过钙调磷酸酶调节因子(Regulator of calcineurin 1,RCAN 1)协同作用,可调控细胞核转录因子(nuclear factor activated T Cell,NFAT),进而影响机体免疫防疫系统,激活T细胞,引起机体IL-2、IL-3、GM-CSF、IFNɤ和TNFα等水平变化,最终导致细胞核封锁,从细胞质中易位[23-25]。最后DYRK1A使caspase-9磷酸化,抑制其能力,导致唐氏综合症患者神经系统发生生物学改变。然而,研究发现DYRK1A受控于miR-1246,通过miR-1246的活化P53激活NFAT通路致使DYRK1A表达降低,最大限度地发挥抗肿瘤活性。其作用机理是:DNA损伤激活P53蛋白,P53蛋白与Drosha酶复合物结合后,促进初级miRNA转变成成熟的miRNA前体,P53及其类似物P63和P73能靶向作用于miR-1246,后者能通过抑制DYRK1A基因的表达,进而活化NFAT,从而引起细胞调亡,抑制唐氏综合征相关蛋白激酶的表达水平,从而发挥抗肿瘤功能[26, 27]。以上结果提示,p53家族是最重要的肿瘤蛋白家族,而miR-1246是一个重要的抗癌基因,可以作为唐氏综合症诊断的临床标记。
3.5 miR-1246与埃博拉病毒传染病埃博拉病毒(Ebola virus,EBOV)是长约19 kb的单股负链RNA病毒,是引起人类及灵长类动物产生出血热等症状的烈性传染性病毒,主要通过汗液、唾液或血液等途径感染,而目前尚无有效的防治策略[28]。Sheng等[29]用EBOV的GP蛋白感染人脐静脉内皮细胞发现,3个miRNA表达升高(miR-1246、miR-320a和miR-196b-5p),并观察到这些miRNA的一些靶标显著下调,如膀胱蛋白酶8(Caspase 8)、组织因子抑制剂(TFPI)、肌萎缩蛋白1(DAG1)和FADD样细胞凋亡调控因子(CFLAR)等。然而,进一步发现降低这些miRNA的表达能在体外降低埃博拉病毒GP蛋白引起的细胞毒性。GP是一种存在于病毒多功能蛋白,能引起组织炎症、细胞吸附、细胞毒性和宿主细胞免疫等反应[30-32]。TFPI、DAG1和CFLAR曾被报道与细胞黏附有关,TFPI抑制血液凝固,CFLAR抑制细胞凋亡,DAG1可能在上皮细胞黏附过程发挥作用[30, 33-35]。总之,EBOV GP能诱导miR-1246、miR-320a和miR-196b-5p的表达升高,从而降低与细胞黏附相关的TFPI,DAG1和CFLAR等基因的表达,并破坏血液的完整性,增加血管通透性使红细胞外泄,最终导致人类高致命性出血热综合症。
3.6 miR-1246与系统性红斑狼疮系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累积多系统、多器官并有多种自身抗体出现的自身免疫性疾病。SLE的特点之一是通过不断激活B细胞使自身抗体的生产不受控制,进而造成组织损伤[36]。近年来的研究表明,异常的表观遗传作用在系统性红斑狼疮的发病机制中扮演着重要角色[37-40]。而一些miRNAs(miR-155、miR-146a、miR-326等)可以调节T细胞和B细胞功能影响自身免疫性疾病的发病机制,如SLE、风湿性关节炎和多发性硬化症[41]。Luo等[42]研究发现miR-1246能特异性的与早期的B细胞因子1(Early B cell factor 1,EBF1)mRNA 3’-UTR结合,抑制SLE。在SLE病人中,被激活的的异常B细胞会激活AKT通路,致使P53表达下调,miR-1246表达量减少,而EBF1表达上调。同时细胞中的免疫基因CD40、CD80、CD86表达也上调,接着又会更加刺激B细胞的增多。然而,当向正常B细胞转染miR-1246类似物时,得到结果刚好相反。结果提示,过表达的miR-1246可以抑制B细胞的过度激活、自身免疫系统过度运作,从而抑制系统性红斑狼疮。
3.7 miR-1246与心力衰竭心力衰竭(diastolic heart failure,DHF)是指在心室收缩功能正常的情况下,由于心室充盈异常和充盈压的升高而导致的肺循环或体循环的临床综合征。Nair等[43]通过miRNA芯片分析比较了正常人与舒张性心衰患者miRNA表达情况,确定了不同类型的舒张性心衰患者血浆中差异表达的循环miRNA(miR-454、miR-500、miR-1246和miR-142-3p),其中在舒张期功能不全患者中miR-454、miR-500和miR-1246分别表达下调和上调,在收缩期和舒张功能不全患者和收缩压+舒张压功能不全患者中miR-142-3P表达下调。该研究首次证实了miR-1246可作为舒张期功能障碍舒张功能不全的标志物,尤其是老年男性通过识别miR-1246,作为一个舒张功能不全和心肌损伤的更为敏感的标志。此外,通过TargetScan5.2分析发现其大约有114个保守基因与心脏疾病相关。这些基因是:与急性冠心病及钠钾离子通道相关的基因(SCN3A和KCNAB1)、蛋白激酶C(PRKCE)、cAMP反应元件结合蛋白5(CRE-B5)、肾上腺素能β-1受体(ADRβ1)等。最近研究表明,miRNA被分泌在细胞微泡和胞外体内[44],神经酰胺通路控制细胞间胞外体miRNA的转运。这说明血清中检测到的miRNA不全部直接来自组织和细胞系,而多来源于细胞溶解产物、组织破裂、血管破裂或远离靶器官的其他器官的产物。结果提示,通过心脏受损,发现舒张压功能受损影响血液中miRNA差异表达,当心脏血液注后,miRNA通过细胞间通道,随血液到达病灶器官,发挥一定功能。这可为心脏病药物开发或者疾病诊断的提供依据
3.8 miR-1246与其他疾病Baraniskin等[45]认为它是一个胰腺导管腺癌和结肠癌的血清肿瘤标记物,通过对植入原代人胰腺导管腺癌(PDAC)裸小鼠的血清分析发现miR-1246可与RNU2-1片段(RNU2-1f)杂交存在于病人血清中,提示miR-1246可由目标细胞释放到血液,乳液和导管的液体,但miRNA的释放有选择性,选择释放的miRNA可能与恶性肿瘤相关。Pigati等[46]报道它与乳腺癌有关,miR-1246可被乳腺癌细胞选择性地释放出细胞外,且这种选择性与细胞的恶性程度密切相关,可能与ECM有关。Xu等[47]研究发现人神经母细胞瘤中感染HEV71后,可特异性诱导miR-1246的表达,并通过调节其靶基因DLG3的表达参与了神经系统发病调控。Zheng等[48]对热应激奶牛miRNA高通量测序分析发现共有52个差异表达极显著的miRNA,主要包括miRNA-1246、miR-181a、miR-19a等,而miR-1246主要与机体免疫功能有关,尤其与Toll样受体(Toll like receptor,TLR)密切相关。Sarachana等[49]研究表明非编码小RNA存在于血友病人血液中,且检测发现,病人中存在抗第八因子(factor Ⅷ,F8)中性抑制剂,鉴定出miR-1246能与F8非编码区靶位点相结合,并在淋巴细胞中稳定表达。Wang等[50]研究发现miR-1246在结肠癌组织中显著表达,且可下调HCT-116和LOVO CRC细胞CycG2基因的表达,而过表达miR-1246会导致细胞增殖、迁移和侵袭。以上研究均只停留在miR-1246的表达水平检测。但关于miR-1246如何作用于疾病过程,仍有许多谜团未解开。要彻底了解miR-1246在疾病中的具体作用机制,还需要进一步结合动物模型,进行更深入的分子机理研究。
4 展望综上,miR-1246与癌症、肿瘤、埃博拉病毒传染病、免疫疾病等都存在一定关系,而在这些疾病中,miR-1246主要作为一个抑制剂起作用,但在有些癌症和细胞中,miR-1246也显示出促进作用,可能原因是其发挥的作用与它所处的组织细胞环境密切相关。但同时也必须指出,以上miR-1246与疾病的相关研究结果,大部分都是以病理细胞及病理组织为研究对象获得的。而以miR-1246的过表达或敲除动物模型为材料的活体内研究比较少,因此不能较好地展现出miR-1246在疾病发生、发展过程中所发挥的作用和调控的相关分子信号通路。若要更深入的挖掘miR-1246的临床意义,还需构建miR-1246的过表达或敲除动物模型。
总之,miRNA介导的转录后水平的表达调控是目前疾病诊断标记研究领域的新方向和切入点,医用需求十分迫切。尤其在对癌症疾病的诊疗上,研发有效的miRNA激活剂或抑制剂就显得尤为必要。利用miRNA敲降或过表达技术,可以“纠正”病理状态下异常表达的miRNA;厘清miRNA介导的基因调控机制研究,加强序列同源性检测,可以降低脱靶效应;开发组织特异性或诱导型的miRNA抑制剂控制miRNA的过度活跃或通过外源导入方式补偿病态下表达下调的miRNA,可达到治疗疾病的目的。如表 1列举了几种miRNA治疗方法及特点。
目前,已有药物制造商生产出应用于临床的miRNA治疗试剂,尽管仍旧存在着较多问题,但随着miRNA研究的深入与成熟,相关药物开发和临床治疗也将提上日程。相信在不久的将来,随着miRNA分子诊断技术不断地评估完善及推广应用,医疗界会逐步建立起以分子诊断、仪器化疗、药品辅疗等多学科交叉诊疗相结合的科学医疗模式,miRNA在医疗应用领域定会取得突破性进展。
| [1] | Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4, encodes small RNAs with antisense complementarity to lin-14. Cell, 1993, 75 (5): 843–854. DOI:10.1016/0092-8674(93)90529-Y |
| [2] | Dooley AL, Winslow MM, Chiang DY, et al. Nuclear factor I/B is an oncogene in small cell lung cancer. Genes & Development, 2011, 25 (14): 1470–1475. |
| [3] | Kosaka N, Iguchi H, Ochiya T, et al. Circulating microRNA in body fluid:a new potential biomarker for cancer diagnosis and prognosis. Cancer Science, 2010, 101 (10): 2087–2092. DOI:10.1111/cas.2010.101.issue-10 |
| [4] | Pigati L, Yaddanapudi SCS, Iyengar R, et al. Selective release of microRNA species from normal and malignant mammary epithelial cells. PLoS One, 2010, 5 (10): e13515. DOI:10.1371/journal.pone.0013515 |
| [5] | Suzuki HI, Yamagata K, Sugimoto K, et al. Modulation of microRNA processing by p53. Nature, 2009, 460 (7254): 529–533. DOI:10.1038/nature08199 |
| [6] | Liao JM, Zhou X. New insights into p53 functions through its target microRNAs. J Mol Cell Biol, 2014, 6 (3): 206–213. DOI:10.1093/jmcb/mju018 |
| [7] | Gregory RI, Chendrimada TP, Cooch N, et al. Human RISC couples microRNA biogenesis and posttranscriptional gene silencing. Cell, 2005, 123 (4): 631–640. DOI:10.1016/j.cell.2005.10.022 |
| [8] | Baek D, Villén J, Shin C, et al. The impact of microRNAs on protein output. Nature, 2008, 455 (7209): 64–71. DOI:10.1038/nature07242 |
| [9] | Chen J, Yao D, Zhao S, et al. MiR-1246 promotes SiHa cervical cancer cell proliferation, invasion, and migration through suppression of its target gene thrombospondin 2. Arch Gynecol Obstet, 2014, 4 : 725–732. |
| [10] | Kim H, Watkinson J, Varadan V, et al. Multi-cancer computational analysis reveals invasion-associated variant of desmoplastic reaction involving INHBA, THBS2 and COL11A1. American Geophysical Union, 2010, 3 (4): 367–376. |
| [11] | Doeberitz MVK, Rittmüller C, Hausen HZ, et al. Inhibition of tumorigenicity of cervical cancer cells in nude mice by HPV e6-e7 anti-sense RNA. Int J Cancer NLM, 1992, 5 : 831–834. |
| [12] | Bosch FX, Ribes J, Díaz M, et al. Primary liver cancer:worldwide incidence and trends. Gastroenterology, 2004, 127 (5 Suppl 1): S5–S16. |
| [13] | Sun Z, Meng C, Wang S, et al. MicroRNA-1246 enhances migration and invasion through CADM1 in hepatocellular carcinoma. Molecular Oncology, 2014, 14 (1): 1–11. |
| [14] | Zhang Q, Cao LY, Cheng SJ, et al. P53-induced microRNA-1246 inhibits the cell growth of human hepatocellular carcinoma cells by targeting NFIB. Oncol Rep, 2015, 33 (3): 1335–1341. |
| [15] | Bouyssou JMC, Manier S, et al. Regulation of microRNAs in cancer metastasis. Biochim Biophys Acta, 2014, 2 : 255–265. |
| [16] | Perry BC, Soltys D, Toledo AH, et al. Tumor necrosis factor-α in liver ischemia/reperfusion injury. J Invest Surg, 2011, 24 (4): 178–188. DOI:10.3109/08941939.2011.568594 |
| [17] | Leal JA, Lleonart ME. MicroRNAs and cancer stem cells:therapeutic approaches and future perspectives. Cancer Lett, 2013, 338 (1): 174–183. DOI:10.1016/j.canlet.2012.04.020 |
| [18] | Huang W, Li H, Luo R, et al. The microRNA-1246 promotes metastasis in non-small cell lung cancer by targeting cytoplasmic polyadenylation element-binding protein 4. Diagn Pathol, 2015, 10 (1): 1–10. DOI:10.1186/s13000-014-0231-7 |
| [19] | Kim G, An HJ, Lee MJ, et al. Hsa-miR-1246 and hsa-miR-1290 are associated with stemness and invasiveness of non-small cell lung cancer. Lung Cancer, 2015, 91 : 15–22. |
| [20] | Antonarakis SE, Lyle R, Dermitzakis ET, et al. Chromosome 21 and down syndrome:from genomics to pathophysiology. Nat Rev Genet, 2004, 5 (10): 725–738. DOI:10.1038/nrg1448 |
| [21] | Becker W, Sippl W. Activation, regulation, and inhibition of DYRK1A. Febs Journal, 2011, 278 (2): 246–256. DOI:10.1111/j.1742-4658.2010.07956.x |
| [22] | Yang EJ, Ahn YS, Chung KC, et al. Protein kinase Dyrk1 activates cAMP response element-binding protein during neuronal differentiation in hippocampal progenitor cells. J Biol Chem, 2001, 276 (43): 39819–39824. DOI:10.1074/jbc.M104091200 |
| [23] | Arron JR, Winslow MM, Polleri A, et al. NFAT dysregulation by increased dosage of DSCR1 and DYRK1A on chromosome 21. Nature, 2006, 441 (7093): 595–600. DOI:10.1038/nature04678 |
| [24] | Gwack Y, Sharma S, Nardone J, et al. A genome-wide drosophila RNAi screen identifies DYRK-family kinases as regulators of NFAT. Nature, 2006, 441 (441): 646–650. |
| [25] | Woods Y, Rena GN, Barthel A, et al. The kinase DYRK1A phosphorylates the transcription factor FKHR at Ser329 in vitro, a novel in vivo phosphorylation site. Biochemical Journal, 2001, 355 (Pt 3): 597–607. |
| [26] | Liao JM, Zhou X, Zhang Y, et al. MiR-1246:a new link of the p53 family with cancer and down syndrome. Cell Cycle, 2012, 11 (14): 2624–2630. DOI:10.4161/cc.20809 |
| [27] | Zhang Y, Liao JM, Zeng SX, et al. P53 downregulates down syndrome-associated DYRK1A through miR-1246. Embo Reports, 2011, 12 (8): 811–817. DOI:10.1038/embor.2011.98 |
| [28] | Colebunders R, Borchert M. Ebola haemorrhagic fever -a review. Journal of Infection, 2000, 40 (1): 16–20. DOI:10.1053/jinf.1999.0603 |
| [29] | Sheng MM, Zhong Y, et al. Hsa-miR-1246, hsa-miR-320a and hsa-miR-196b-5p inhibitors can reduce the cytotoxicity of ebola virus glycoprotein in vitro. Sci China Life Sci, 2014, 10 : 959–972. |
| [30] | Provencal M, Michaud M, Beaulieu E, et al. Tissue factor pathway inhibitor (TFPI) interferes with endothelial cell migration by inhibition of both the Erk pathway and focal adhesion proteins. Thromb Haemost, 2008, 99 (3): 576–585. |
| [31] | Chen J, Zhang B, Pan C, et al. Effects of monocyte chem-otactic protein-3 on ICAM-1, VCAM-1, TF, and TFPI expression and apoptosis in human umbilical vein endothelial cells. Nan Fang Yi Ke Da xue xue Bao, 2013, 33 : 86–92. |
| [32] | Belkin AM, Smalheiser NR. Localization of cranin (dystroglycan) at sites of cell-matrix and cell-cell contact:recruitment to focal adhesions is dependent upon extracellular ligands. Cell Adhesion & Communication, 1996, 4 (4-5): 281–296. |
| [33] | Brancaccio A. DAG1, no gene for RNA regulation. Gene, 2012, 497 (1): 79–82. DOI:10.1016/j.gene.2012.01.046 |
| [34] | Winckers K, Cate HT, Hackeng TM, et al. The role of tissue factor pathway inhibitor in atherosclerosis and arterial thrombosis. Blood Reviews, 2013, 27 (3): 119–132. DOI:10.1016/j.blre.2013.03.001 |
| [35] | He MX, He YW. CFLAR/c-FLIPL:a star in the autophagy, apoptosis and necroptosis alliance. Autophagy, 2013, 9 (5): 791–793. DOI:10.4161/auto.23785 |
| [36] | Javierre BM, Richardson B. A new epigenetic challenge:systemic lupus erythematosus. Adv Exp Med Biol, 2011, 711 : 117–136. DOI:10.1007/978-1-4419-8216-2 |
| [37] | Liu A, La CA. Epigenetic dysregulation in systemic lupus erythematosus. Autoimmunity, 2014, 47 (4): 215–219. DOI:10.3109/08916934.2013.844794 |
| [38] | Deng Y, Tsao BP. Advances in lupus genetics and epigenetics. Current Opinion in Rheumatology, 2014, 26 (5): 482–492. DOI:10.1097/BOR.0000000000000086 |
| [39] | Guo Y, Sawalha AH, Lu Q, et al. Epigenetics in the treatment of systemic lupus erythematosus:potential clinical application. Clinical Immunology, 2014, 155 (1): 79–90. DOI:10.1016/j.clim.2014.09.002 |
| [40] | Ming Z, Liu S, Luo S, et al. DNA methylation and mRNA and microRNA expression of SLE CD4+ T cells correlate with disease phenotype. J Autoimmu, 2014, 54 : 127–136. DOI:10.1016/j.jaut.2014.07.002 |
| [41] | Yébenes VGD, Bartolomé-Izquierdo N, Ramiro AR, et al. Regula-tion of B-cell development and function by microRNAs. Proc Spie, 2013, 253 (1): 25–39. |
| [42] | Luo S, Yu L, Liang G, et al. The role of microRNA-1246 in the regulation of B cell activation and the pathogenesis of systemic lupus erythematosus. Clinical Epigenetics, 2015, 7 (1): 1–13. DOI:10.1186/s13148-014-0036-2 |
| [43] | Nair N, Kumar S, Gongora E, et al. Circulating miRNA as novel markers for diastolic dysfunction. Molecular & Cellular Biochemistry, 2013, 376 (1-2): 33–40. |
| [44] | Melissa PH, Noura I, Zhang XL, et al. Detection of microRNA expression in human peripheral blood microvesicles. PLoS One, 2008, 3 (11): e3694. DOI:10.1371/journal.pone.0003694 |
| [45] | Baraniskin A, Maike A, Steffen GJ, et al. Circulating U2 small nuclear RNA fragments as a novel diagnostic biomarker for pancreatic and colorectal adenocarcinoma. Int J Cancer NLM, 2013, 132 (2): E48–E57. DOI:10.1002/ijc.27791 |
| [46] | Pigati L, Yaddanapudi SCS, Iyengar R, et al. Selective release of microRNA species from normal and malignant mammary epithelial Cells. PLoS One, 2010, 5 (10): e13515. DOI:10.1371/journal.pone.0013515 |
| [47] | Xu LJ, Jiang T, Zhao W, et al. Parallel mRNA and microRNA profiling of HEV71-infected human neuroblastoma cells reveal the up-regulation of miR-1246 in association with DLG3 repression. PLoS One, 2014, 9 (4): e95272–e95272. DOI:10.1371/journal.pone.0095272 |
| [48] | Zheng Y, Chen KL, Zheng XM, et al. Identification and bioinformatics analysis of microRNAs associated with stress and immune response in serum of heat-stressed and normal Holstein cows. Cell Stress Chaperones, 2014, 6 : 973–981. |
| [49] | Sarachana T, Dahiya N, Simhadri VL, et al. Small ncRNA expression-profiling of blood from hemophilia A patients identifies miR-1246 as a potential regulator of factor 8 gene. PLoS One, 2015, 10 (7): 1–14. |
| [50] | Wang S, Zeng Y, Zhou JM, et al. MicroRNA-1246 promotes growth and metastasis of colorectal cancer cells involving CCNG2 reduction. Mol Med Rep, 2016, 13 (1): 273–280. |
| [51] | Shan D, Ding X, Song X, et al. Roles of microRNAs in cardiovascular diseases therapeutics. Chemistry of Life, 2013, 33 (4): 427–432. |






