漆酶(p-diphenol:oxygen oxidoreductase,EC 1.10.3.2)含有4个铜离子,能以氧气作为电子供体,氧化多种化合物,反应过程中的副产物为水,是一种氧化能力较强的氧化还原酶[1-3]。它在许多领域有着广泛的应用,如环境保护、造纸工业、化学合成、生物传感器、医学检测等,也是一种为数不多的已经被商业化应用的酶类[4, 5]。酶的生产和使用成本是酶在商业化应用过程必须考虑的一个经济问题。游离酶在反应完成后,难以从反应液中回收和重复利用,并且易受到环境因子影响而导致酶失活,这些缺点会阻碍酶的商业化应用[6]。目前解决这个问题的最好方法是使酶固定化,固定化后的酶能抵抗外部不利因子从而减少酶的失活,并且固定化酶能易于回收和重复使用[7]。
如何提高酶的固定化效率、增加酶活性和改善酶回收率是酶固定化中面临的几个难题[8],而采用优良的固定化载体是解决这些问题的一个有效方法。目前,用于酶固定化的载体比较多,有高分子化合物(树脂、壳聚糖、纤维素和明胶等),还有天然富含孔隙的物质(黏土、二氧化硅和活性炭等)[6-9]。伴随着纳米技术的不断发展,应用于酶固定的纳米材料越来越多,如纳米二氧化硅、碳纳米管、金纳米和磁纳米等[10, 11]。相比较于其他固定化载体,纳米载体用于酶的固定化具有以下几个优点:其一,纳米材料比表面积大;其二,内部有很多微小孔径;其三,纳米表面易于修饰,这些优点有利于提高酶的负载量和酶的附着与偶联,从而提高单位载体量的固定化酶活力[12]。研究表明,一些具有导电性能的纳米材料用于酶的固定化,能提高氧化还原酶类的活性,如当碳纳米管作为酶固定化材料时,能够提高固定化酶(如过氧化氢酶、抗坏血酸氧化酶和漆酶)的活性[13]。近几年,有研究者利用聚苯胺纳米纤维来固定辣根过氧化物,结果表明聚苯胺是一种高效的酶固定化载体[14]。但这种载体存在一个不足之处:用聚苯胺固定化的酶在回收的时候,需要通过离心等方式来回收,耗能耗时且使用效率降低,增加了酶的应用成本。为了解决这个问题,可以使聚苯胺和磁性纳米复合在一起,形成一种易于通过磁性回收的纳米复合物。磁性聚苯胺纳米复合物具有以下优点:其一,纤维状的聚苯胺比表面积大且孔隙多有利于提高酶负载量;其二,聚苯胺含有丰富的氨基,不需要进一步修饰其他基团就能通过戊二醛和酶进行偶联;其三,聚苯胺具有高效的导电性能,作为氧化还原酶的固定化载体有利于酶的电子传递;其四,磁性的固定化酶在反应液中可通过磁铁吸附方便回收,有利于节能省时,从而减少酶的应用成本。目前,将磁性聚苯胺纳米纤维作为酶固定化载体的报道还较少。
本研究首先制备出磁性纳米颗粒,然后将其与苯胺单体混合在一起,使苯胺在聚合的过程中将磁性纳米颗粒包裹起来,从而形成具有磁性的聚苯胺纳米纤维,再通形成酶聚集体的方式使漆酶固定到纳米纤维上,最后比较游离漆酶和固定化酶的活性和稳定性等,旨在为发展漆酶的固定化载体和其应用提供理论基础。
1 材料与方法 1.1 材料2,2’-连氮-双-(3-乙基苯并噻吡咯啉-6-磺酸)(ABTS)购自美国Sigma公司,漆酶购自中国夏盛实业集团有限公司,其他试剂均为国产分析纯。
1.2 方法 1.2.1 磁性纳米颗粒的制备Fe3O4纳米粒子的合成如下[15]:在室温下,将1.988 g FeCl2.4H2O和5.46 g FeCl3.6H2O加入到60 mL去离子水中,搅拌混匀,然后加热到80℃,再搅拌25 min后逐滴加入氨水(约20 mL),使混合液pH值达到10。再经过30 min的搅拌,通过磁铁回收黑色的沉淀物,用去离子水洗涤沉淀数次,直到得到洗涤液pH值为7,最后将纳米颗粒于60℃下真空干燥8 h备用。
1.2.2 磁性Fe3O4/聚苯胺纳米纤维的合成以磷酸作为苯胺聚合过程中的酸掺杂剂,通过原位聚合方法制备Fe3O4/聚苯胺纳米纤维[16],合成途径如图 1所示。步骤如下:将0.3 mL的苯胺单体和不同量的(0.01 g,0.0 5g,0.1 g)的Fe3O4纳米粒子分别加入到20 mL去离子水中,再加入1.5 mL磷酸。在15℃下,将混合液超声搅拌10 min,然后将6 mL过硫酸铵(APS,0.1 g/mL)溶液加入到上述混合液中。放置过夜后,通过磁铁分离回收黑色沉淀,再用去离子水和甲醇冲洗3次。最后,将黑色沉淀于60℃下真空干燥24 h备用。

|
| 图 1 磁性Fe3O4/聚苯胺纳米纤维的合成及漆酶固定化示意图 |
取0.05 g Fe3O4/聚苯胺纳米纤维溶于5 mL蒸馏水中,超声分散5 min,再加入1 mL漆酶(0.5 mg/mL),随后加入7 mL冰浴的饱和硫酸铵,将混合液于4℃静置40 min。在上述溶液中,加入0.4 mL戊二醛(GA,含量25%),室温振荡2.5 h,最后用磁铁分离回收沉淀,并用去离子水洗涤多次直至洗涤液中无漆酶活性,所得沉淀即为固定化酶。载体的酶负载量=加入的酶蛋白量-溶液中残留的酶蛋白量。
1.2.4 Fe3O4/聚苯胺固定漆酶前后电化学分析采用循环伏安法分析电流变化,分别将大约相同量的Fe3O4/聚苯胺和漆酶-Fe3O4/聚苯胺纳米复合物涂布在Pt电极上,室温下用氮气小心吹干,在三电极系统工作模式下,以pH 3.5醋酸钠缓冲溶液为电极工作液,测定Fe3O4/聚苯胺载体在固定漆酶前后电流变化。
1.2.5 游离漆酶和固定化漆酶性质比较漆酶活性测定以ABTS(0.2 mol/L)作为底物,反应温度为25℃,反应体系共3 mL,分别为2.7 mL缓冲液(50 mmol/L醋酸钠缓冲溶液,pH4.0)、0.1 mL酶液或含有一定量固定化酶、0.2 mL ABTS,记下反应3 min前后在波长420 nm的吸光值变化。游离酶一个酶活力单位(U):在上述条件下,每分钟催化1 μmol ABTS氧化所需的酶量。固定化酶活力单位:每毫克干重固定化酶每分钟转化底物的量。
1.2.5.1 最适反应pH在酶活性测定时,将反应体系缓冲液换成不同pH磷酸氢二钠-柠檬酸缓冲液缓冲液(0.2 mol/L,pH2-6)测其活力。
1.2.5.2 最适反应温度先将加有底物的反应缓冲液在不同温度(30-70℃,以5℃为间隔)下保温5 min,然后加入酶液测其活力。
1.2.5.3 温度稳定性将含有酶的缓冲液放在50℃烘箱孵育,每隔30 min,取出部分酶液测定酶活性,共4 h。
1.2.5.4 储存稳定性将含有酶的缓冲液放在4℃冰箱中箱孵育,每隔几天取出部分酶液测定酶活性,共30 d。
1.2.5.5 重复使用稳定性在每次催化反应完成后,用磁铁吸附回收固定化酶并洗涤3次,然后加入到新的反应体系中,检测酶活性,共8次。
2 结果 2.1 磁性Fe3O4/聚苯胺纳米纤维的合成及其特征如图 2-A所示,化学共沉淀的方法合成出的磁性纳米颗粒大约在20 nm以下,表现出团聚现象。从图 2-B来看,苯胺合成聚苯胺后,表现出纤维状,存在有分支,电子衍射图中没有小光点,表明其成分单一,没有晶体存在,是一种无定形结构。如图 2-C所示,合成出的磁性Fe3O4/聚苯胺纳米纤维,相互交联在一起形成纳米纤维垫,而其表面和纤维簇的内部明显存在有很多团聚的磁性纳米颗粒,其电子衍射图中则存在很多闪亮的小光点,表明聚苯胺中有晶体物质存在。合成磁性Fe3O4/聚苯胺纳米纤维能很好的分散在水中,用磁铁能迅速将其吸附(图 2-D)。红外光谱图显示,在3 400 cm-1左右的峰是N-H或O-H的振动峰,其中纳米纳米纤维(图 3-C)中1 613、1 305和1 140 -1处均出现较强的吸收峰,它们分别归属于苯环的C=C伸缩振动以及C-N和C=N的伸缩振动,而570 -1左右的峰是Fe-O的特征峰[17]。磁性Fe3O4/聚苯胺纳米纳米纤维中的红外图谱明显包含有磁性纳米颗粒和聚苯胺的特征峰。这些结果证实了磁性Fe3O4/聚苯胺纳米纤维被成功合成。

|
| 图 2 电镜图片和Fe3O4/聚苯胺复合物磁性吸附 A:Fe3O4;B:聚苯胺;C:Fe3O4/聚苯胺;D:磁力吸附 |

|
| 图 3 红外光谱图 A:Fe3O4;B:聚苯胺;C:Fe3O4/聚苯胺 |
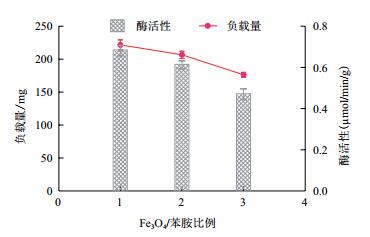
采用不同比例的Fe3O4纳米颗粒与苯胺单体相结合时,尽管其最后形成的纳米纤维形态结构没有差别,但从电镜图片从可以看出(图 4),随着Fe3O4纳米颗粒量的增加,在聚苯胺中的磁性纳米颗粒数量明显提高,并且相应的磁力响应时间也大大减少。其中当Fe3O4:苯胺(0.01 g:0.3 mL)比例较低时,生成的Fe3O4/聚苯胺纳米纤维磁力响应时间在8 min以上,且有部分颗粒漂浮在溶液中,这可能是部分聚苯胺中包裹的磁性纳米颗粒量减少,导致纳米纳米纤维的磁力非常弱。另外,随着Fe3O4纳米颗粒在Fe3O4/聚苯胺纳米纤维中比例的增加,对应酶蛋白的负载量减少,且相应的单位固定化酶的活性也逐渐降低(图 5)。主要原因是在Fe3O4/聚苯胺复合物中,相同的单位重量下,随着Fe3O4纳米颗粒增加,苯胺的比例就会减少,而苯胺中的氨基是负载酶蛋白的主要基团。

|
| 图 4 不同比例的Fe3O4与苯胺形成的Fe3O4/聚苯胺纳米纤维电镜图片 A:苯胺;B:Fe3O4:苯胺(0.01 g:0.3 mL);C:Fe3O4:苯胺(0.05 g:0.3 mL);D:Fe3O4:聚苯胺(0.1 g:0.3 mL) |
|
| 图 5 不同比例的Fe3O4与苯胺对负载量和酶活性影响 1:Fe3O4:苯胺(0.01 g:0.3 mL);2:Fe3O4:苯胺(0.05 g:0.3 mL);3:Fe 3O4:聚苯胺(0.1 g:0.3 mL) |
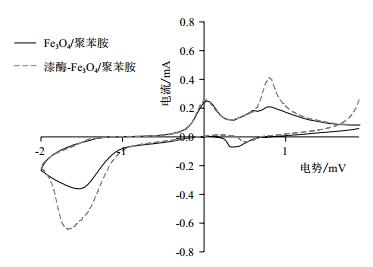
对比Fe3O4/聚苯胺载体固定漆酶前后的电流(图 6)可以发现,载体固定漆酶后,其氧化还原电位峰值有一定的位移,同时其峰值上升,这可能是漆酶的固定在载体上后所引起的,这一结果也表明漆酶与Fe3O4/聚苯胺载体间存在有一定电子交流。
|
| 图 6 Fe3O4/聚苯胺固定漆酶前后的电流变化 |
从图 7-A中可以看出,当载体量固定不变时,随着酶浓度增加,Fe3O4/聚苯胺载体对蛋白的负载量逐渐增加,在漆酶浓度为0.6 mg/mL时,其负载量达到饱和。继续增加酶浓度,负载量不再增加,最大负载量在210 mg/g。如图 7-B所示,当酶浓度固定不变时,随着吸附时间的增加,Fe3O4/聚苯胺载体对蛋白的负载量也逐渐增加,吸附时间在30 min时,其负载量达到饱和。继续延长吸附时间,负载量不再增加,其负载平衡时间约在30 min。

|
| 图 7 Fe3O4/聚苯胺负载漆酶量和吸附平衡时间 A:漆酶蛋白浓度对负载量的影响;B:吸附平衡时间对负载量的影响 |
从图 8可以看出游离酶的最适pH为4,而固定化酶的最适pH约为3.5,略向酸性pH偏移,在整个酸性pH范围内固定化酶的相对酶活性要高于游离酶。固定化酶和游离酶的最适温度都大约在60℃,但固定化酶对温度的敏感性要低于游离酶(图 9)。当温度超过60℃时,游离酶下降很明显,而固定化酶的酶活性下降较少。

|
| 图 8 pH对酶活性影响 |

|
| 图 9 温度对酶活性影响 |
图 10结果显示,在50℃时,固定化酶和游离酶随着孵育时间的延长,变化趋势基本相同,酶活性都有不同程度的下降,但游离酶的下降幅度要高于固定化酶。固定化酶孵育240 min后还能保持大约50%的酶活性,而游离酶活性只能保留25%的酶活性,这表明漆酶被固定于磁性聚苯胺后,其热稳定性得到明显提高。

|
| 图 10 酶热稳定性 |
图 11显示了游离漆酶和固定化酶在4℃时的储存稳定性,尽管随着时间的增加,两种形态的酶活性都下降,但游离酶活性下降更快。储存30 d后,游离漆酶活性仅保留27%,而固定化酶活性仍能保留60%。

|
| 图 11 漆酶储存稳定性 |
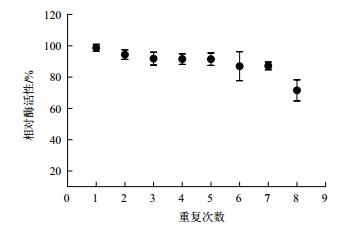
图 12所示,固定化漆酶能催化底物ABTS从无色变成绿色,反应结束后,可通过磁铁快速将固定化酶吸附回收,回收的固定化酶洗涤后可进行下一轮催化反应。固定化酶重复操作稳定性结果如图 13所示,经过第一轮循环后,酶活性下降了9%,而随后4次循环中,酶活性基本保持不变。在经过8次循环后,固定化酶活性还能保持70%以上活性,结果表明固定化酶能循环使用,并保持较好的稳定性。

|
| 图 12 固定化酶磁性回收 |
|
| 图 13 固定化酶重复使用 |
聚苯胺纳米纤维易于合成且成本低,已被广泛应用于电化学和传感器等领域[18]。近年来,研究者发现聚苯胺纳米纤维具有高比表面积和多孔隙,很适合于作为酶的固定化载体[19]。对于固定化酶而言,易于回收利用是减少酶应用成本的一种方法,但直接以聚苯胺纳米纤维为载体的固定化酶需要经过沉淀或离心等方式来回收,增加了使用成本,不利于酶的商业应用。而以磁性聚苯胺纳米纤维作为酶载体时,则可以通过简单的磁力吸附来回收固定化酶,其易于回收性能够进一步降低酶的应用成本。本研究中,通过使漆酶和载体共沉淀形成一种聚集体,然后再通过戊二醛和载体的氨基连接,从而形成固定化酶,而不是采用使游离酶通过戊二醛和载体直接交联的方法。交联酶聚集体是一种固定酶的方法,由一种酶蛋白和少量交联剂组成,无惰性载体,具有酶活高和稳定性强等特点[20]。采取这种方法,可以使单位体积中酶的浓度增加,从而进一步提高固定化酶的活性。Lee等[21]已经证实,通过酶聚集体方法将漆酶固定在磁性纳米颗粒上,可大大提高的固定化酶的活性。
在保持苯胺的量一定时,添加不同量的Fe3O4,结果显示所形成Fe3O4/聚苯胺纳米纤维结构与不加磁性纳米颗粒的聚苯胺结构类似。但相同重量的Fe3O4/聚苯胺纳米纤维对漆酶蛋白的负载量却随着Fe3O4的比例增加而减少,主要原因是在重量不变的前提下,Fe3O4的量增加会导致纳米纤维中苯胺量减少,而苯胺是负载酶蛋白的主要成分。尽管苯胺的比例增加有利于增加酶负载量,但Fe3O4的量过少时,形成的Fe3O4/聚苯胺纳米纤维磁性太弱而不利于固定化酶的磁力回收,因此探索合适的Fe3O4和苯胺的比例有利于既能保证载体合适的酶负载量,同时又能保证其有足够的磁性,这在将来的实践中有待于进一步优化它们的比例。文献表明,刘宇等[22]制备的磁性SiO2对负载漆酶蛋白的量为58 mg/g,姜德生等[23]制备的磁性壳聚糖微球漆酶蛋白的量约为40 mg/g,而本研究所合成Fe3O4/聚苯胺纳米纤维负载酶蛋白的量高达210 mg/g,这比部分文献报道的合成载体负载漆酶的量要大很多,这可能与聚苯胺纳米纤维具有高比表面积和多孔隙有关,同时也表明Fe3O4/聚苯胺纳米纤维在酶固定化上有潜在的应用前景。
相比较游离酶,固定化酶的最适pH值向酸性偏移,并且在酸性pH范围(pH2-6)的相对酶活性较高,这一结果可能和聚苯胺导电性有关。聚苯胺的导电性和溶液中质子(H+)的传递有关,当溶液pH小于4时,聚苯胺导电性会大大增强[24]。由于漆酶是一种氧化还原酶,其对底物的氧化涉及到电子传递,而作为酶载体的聚苯胺在固定化酶催化的过程中,可能起到了电子传递的作用,Fe3O4/聚苯胺纳米纤维固定漆酶前后的电流变化证实了漆酶和载体间存在有电子流动。丁杭军[14]等报道了用聚苯胺固定辣根过氧化物酶时有类似的现象。Lalaoui等[25]用导电性的碳纳米管固定漆酶,发现碳纳米管能明显提高固定化酶的活性,并证实酶活性的提高与碳纳米管的导电性有关。本研究所合成Fe3O4/聚苯胺纳米纤维和固定的漆酶之间存在电子交流,有利于固定化漆酶活性提高,这是其它非导电载体不具有的特点。
固定化酶的热稳定性和储存稳定性能得到明显的改善,这是因为载体可以为酶提供保护作用,避免酶受到环境不利因子的影响而变性,这一特性在酶的应用中非常重要。固定化酶另外一个特征是能重复使用,本研究中的固定化漆酶重复使用8次后还能保留70%的酶活性,证明了磁性聚苯胺纳米纤维固定化漆酶有较好的重复使用稳定性,但也存在部分酶活性的降低,这可能和下列几个因素有关:其一,酶反应产物的积累所带来的反馈抑制;其二,在酶的催化反应过程中,需要进行剧烈的振荡,可能有部分酶从载体上脱落;其三,尽管磁性纳米颗粒被包裹在聚苯胺中,但在反应的振荡过程中,由于物理作用会导致磁性纳米颗粒从载体上释放出来,从而导致部分载体没有磁性,结果在磁力回收的过程中没有磁性的固定化酶会随着上清液的废弃而丢失,这一个问题值得进一步探究解决。
4 结论本研究构建了一种磁性聚苯胺纳米纤维作为漆酶的固定化载体,电镜观察和红外光谱图证实该纳米纳米纤维被成功合成,漆酶通过交联酶集体的方式被固定在载体上。不同比例的Fe3O4与苯胺对Fe3O4/聚苯胺纳米纤维结构没有影响,但随着Fe3O4的比例增加,合成的载体对漆酶的负载量影响却减少。其最大负载量210 mg/g,并且漆酶与Fe3O4/聚苯胺载体间存在有一定电子交流。固定化酶最适pH向酸性偏移,并在酸性pH范围保持较高的酶活性;固定化酶的最适温度和游离酶基本一致,但其热稳定性和储存稳定性都有明显的提高。另外,固定化酶重复使用8次后还能保留70%的酶活性,其可通过磁力吸附的方式从反应液中进行回收再使用。这些结果表明磁性聚苯胺纳米纤维是一种优良的酶固定化载体,可以实现酶的高效固定化。
| [1] | 罗爽, 谢天, 刘忠川, 等. 漆酶/介体系统研究进展. 应用与环境生物学报, 2015, 21(6): 987–995. |
| [2] | 李瑞云, 栗君. 漆酶对染料废水脱色的应用研究. 环境科学与管理, 2015, 40(9): 98–100. |
| [3] | Mogharabi M, Faramarzi MA. Laccase and laccase-mediated systems in the synthesis of organic compounds. Advanced Synthesis & Catalysis, 2014, 356 (5): 897–927. |
| [4] | 王祎宁, 赵国柱, 谢响明, 等. 漆酶及其应用的研究进展. 生物技术通报, 2009(5): 35–38. |
| [5] | 张鹏, 王延锋, 潘春磊, 等. 食用菌漆酶生物学性质及其应用研究进展. 生物技术通报, 2014(9): 39–44. |
| [6] | 王苗苗, 李群艳, 韦奇, 等. 介孔SiO2/Fe3O4中空磁性微球的漆酶固定化. 高等学校化学学报, 2013, 34(2): 299–305. |
| [7] | 袁炳楠, 董其飞, 陈成, 等. 纳米磁性载体在固定化漆酶技术中的应用. 安徽农业科学, 2015, 45(18): 22–23. |
| [8] | 李丽娟, 马贵平, 赵林果. 固定化酶载体研究进展. 中国生物工程杂志, 2015, 35(11): 105–113. |
| [9] | 钱洁, 季敏. 固定化漆酶载体研究进. 系统工程理论与实践, 2015, 10(1): 228–238. |
| [10] | 尹艳丽, 王爱玲, 曹健, 等. 纳米载体固定化酶的研究. 现代化工, 2007, 27(9): 67–70. |
| [11] | 王香玉.磁性纳米载体的制备及在酶固定化中的应用[D].镇江:江苏大学, 2015. |
| [12] | Ansari SA, Husain Q. Potential applications of enzymes immobilized on/in nano materials:A review. Biotechnology Advances, 2012, 30 (3): 512–23. DOI:10.1016/j.biotechadv.2011.09.005 |
| [13] | Wang Z, Li M, Su P, et al. Direct electron transfer of horseradish peroxidase and its electrocatalysis based on carbon nanotube/thionine/gold composites. Electrochemistry Communications, 2008, 10 (2): 306–310. DOI:10.1016/j.elecom.2007.12.011 |
| [14] | 丁杭军, 文湘华, 杨洲, 等. 聚苯胺纳米纤维固定化辣根过氧化物酶的合成及性能研究. 高分子学报, 2014, 37(5): 701–707. |
| [15] | Cao J, Wang Y, Yu J, et al. Preparation and radiolabeling of surface-modified magnetic nanoparticles with rhenium-188 for magnetic targeted radiotherapy. Journal of Magnetism & Magnetic Materials, 2004, 277 (1-2): 165–174. |
| [16] | Zhang Z, Wan M, Wei Y. Electromagnetic functionalized polyaniline nanostructures. Nanotechnology, 2005, 16 (12): 2827–2832. DOI:10.1088/0957-4484/16/12/016 |
| [17] | Lakouraj MM, Zare EN, Moghadam PN. Synthesis of novel conductive poly (p-phenylenediamine)/ Fe3O4, nanocomposite via emulsion polymerization and investigation of antioxidant activity. Advances in Polymer Technology, 2014, 33 (1): 509–509. |
| [18] | 杨显.功能酸掺杂聚苯胺材料的制备及性能研究[D].郑州:河南大学, 2014. |
| [19] | Lee G, Kim J, Lee JH. Development of magnetically separable polyaniline nanofibers for enzyme immobilization and recovery. Enzyme & Microbial Technology, 2008, 42 (6): 466–472. |
| [20] | Velasco-Lozano S, López-Gallego F, Mateos-Díaz J C, et al. Cross-linked enzyme aggregates (CLEA) in enzyme improvement-a review. Biocatalysis, 2014, 1 (1): 166–177. |
| [21] | Kumar VV, Sivanesan S, Cabana H. Magnetic cross-linked laccase aggregates—Bioremediation tool for decolorization of distinct classes of recalcitrant dyes. Science of the Total Environment, 2014, 487 (1): 830–839. |
| [22] | 刘宇, 郭晨, 王峰, 等. 磁性SiO2纳米粒子的制备及其用于漆酶固定化. 过程工程学报, 2008, 8(3): 583–588. |
| [23] | 姜德生, 龙胜亚, 黄俊, 等. 漆酶在磁性壳聚糖微球上的固定及其酶学性质研究. 微生物学报, 2005, 45(4): 630–633. |
| [24] | Baghayeri M. Glucose sensing by a glassy carbon electrode modified with glucose oxidase and a magnetic polymeric nanocomposite. Rsc Advances, 2015, 5 (24): 18267–18274. DOI:10.1039/C4RA15888A |
| [25] | Lalaoui N, Elouarzaki K, Le GA, et al. Efficient direct oxygen reduction by laccases attached and oriented on pyrene-functionalized polypyrrole/carbon nanotube electrodes. Chemical Communications, 2013, 49 (81): 9281–9283. DOI:10.1039/c3cc44994g |




