2. 华南理工大学食品科学与工程学院,广州 510640
2. College of Food Science and Engineering, South China University of Technology, Guangzhou 510640
尿微量白蛋白(Microalbuminuria,MAU)是指在尿中出现微量白蛋白,其分泌率在30-300 mg/24 h的范围内。正常情况下人血白蛋白很难通过肾小球基底膜,只有极少量的白蛋白可以通过尿液排出体外,当肾小球基底膜病变,蛋白滤过量超过肾小管重吸收,则导致尿白蛋白增高[1]。尿微量白蛋白是诊断糖尿病肾病早期肾损伤的可靠生化指标[2-4]。此外,研究表明MAU也是高血压、孕妇子痫前期及心血管疾病并发症独立的危险因素[5-7]。
目前临床上常用的检测MAU的方法有放射免疫法[8]、酶联免疫吸附法[9]、化学发光法[10]、免疫比浊法[11]和免疫层析法[12]等。放射免疫法利用放射性同位素作为示踪剂,有放射性污染且仪器较贵;酶联免疫吸附法需要多次洗涤和孵育,操作繁琐;化学发光法成本较贵,试剂及仪器皆依赖于进口;免疫比浊法灵敏度高、特异性好,但需要高质量的特种蛋白分析仪;免疫层析法克服以上几种方法的缺点,具有快速、灵敏、特异性强、操作简便、成本较低等优点,是近年免疫检测中最有发展前途的方法[13]
本研究为克服胶体金免疫层析灵敏度相对偏低,且只能用于定性或半定量检测的缺点,拟采用免疫标记技术和免疫层析方法,以荧光纳米微球作为示踪物,制备免疫层析试纸条,以期获得一种操作简单快速、灵敏度高、特异性强、定量准确的检测尿微量白蛋白的新的检测模式。
1 材料与方法 1.1 材料人血白蛋白,西班牙Instituto Grifols公司;鼠抗人白蛋白单克隆抗体,芬兰Medix Biochemica公司;兔IgG及羊抗兔IgG均为本实验室制备[14];荧光微球,美国Bangs lab公司;硝酸纤维素膜,德国Sartorius公司;碳二亚胺(EDC)、N-羟基硫代琥珀酰亚胺(Sulfo NHS),美国Thermo Scientific公司;牛血清白蛋白(BSA)、吐温-20、聚乙二醇-4000、一水吗啉乙磺酸(MES),美国Sigma公司;硼砂、硼酸、氯化钠、磷酸二氢钠、磷酸氢二钠,广州化学试剂厂。其余试剂均为国产分析纯。
ND2000型超微量分光光度计、Legen RT+台式高速冷冻离心机,美国Thermo Scientific公司;Iso Flow型喷膜机,美国Imagene Technplogy公司;HGS201切条机,杭州峰航科技有限公司;超声波细胞粉碎机,宁波新芝生物科技股份有限公司;Milli-Q超纯水机,美国Millipore公司;LEO1530VP场发射扫描电子显微镜,德国Zeiss公司;飞测Ⅱ荧光定量检测仪,广州万孚生物技术股份有限公司。
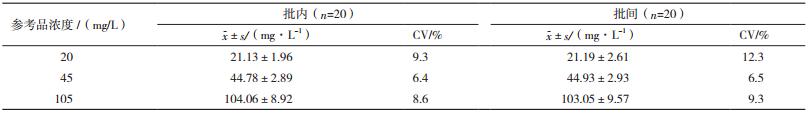
1.2 方法 1.2.1 MAU荧光免疫层析试纸条的制备及优化 1.2.1.1 荧光免疫层析试纸条的制备采用竞争法反应模式,以羧基荧光微球标记的抗人白蛋白单克隆抗体及羊抗兔IgG为标记抗体,用喷膜机喷一定浓度的标记抗体、人血白蛋白和兔IgG于硝酸纤维素(NC)膜上分别作为标记线、检测线(T线)和质控线(C线)。试纸条的组装是在聚氯乙烯(PVC)板上顺次相互搭接样品垫、NC膜和吸水纸,然后用切条机切割成4 mm宽的试纸条,试纸条组成如图 1所示。测试时将75 μL待测尿液样本直接加入加样孔中,反应3 min后用荧光定量检测仪检测。
|
| 图 1 试纸条组成 |
荧光微球的标记过程参照本实验室已建立的方法[14]。研究每毫升1%荧光微球中加入0.2、0.4、0.6、0.8、1.0和1.2 mg的抗体对检测线荧光信号T值的影响,以确定最佳抗体标记浓度。以标记线荧光微球使用浓度30%+3%,T、C线蛋白浓度2.0 mg/mL喷膜,制备试纸条。取浓度为20 mg/L的参考品75 μL进行加样,反应时间3 min,每个浓度重复测试5次。
1.2.2 MAU荧光免疫层析检测试剂的性能评价 1.2.2.1 检测限以零浓度参考品作为标本重复测定20次,计算其荧光信号均值(x)及标准差(SD),将+2SD所得的荧光值代入标准曲线方程计算得出其检测限。
1.2.2.2 精密度抽取两个批次的MAU检测试剂,分别对MAU浓度20、45、105 mg/L的参考品进行检测,每个浓度重复测定20次,计算批内和批间各浓度变异系数(Coefficient of variation,CV)。
1.2.2.3 回收率在已知6个不同浓度的MAU尿液中加入不同浓度的MAU纯抗原,使得尿液中MAU的期望浓度为20 mg/L和100 mg/L,每个浓度重复测试5次,计算回收率,即实测值与理论值的比值。
1.2.2.4 特异性以含MAU的尿液样本(35 mg/L)为对照,向其中分别添加干扰物质丙酮、肌酐、胆红素、抗坏血酸、葡萄糖、对乙酰氨基酚、柠檬酸、尿素、氨苄西林、咖啡因、四环素、胆固醇、血红蛋白(1 mg/mL),人IgA、人IgG、人IgM(50 mg/L),β2-微球蛋白(5 mg/L),促甲状腺激素(TSH,100 mIU/L)、促卵泡激素(FSH,100 mIU/mL)、人绒毛膜促性腺激素(HCG,100 IU/mL),每个浓度重复测试5次,比较不同干扰物质的测试值,以评价试剂的特异性。
1.2.2.5 稳定性将成品试剂盒置于干燥房保存,14个月内每个月分别测试浓度为20、45、105 mg/L的MAU参考品,每个浓度重复测试5次,检测结果相对偏差在±20%以内认为试剂稳定性良好。
1.2.2.6 临床验证用本试剂盒(万孚-MAU)检测244例临床尿液样本,以Orion QuikRead U-ALB试剂检测结果为对照,每个临床样本测试2次取平均值,比较其检测结果的相关性和一致性。
1.2.3 统计学分析采用Origin8.0软件拟合标准曲线方程,R2≥0.998,P < 0.05表明线性良好。各组数据用x±s表示。两种方法临床定量检测结果的相关性采用SPSS18.0进行线性回归分析,相关系数r≥0.95表明相关性良好。采用Bland-Altman图进行临床测试结果的一致性分析,统计95%一致性界限外的百分比。
2 结果 2.1 荧光微球扫描电镜图谱从原荧光微球扫描电镜图(图 2-A)中可以看出,实验所用荧光微球呈均一分散的球形,粒径为500 nm左右。从与抗体蛋白共价偶联后的免疫荧光微球扫描电镜图(图 2-B)图中可以看出,微球-抗体复合物仍粒度均一,没有出现团聚现象。与抗体蛋白共价偶联后在微球的表层可以观察到一层“晕”,这层“晕”即为蛋白质分子层。

|
| 图 2 荧光微球扫描电镜图谱 A:原荧光微球;B:免疫荧光微球 |
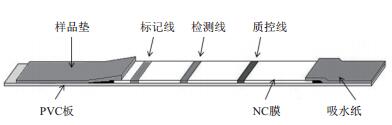
不同标记抗体蛋白浓度下免疫层析荧光信号如图 3所示,在0.2-1.2 mg/mL的范围内,随着蛋白浓度的增加,荧光信号值逐渐增加,高于1.0 mg/mL时,荧光信号值变化平稳,说明抗体标记浓度为1.0 mg/mL时,荧光微球共价偶联蛋白量已达到饱和,因此最佳抗体标记浓度为1.0 mg/mL。
|
| 图 3 荧光信号随标记抗体蛋白浓度的变化 |
MAU荧光免疫层析定量检测试剂的标准曲线如图 4所示,回归方程y=0.00902x+0.27324(决定系数R2=0.99974、P < 0.01),荧光信号C/T值与MAU参考品浓度在5-300 mg/L范围内具有良好的线性关系。将x±SD所得的荧光值代入标准曲线方程计算得出其检测限为2.3 mg/L,试剂分析灵敏度较高。

|
| 图 4 MAU荧光免疫层析检测试剂标准曲线 |
抽取两个批次的MAU检测试剂,分别对MAU浓度20、45、105 mg/L的参考品进行检测,结果如表 1所示,批内和批间变异系数分别为6.4%-9.3%和6.5%-12.3%,批内与批间各检测浓度CV < 15%,试剂精密度较高。
如表 2所示,MAU荧光免疫层析检测试剂在回收率在93.6%-108.3%之间,平均回收率为102.3%,表明添加物与尿液被测物一致,基本没有尿液基质物的干扰。
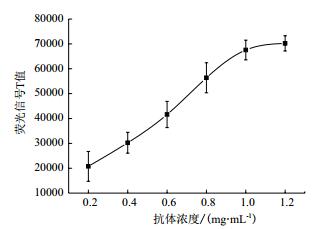
MAU荧光免疫层析检测试剂特异性分析结果如图 5所示,20种干扰物质的测试值与对照品的相对偏差均 < 15%,故这20种干扰物在尿液中对MAU检测无影响,试剂抗干扰能力较强。
|
| 图 5 MAU荧光免疫层析检测试剂特异性 1:对照;2:丙酮;3:肌酐;4:胆红素;5:抗坏血酸;6:葡萄糖;7:对乙酰氨基酚;8:柠檬酸;9:尿素;10:氨苄西林;11:咖啡因;12:四环素;13:胆固醇;14:血红蛋白;15:人IgA;16:人IgG;17:人IGM;18:β2微球蛋白;19:TSH;20:FSH;21:HCG |
稳定性试验结果如表 3所示,14个月内检测浓度为20.0、45.0、105.0 mg/L的MAU参考品,各浓度相对偏差均 < 20%,表明MAU试剂盒较稳定,有效期 > 12月。
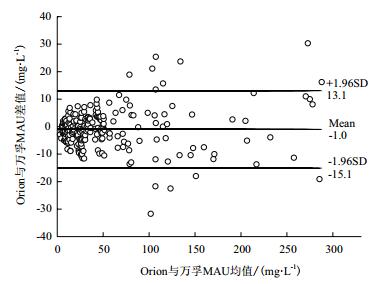
244例临床尿样同时用自制试剂盒与Orion QuikRead U-ALB试剂盒测定的数值进行相关性分析,结果两种方法所测试值有显著相关性(图 6),线性回归方程y=0.9813x+1.9232,Pearson相关性系数r=0.993,P < 0.01。采用Bland-Altman图进行临床测试结果的一致性分析,结果如图 7所示。244例配对数据差值的均数为-1.0 mg/L,95%一致性界限为-15.1-13.1 mg/L,5.32%(13/244)的点在95%一致性界限以外,在一致性界限范围内,Orion试剂与万孚MAU试剂相比,差值的绝对值最大为13.7 mg/L,该样本测试均值为216.9 mg/L,这种相差的幅度在临床上可以接受,因此可以认为两种方法测量的结果具有较好的一致性。

|
| 图 6 万孚-MAU与Orion试剂相关性 |
|
| 图 7 万孚-MAU与Orion试剂相关性Bland-Altman一致性分析 |
白蛋白的分子量为6.9 kD,带负电荷,是肾小球滤过膜所能通过的最小蛋白质分子之一,经肾小球滤过的蛋白质基本全部被近曲小管主动回吸收,因此尿中只有微量白蛋白。当肾小球基底膜病变,蛋白滤过量超过肾小管重吸收,则导致尿白蛋白增高,尿微量白蛋白是指尿中白蛋白含量为30-300 mg/24 h,或随机尿样本中白蛋白浓度为20-200 mg/L。尿微量白蛋白不仅是评估高血压病和糖尿病肾功能损伤的早期敏感指标,而且已被证实是心血管疾病独立的危险因素[15, 16],也是内皮细胞功能受损的标志,能够预报大血管病变[17]。
Omidfar等[18]研制了一种胶体金免疫层析试纸条检测尿液中微量白蛋白,试纸条灵敏度为20 mg/L,测试时间10 min。刘芳等[19]建立一种快速检测尿中微量白蛋白的高效液相色谱法,单个标本检测速度约为6 min,该法在5-2 000 mg/L范围内线性较好,检测限2 mg/L。Qin等[20]采用时间分辨荧光共振能量转移分析法快速、定量检测尿液中微量白蛋白,检测时间12 min,检测范围10-320 mg/L,检测限5.5 mg/L。Choi等[21]建立一种现场即时检验尿微量白蛋白的荧光免疫分析法,定量检测限4.65 mg/L,测试时间10 min。本研究所研制的尿微量白蛋白荧光免疫层析试剂检测范围为5-300 mg/L,检测限2.3 mg/L,检测时间3 min,相比其他方法检测灵敏度高、测试时间短。
即时检验(Point of care testing,POCT)是体外诊断行业的子行业,是近几年体外诊断行业重要的发展方向和增长最快的领域。本研究所建立的MAU荧光免疫层析定量检测方法无需配备大型仪器设备,采用一步法加样,操作简单,灵敏度高,重复性、准确度高,特异性及稳定性较好。不足之处是由于尿液样本个体差异大、分析结果易受化学成分的干扰,这可能造成个别样本测试结果与临床状态不符,后期仍需增大临床样本测试数量,并针对特殊样本进行改进,以增强试剂的抗干扰能力。
4 结论本研究所制备MAU荧光免疫层析检测试剂的线性范围为5-300 mg/L,检测限为2.3 mg/L,线性范围广,分析灵敏度高;批内和批间变异系数(CV)分别为6.4%-9.3%和6.5%-12.3%,平均回收率为102.3%,试剂重复性及准确度高。试剂与尿液中20种干扰物质无交叉反应,特异性较好;实时稳定性试验表明试剂盒有效期 > 12月。临床样本测试,与Orion QuikRead U-ALB试剂相关性较好(r=0.993,P < 0.01),Bland-Altman分析表明两种方法的诊断结果具有较好的一致性。
| [1] | Quinlan GJ, Martin GS, Evans TW. Albumin:biochemical properties and therapeutic potential. Hepatology, 2005, 41 (6): 1211–1219. DOI:10.1002/(ISSN)1527-3350 |
| [2] | Doumas BT, Peters T. Serum and urine albumin:a progress report on their measurement and clinical significance. Clinica Chimica Acta, 1997, 258 (1): 3–20. DOI:10.1016/S0009-8981(96)06446-7 |
| [3] | 陈燕, 赵敏. 尿微量白蛋白的检测对糖尿病早期肾损害诊断中的临床价值. 中华医学杂志, 2003, 26(6): 562–564. |
| [4] | Comper WD, Osicka TM. Detection of urinary albumin. Advance in Chronic Kidney Disease, 2005, 12 (2): 170–176. DOI:10.1053/j.ackd.2005.01.012 |
| [5] | Waugh J, Kilby M, Lambert P, et al. Validation of the DCA 2000 microalbumin:creatinine ratio urinanalyzer for its use in pregnancy and preeclampsia. Hypertensi Pregnancy, 2003, 1 : 77–92. |
| [6] | José SL, Daniel SH, Alejandro DLS, et al. Relationship between urinary albumin excretion and blood pressure in the community pharmacy:the Palmera study. American Journal of Hypertension, 2013, 26 (8): 3–4. |
| [7] | Mongensen CE, Hansen KW, Osterby R, et al. Blood pressure elevation versus abnormal albuminuria in the genesis and prediction of renal disease in diabetes. Diabetes Care, 1992, 15 (9): 1192–1204. DOI:10.2337/diacare.15.9.1192 |
| [8] | Jury DR, Speed JF, Dunn PJ. Urinary albumin radioinununoassay using a solid phase seeond antibody. Clinica Chimica Acta, 1985, 148 (1): 63–67. DOI:10.1016/0009-8981(85)90301-8 |
| [9] | 鲍利民, 齐若梅, 高欣, 等. ELISA法检测尿微量白蛋白的临床应用与评价. 中国卫生检验杂志, 2006, 2: 227–228. |
| [10] | Zhao LX, Lin JM, Li ZJ. Comparison and development of two different solid phase chemiluminescence ELISA for the determination of albumin in urine. Analytica Chimica Acta, 2005, 541 (1-2): 197–205. DOI:10.1016/j.aca.2005.03.027 |
| [11] | Marre M, C1audel JP, Ciret P, et al. Laser immunonephelometry for routine quantification of urinary albumin exeretion. Clinical Chemistry, 1987, 33 (2): 209–213. |
| [12] | 卢仁泉, 宗英, 郑佐娅. 尿微量白蛋白半定量金免疫层析试条的研制和临床评价. 检验医学, 2007, 22(1): 54–57. |
| [13] | Ngom B, Guo Y, Wang X, et al. Development and application of lateral flow test strip technology for detection of infectious agents and chemical contaminants:a review. Analytical and Bioanalytical Chemistry, 2010, 397 (3): 1113–1135. DOI:10.1007/s00216-010-3661-4 |
| [14] | 张赛.荧光免疫层析法结合免疫磁珠分离技术在单增李斯特菌检测中的应用[D].广州:华南理工大学, 2014. |
| [15] | Verdecchia P, Reboldi GP. Hypertension and microalbuminuria:the new detrimental duo. Blood Press, 2004, 4 : 198–211. |
| [16] | Wang TJ, Evans JC, Meigs JB, et al. Low-Grade albuminuria and the risks of hypertension and blood pressure progression. Circulation, 2005, 111 (11): 1370–1376. DOI:10.1161/01.CIR.0000158434.69180.2D |
| [17] | Gschwend S, Pinto-Sietsma SJ, Buikema H, et al. Impaired coronary endothelial function in a rat model of spontaneous albuminuria. Kidney International, 2002, 62 (1): 181–191. DOI:10.1046/j.1523-1755.2002.00431.x |
| [18] | Omidfar K, Kia S, Larijani B. Development of a colloidal gold-based immunochromatographic test strip for screening of microalbuminuria. Hybridoma, 2011, 30 (2): 117–124. DOI:10.1089/hyb.2010.0090 |
| [19] | 刘芳, 向跃芸, 徐克前. 一种快速检测尿中微量白蛋白的高效液相色谱法. 中南大学学报, 2012, 37(10): 1066–1070. |
| [20] | Qin QP, Peltola O, Pettersson K. Time-Resolved fluorescence resonance energy transfer assay for point-of-care testing of urinary albumin. Clinical Chemistry, 2003, 49 (7): 1105–1113. DOI:10.1373/49.7.1105 |
| [21] | Choi S, Choi EY, Kim HS, et al. On-Site quantification of human urinary albumin by a fluorescence immunoassay. Clinical Chemistry, 2004, 50 (6): 1052–1055. DOI:10.1373/clinchem.2004.032813 |