2. 辽宁出入境检验检疫局,大连 116001
2. Liaoning Entry-Exit Inspection and Quarantine Bureau, Dalian 116001
布鲁氏菌病(Brucellosis)简称布病,是由布鲁氏菌侵入机体所引起的一种人畜共患传染病,人患病途径一般为接触已经感染的动物或者食物,已经成为国内乙类法定报告传染病[1, 2]。布鲁氏菌属于革兰氏阴性兼性胞内寄生菌,可以引起动物流产、不孕和人的劳动力丧失[3-5]。近年来,布病在世界范围内呈反弹趋势,全世界每年报道的布病病例超过500万,由于布病给动物产品及公共卫生安全带来的经济损失巨大,因此布病的防治十分严峻[6]。
Notomi等[7]在2000年研发了环介导等温扩增技术(Loop-mediated isothermal amplification,LA-MP),在65℃条件下,15-60 min DNA可以扩增1010倍左右,反应结果可通过反应副产物焦磷酸镁白色沉淀的形成进行肉眼观察,或者通过浊度仪检测焦磷酸镁白色沉淀的混浊度来判定[8-11]。该方法与普通PCR相比,具有高特异性、高灵敏度、操作简单、耗时短、结果易于鉴定等特点,具有更大优势。环介导等温扩增技术已被用于对细菌、病毒、寄生虫的检测和动物胚胎性别鉴定等领域[12-19],在疾病的快速检测方面发展迅速,可对多种疾病进行检测和鉴定,是比较有发展前景的快速诊断手段方法之一。本研究针对布鲁氏菌保守基因16S rDNA设计LAMP引物,对布鲁氏菌进行检测,优化LAMP各反应条件,并对该方法的特异性和灵敏度进行分析比较。
1 材料与方法 1.1 材料羊种布鲁氏菌16M、猪种布鲁氏菌S2、牛种布鲁氏菌2308三种标准布鲁氏菌核酸和小肠耶尔森ATCC9510、大肠杆菌ATCC25922、沙门氏菌ATCC10708、金黄色葡萄球菌ATCC33591、志贺氏菌ATCC29903对照菌株均来自于相关实验室馈赠。DNA扩增试剂盒购自广州迪奥生物科技有限公司;蛋白酶k购自宝生物工程(大连)有限公司。
1.2 方法 1.2.1 引物的设计与合成针对布鲁氏菌保守基因16S rDNA设计LAMP引物,引物序列如表 1所示。
提取细菌基因组具体步骤:吸取细菌培养液200 µL,10 000 r/min离心1 min,弃上清。将沉淀用540 µL TE缓冲液重悬。在重悬液中加入30 µL 10%(W/V)SDS、3 µL 2%(W/V)蛋白酶K。混合后37℃温育1 h。用等体积的酚氯仿对裂解细胞抽提两次,12 000 r/min离心2 min,取上清。加入两倍体积的预冷无水乙醇,12 000 r/min离心1 min。沉淀溶解在100 µL的TE缓冲液中,-20℃冰箱保存。
1.2.3 LAMP反应体系的配制根据LAMP反应试剂盒推荐的25 µL体系进行配制,在超净台上进行。
1.2.3.1 染色法反应体系为12.5 µL的反应液RM(2×),内引物(FIP/BIP)各1.5 µL,外引物(F3/B3)各0.25 µL,环引物(LF/LB)各1 µL,Bst聚合酶1 µL,DNA模板1 µL,加超纯水至25 µL。上述试剂混匀后,加20 µL密封液,混匀离心,将1 µL的显色液滴在PCR管盖中央。将上述反应管放入63℃的恒温金属水浴锅内,反应60 min。反应结束后,颠倒PCR管数次,使反应混合液和显色液充分混匀,观察反应液颜色。根据颜色变化观察结果。
1.2.3.2 实时荧光法反应体系12.5 µL的反应液RM(2×),内引物(FIP/BIP)各1.5 µL,外引物(F3/B3)各0.25 µL,环引物(LF/LB)各1 mL,Bst聚合酶1 µL,荧光染料Ⅰ0.5 µL,DNA模板1 µL,加超纯水至25 µL。上述试剂混匀后,加20 µL密封液,混匀离心。使用LC480,选择FAM通道,反应程序为:63℃15 s;63℃15 s、63℃45 s,共45个循环。
1.2.3.3 实时浊度法反应体系12.5 µL的反应液RM(2×),内引物(FIP/BIP)各1.5 µL,外引物(F3/B3)各0.25 µL,环引物(LF/LB)各1 µL,Bst聚合酶1 µL,DNA模板1 µL,加超纯水至25 µL。上述试剂混匀后,加20 µL密封液,混匀离心。将反应管放入LC-320C浊度仪中,63℃ 60 min。根据浊度图判断结果。
1.2.4 LAMP反应条件的优化(1)反应时间:保持DNA扩增试剂盒(迪奥生物科技有限公司)的推荐温度63℃,以5 min为梯度,改变反应时间分别为:65、60、55和50 min、反应结束后根据扩增情况,确定最佳反应时间。(2)反应温度:选择60、61、62和63℃为不同温度条件,以最佳反应时间进行实验,确定布鲁氏菌的最佳反应温度。再以得到的反应温度验证其反应时间也具有以上实验的相似的趋势。(3)引物浓度:布鲁氏菌的引物分为内、外引物和环引物(表 2),两组均进行优化试验。环引物保持不变,内、外引物同时进行梯度变化,同理,环引物进行梯度变化,从而得到最适宜的引物浓度。
分别以羊种布鲁氏菌16M、猪种布鲁氏菌S2和牛种布鲁氏菌2308、小肠耶尔森ATCC9510、大肠杆菌ATCC25922、沙门氏菌ATCC10708、金黄色葡萄球菌ATCC33591、志贺氏菌ATCC29903的基因组作为模板,进行特异性实验。
1.2.6 灵敏度试验测定牛种布鲁氏菌2308核酸的浓度为43.6 ng/µL,进行10倍梯度稀释,得到的浓度梯度分别为:43.6 ng/µL、4.36 ng/µL、436 pg/µL、43.6 pg/µL、4.36 pg/µL、436 fg/µL、43.6 fg/µL和4.36 fg/µL。分别取1.0 µL作为反应模板,使用浊度仪法、实时荧光法进行LAMP反应,同时与普通PCR方法进行比较分析。
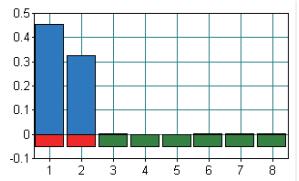
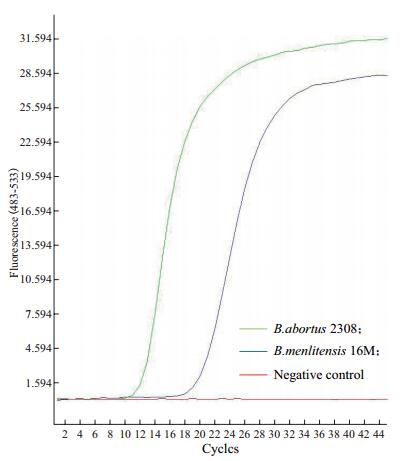
2 结果 2.1 LAMP实验结果分别以羊种布鲁氏菌16M和牛种布鲁氏菌2308作为1号和2号DNA模板,3号以水作为阴性对照。两种模板使用染色法进行鉴定,发生LAMP扩增反应则PCR管发绿色荧光,没有发生扩增反应则为橙红色(图 1)。采用浊度仪方法,结果(图 2)显示浊度达到0.1以上并且最下方为红色则为阳性,如为绿色则为阴性,即没有核酸扩增。图 3为实时荧光法,出现“S”型扩增曲线则判断阳性,若无“S”型曲线为阴性。以下3个结果图中,1号样品和2号样品均具有阳性判定特征,即有核酸扩增,而3号样品则为阴性结果。与理论分析相符,3种方法均可以检测到布鲁氏菌。

|
| 图 1 布鲁氏菌LAMP可视化检测 1 : B.abortus 2308;2 : B.menlitensis 16M;3 :Negative control |
|
| 图 2 布鲁氏菌LAMP浊度仪检测 1 : B.abortus 2308;2 : B.menlitensis 16M;3 :Negative control |
|
| 图 3 布鲁氏菌LAMP实时荧光检测 B.abortus 2308; B.menlitensis 16M;Negative control |
以布鲁氏菌阳性核酸为模板进行LAMP反应,在浊度仪中设定的4个反应时间的LAMP试验结果如图 4所示。图 4-A与图 4-B样品的浊度值最高并且几乎相同,因此可选择60 min为最佳反应时间。

|
| 图 4 时间梯度图 A :65 min; B :60 min; C :55 min; D :50 min |
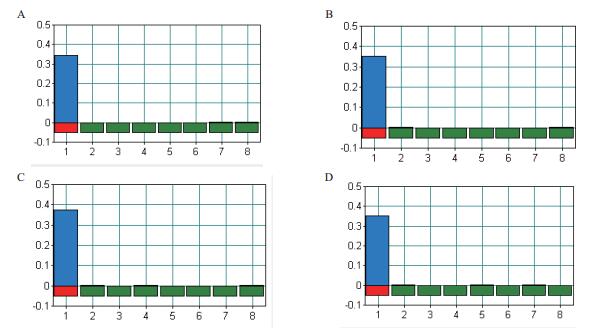
以布鲁氏菌阳性核酸为模板进行LAMP反应,以6 min为最佳反应时间进行反应温度的优化,反应结果如图 5。实验结果(图 5-C)表明,反应温度在62℃时,LAMP反应扩增效率达到最高,浊度值最大。以62℃进行时间梯度实验(图 6),与2.2.1的结果具有相似的趋势,因此62℃可确定为为LAMP反应最适温度。
|
| 图 5 温度梯度图 A :60℃; B :61℃; C :62℃; D :63℃ |

|
| 图 6 时间梯度图 A :65 min; B :60 min; C :55 min; D :50 min |
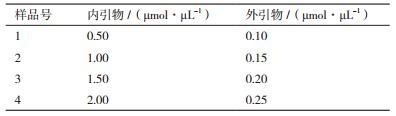
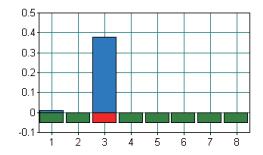
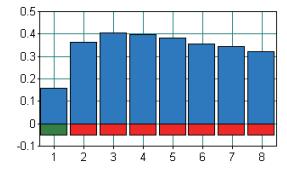
以布鲁氏菌阳性核酸为模板进行LAMP反应,结果如图 7所示,只有3号样品得到了阳性结果,也就是说当体系中内引物为1.5 µmol/µL、外引物0.20 µmol/µL时,才能够检测出布鲁氏菌。而作为不影响阴、阳性结果,仅仅增加反应效率的环引物则与样品浊度表现出线性关系,如图 8所示,会随着环引物的浓度增加样品的浊度也随之增加。因此,环引物的合适浓度则为1 µmol/µL。
|
| 图 7 内、外引物浓度优化结果图 1:内、外引物0.50 μmol/μL、0.10 μmol/μL;2:内、外引物1.00 μmol/μL、0.15 μmol/μL;3:内、外引物1.50 μmol/μL、0.20 μmol/μL;4:内、外引物2.00 μmol/μL、0.25 μmol/μL |
|
| 图 8 环引物浓度 |
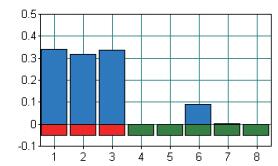
对3株阳性布鲁氏菌和5株对照菌的核酸进行LAMP扩增反应,结果如图 9所示,3株布鲁氏菌反应结果均有扩增,为阳性结果,5株阴性对照菌均为阴性结果。结果表明,本研究建立的LAMP检测方法具有较好的特异性。
|
| 图 9 布鲁氏菌LAMP特异性浊度法检测 1 : B.abortus 2308;2 : B.menlitensis 16M;3 :B.suis S2;4 : Yersinia enterocolitica ATCC9510;5 : E.coil ATCC25922;6 : Salmonella ATCC10708;7 : Staphylococcus aureus ACTT33591;8 : Shigella ATCC29903 |
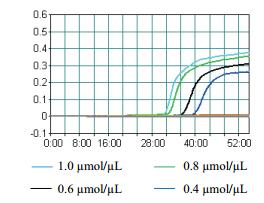
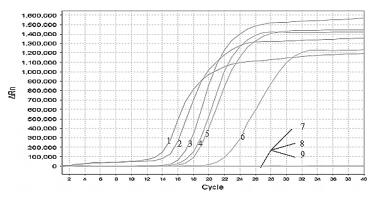
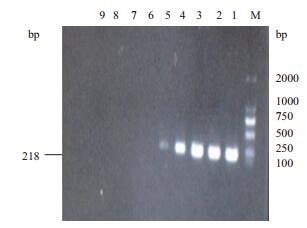
将10倍梯度稀释的牛种布鲁氏菌2308的核酸进行LAMP扩增,图 10为浊度仪中62℃恒温60 min的反应结果,浊度仪的检测低限为4.36 fg/µL,并且最后一个样品的浊度远大于0.1。实时荧光法进行的灵敏度实验结果(图 11)显示,最低检测的样品浓度约为436 fg/µL。普通PCR灵敏度的检测到的最小值为4.36 pg/µL(图 12)。结果表明浊度仪和荧光定量的灵敏度均高于普通PCR。与普通PCR相比,灵敏度大幅提高,具有明显的优势。
|
| 图 10 布鲁氏菌LAMP灵敏度浊度法检测 1:43.6 ng/μL;2:4.36 ng/μL;3:436 pg/μL;4:43.6 pg/μL;5:4.36 pg/μL;6:436 fg/μL;7:43.6 fg/μL;8:4.36 fg/μL |
|
| 图 11 布鲁氏菌LAMP灵敏度实时荧光检测 1:43.6 ng/μL;2:4.36 ng/μL;3:436 pg/μL;4:43.6 pg/μL;5:4.36 pg/μL;6:436 fg/μL;7:43.6 fg/μL;8:4.36 fg/μL |
|
| 图 12 布鲁氏菌LAMP灵敏度电泳检测 M :DL 2000 Marker; 1 :43.6 ng/μL; 2 :4.36 ng/μL; 3 :436 pg/μL; 4 :43.6 pg/μL; 5 :4.36 pg/μL; 6 :436 fg/μL; 7 :43.6 fg/μL; 8 :4.36 fg/μL; 9 : Negative control |
近年来,检测LAMP反应的方法有目视检查浑浊、染色法、实时浊度法和实时荧光法[20-23]。目视检查浑浊是通过LAMP反应产生大量的副产物焦磷酸镁白色沉淀进行判断,但是沉淀量较低时很难直接观察结果。染色法则能显著提高肉眼的识别率,可直接进行阴、阳性结果的判断。实时浊度法和实时荧光法则能够更加直观、精确地判定结果,但是两种方法都需要特定的仪器设备,成本较高。
本研究中对浊度法进行了反应条件优化,在50-60 min的反应时间内,时间对反应的结果影响并不是很大。在进行的特异性实验时,3株布鲁氏菌都显示有核酸扩增,而其他5株阴性对照菌无核酸扩增,判定为阴性,结果表明引物具有较高的特异性。LAMP是一种高灵敏度检测方法,其灵敏度通常比普通PCR约高100倍。通过浊度法、实时荧光和普通PCR 3种方法进行灵敏度分析,分别得到的检测极限为4.36 fg/µL、436 fg/µL和4.36 pg/µL,结果比较后可以得出LAMP检测技术的灵敏度要高于普通PCR,优势明显。图 9中最高浓度的样品在浊度仪实验中反而出现了阴性结果,是否因为样品浓度过高而影响了浊度仪对阴阳性的判断,还需要大量实验进行验证。
4 结论针对布鲁氏菌保守基因16S rDNA设计引物并建立环介导等温扩增技术(LAMP)。通过3种方法对布鲁氏菌进行检测,结果表现出特异性强、速度快且设备要求简单等特点,但对于灵敏度而言,浊度仪法相对具有优势。
| [1] | 许邹亮, 南文龙, 周洁, 等. 布鲁氏菌环节导等温扩增 (LAMP) 可视化检测方法的建立. 中国动物检, 2011, 28(8): 37–40. |
| [2] | Guo Z, Fu Y Z, Ji Z, et al. Loop-mediated isothermal amplification assay targeting the omp25 gene for rapid detection of Brucellaspp. Molecular and Cellular Probes, 2011, 25 : 126–129. DOI:10.1016/j.mcp.2011.01.001 |
| [3] | Huynh TH, Lauren TA, Hannah LS, et al. An evaluation of ELISA using recombinant Brucella abortus bacterioferritin (Bfr) for bovine brucellosis. Microbiology and Infectious Diseases, 2016, 45 : 16–19. |
| [4] | 高彦辉, 赵丽军, 孙殿军, 等. 布鲁氏菌病防治基础研究现状与展望. 中国科学, 2014, 44(6): 628–635. |
| [5] | Li J, Li Y R, Wang Y, et al. Renal abscess caused by Brucella. International Journal of Infectious Diseases, 2014, 28 : 26–28. DOI:10.1016/j.ijid.2014.07.019 |
| [6] | 毛景东, 王景龙, 杨艳玲. 布鲁氏菌病的研究进展. 中国畜牧兽医, 2011, 38(1): 222–226. |
| [7] | Notomi T, Okayma H, Masubuchi H, et al. Loop-mediated isothermal amplificationof DNA. Nuuceic Acids Res, 2000, 28 (12): 63–69. DOI:10.1093/nar/28.12.e63 |
| [8] | 马国瑞, 李志强, 张辉, 等. 基于布鲁氏菌omp25基因的环介导等温技术建立及初步应用. 石河子学报, 2014, 32(6): 683–686. |
| [9] | Pérez-Sancho M, García-Seco T, Arrogante L. Development and evaluation of an IS711-based loop mediated isothermal amplification method (LAMP) for detection of Brucella spp. on clinical samples. Research in Veterinary Science, 2013, 95 : 489–494. DOI:10.1016/j.rvsc.2013.05.002 |
| [10] | Song L Y, Li JT, Hou SP, et al. Establishment of loop-mediated isothermal amplification (LAMP) for rapid detection of Brucellaspp. and application to milk and blood samples. Journal of Microbiological Methods, 2012, 90 : 292–297. DOI:10.1016/j.mimet.2012.05.024 |
| [11] | 马艳萍, 刘振兴, 郝乐, 等. 环介导等温扩增技术的研究进展. 河北科技师范学院学报, 2011, 25(1): 76–80. |
| [12] | Watthanapanituck K, Kiatpathomchai W, Chu E, et al. Identification of human DNA in forensic evidence byloop-mediated isothermal amplification combined with a colorimetric gold nanoparticle hybridization probe. Int J Legal Med, 2014, 128 : 923–931. DOI:10.1007/s00414-014-1018-9 |
| [13] | Kokkinos PA, Zios PG, Bellou M, et al. Loop-mediated isothermal amplification (LAMP) for the detection of Salmonella in food. Food Anal Methods, 2014, 7 : 512–526. DOI:10.1007/s12161-013-9748-8 |
| [14] | 刘威, 李环, 邹大阳. 用环介导等温扩增技术快速检测粪便样本中的沙门菌. 生物技术通讯, 2014, 24(2): 237–241. |
| [15] | 关丽, 聂凯, 张丹. 环介导逆转录等温扩增技术检测中东呼吸综合症冠状病毒基因. 病毒学报, 2014, 31: 269–275. |
| [16] | 戴婷婷, 陆辰晨, 沈浩, 等. 基于环介导等温扩增技术检测橡树疫霉菌. 南京农业大学学报, 2013, 36(3): 23–28. |
| [17] | 陈伯祥, 杨明, 常亮. 环介导等温扩增技术在动物传染病诊断中的应用进展. 动物医学进展, 2012, 33(4): 90–96. |
| [18] | 李结, 王培园, 张萍. 环介导等温扩增技术及其在动物疫病检测中的应用. 中国畜牧兽医, 2012, 39(3): 71–74. |
| [19] | Karthik K, Rathore R, Thomas P, et al. Rapid and visual loop mediated isothermal amplifi cation (LAMP) test for the detection of Brucellaspp. and its applicability inepidemiology of bovine brucellosis. Veterinarski Arhiv, 2016, 86 (1): 35–47. |
| [20] | Ren H, Yang MJ, Zhang JX. Development of a rapid recombinase polymerase amplification assay for detection of Brucellain blood samples. Molecular and Cellular Probes, 2016, 30 : 122–124. DOI:10.1016/j.mcp.2016.02.007 |
| [21] | 高正琴, 邢进, 冯育芳. TaqMan MGB探针实时荧光定量PCR快速检测布鲁氏菌. 中国人兽共患病学报, 2011, 27(11): 995–1000. |
| [22] | Bounaadja L, Albert D, et al. Real-time PCR for identification of Brucellaspp. A comparative study of IS711, bcsp31 and per target genes. Veterinary Microbiology, 2009, 137 : 156–164. DOI:10.1016/j.vetmic.2008.12.023 |
| [23] | Biright H, Holgerc S, Nidia L. Development of PCR assay for typingand subtyping of Brucellaspecies. International Journal of Medical Microbiology, 2009, 299 : 563–573. DOI:10.1016/j.ijmm.2009.05.002 |