2. 宜宾学院生命科学与食品工程学院,宜宾 644000
2. College of Life Science and Food Engineering, Yibin University, Yibin 644000
油樟[Cinnamomum longepaniculatum(Gamble)N. Chao]属樟科、樟属,是国家Ⅱ级重点保护植物(国务院1999年8月4日批准)和我国特有且盛产天然芳香油的主要树种之一,在林业生产上占有重要地位。因其根、枝、叶、木材均可提取樟油而扬名天下,油樟叶中提取的芳香油主要成分为萜类物质,其中已报道有重要经济价值的1,8-桉叶油素、α-松油烯、α-松油醇等成分是国防、轻工,香料、医药、食品工业及军工等烩烯及冰片方面的稀有原料[1-3]。随着社会经济和人们生活水平地不断提高,对于油樟这种天然香料油的需求倍增,供需矛盾十分突出[4]。再加上植物中次生代谢产物含量不稳定以及环境制约等因素的影响,油樟油的产量与品质得不到保证。鉴于此,如何利用新的技术和手段大幅提高油樟油的产量,更有效、低成本和可持续获得油樟油,己成为油樟资源及植物芳香油研究的重要内容和新的发展方向。目前对于油樟研究相对深入的是光照、温度、湿度等外环境生物因素,而忽视了微生物等内环境因素的作用,特别是内生真菌的作用,且研究主要集中在内生真菌的生物多样性[5-8]、次生代谢产物及生物活性多样性[9-11]和内生真菌与宿主之间的相互关系[12-14]等方面,而对于内生真菌影响植物次生代谢产物合成与积累及其作用机制的研究不够深入。本研究以油樟的内生真菌为研究对象,通过研究内生真菌对油樟挥发油(1,8-桉叶油素、α-松油醇)积累的影响,揭示出内生真菌影响油樟油产量和品质的机制,并为后续相关调控基因的克隆和油樟次生代谢物质合成的人工调控提供参考依据。
1 材料与方法 1.1 材料所有供试油樟种子均来源于宜宾红岩山油樟基地,并由宜宾学院魏琴教授鉴定;油樟幼苗由种子萌发而来,并参照姚祥等[15]的方法对种子进行不带菌处理;4株内生真菌2J1(Penicillium commune)、3J1(Neurospora crassa)、5J2(Aspergillus fumigatus)和YB(Penicillium paneum)前期从油樟植株中分离并进行鉴定,采用PDA培养基培养保存。
仪器与设备:GC-MS(7890A-5975c,Agilent),高压蒸汽灭菌锅(MLS-3780,日本),双光束紫外可见分光光度计(TU-901,北京普析通用仪器有限公司),高速冷冻离心机(Sorvall LYNX 6000,Thermos),超净工作台(SW-CJ-2FD,苏州净化设备有限公司)。
1.2 方法 1.2.1 内生真菌的分离与纯化采集新鲜油樟植株外植体(茎、叶),用自来水反复冲洗后,切割成小段,然后进行表面消毒:0.1%升汞消毒5-8 min,无菌水冲洗3次后,再用75%乙醇消毒20 s,无菌水冲洗3次后,将消毒后的外植体剪切成0.3-0.5 cm小片,接种于PDA平板上,28℃培养8-10d,待样品边缘有菌丝长出,切取组织块边缘菌丝进行继续培养,不断转接分离,直至纯化。
1.2.2 内生真菌对油樟挥发油积累的影响将纯化后的内生真菌接种至PDA培养基平面,置28℃培养箱培养7 d后,用灭菌水将分生孢子洗下,配制成孢子浓度为2.0×105个/mL的分生孢子悬浮液,用于接种处理。选择生长健壮均一,苗龄为3个月的油樟幼苗栽植于无菌土壤的花盆中(15 cm×12 cm),适应性培养7 d后,将上述配制的分生孢子悬浮液均匀喷洒在油樟叶片上,同时以无菌水喷洒接种为对照,每处理设6次重复,测定挥发油含量和生理生化指标。
1.2.3 挥发油含量的测定精确称取一定量的油樟叶片,加4倍量(1:4)的环己烷过夜冷浸,之后超声15 min,5 000 r/min离心4 min后取上清液,并定容到一定体积。色谱条件:HP-5MS色谱柱,30 m×0.250 mm;柱温60℃;进样体积1 μL;程序升温:从60℃开始以10℃/min上升至190℃并保持2 min,之后以5℃/min上升至210℃保持2 min,再以10℃/min上升至220℃保持8 min。同时,分别称取适量的1,8-桉叶油素和α-松油醇对照品,用环己烷定容至5 mg/mL的溶液,再用环己烷稀释后注入GC-MS测定,即得标准曲线(1,8-桉叶油素:y=73 900x-29 920,R2=0.999 3;α-松油醇:y=51 620x+16 220,R2=0.999 2)。
1.2.4 油樟叶片粗酶液的制备取0.50 g新鲜叶片,加入0.01 g PVP,5 mL 0.1 mol/L磷酸盐缓冲液(pH7.8,含有0.2 mmol/L EDTA,β-疏基乙醇0.4 mmol/L)冰浴研磨,低温(4℃),12 000 r/min离心10 min后,所得上清液为待测液。
1.2.5 过氧化氢酶(CAT)活性的测定取100 μL待测液中加入到3 mL含有0.1%的H2O2 100 mmol/L,pH7.0的磷酸盐缓冲液中,于240 nm处每隔30 s测其吸光度,以△A/min/g表示酶活性大小。1.2.6过氧化物酶(POD)活性的测定在50 mL,100 mmol/L,pH7.0的磷酸盐缓冲液中加入28 μL愈创木酚,溶解冷却后加入19 μL 30%的H2O2即为POD反应液。测定时取100 μL待测液与2 mL POD反应液和1 mL 0.2 mol/L的磷酸二氢钾溶液反应,于470 nm处每隔30 s测其吸光度,以△A/min/g表示酶活性大小。
1.2.7 丙二醛(MDA)含量的测定取待测液1.0 mL,加入5.0 mL 20%TCA(含0.5% TBA)混匀后塞上塞子,水浴煮沸30 min,快速冷却,4 000 r/ min离心10 min,以20%TCA为参照,上清液在532 nm和600 nm处测定吸光值,重复3次求平均值,MDA含量用△A(△A=A532-A600)表示。
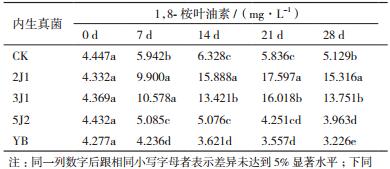
2 结果 2.1 内生真菌对油樟挥发油积累的影响内生真菌侵入宿主植物后,在某些条件下能促进宿主体内次生代谢产物的形成和累积。本研究通过前期分离得到的4株内生真菌(2J1、3J1、5J2、YB),对油樟幼苗进行处理,并分别在0、7、14、21、28 d考察对油樟挥发油(1,8-桉叶油素、α-松油醇)积累的影响。
由表 1和表 2可见,用不同内生真菌处理油樟幼苗,其1,8-桉叶油素和α-松油醇的积累存在明显差异。在0 d时,各个油樟处理之间挥发油含量没有明显差异。随着处理时间增加,除处理YB外,其他处理的挥发油积累量都相应增加,尤其以2J1和3J1增加幅度最大。如在处理后7 d,2J1与3J1的桉叶油素含量明显高于其他处理组,它们分别较对照增加67.61%和78.02%;到14 d、21 d和28 d时,2J1与3J1的挥发油含量继续增加,显著高于其他处理,其中尤以2J1的含量最高,其与对照相比,桉叶油素分别提高151.07%、201.53%和195.11%,松油醇分别提高224.38%、364.14%和359.91%。说明添加内生真菌2J1和3J1进行处理,能促进挥发油的合成和积累,提高挥发油的产量,且用2J1处理比用3J1处理有更大的积累量。因此,通过内生真菌影响油樟挥发油产量上的差异,可寻找出优势菌种,提高油樟油产量。
由图 1和图 2可知,油樟幼苗在添加内生真菌进行培养后,CK、2J1、3J1和5J2的两种挥发油成分的含量逐渐增长。在第7天时只有2J1、3J2以及CK较刚添加内生真菌时有显著增加,其桉叶油素含量分别达到9.900、10.578和5.942 mg/L,松油醇含量分别达到4.294、4.958和2.499 mg/L;而5J2则增长不显著,YB有所下降。到21 d时,2J1和3J1的两种挥发油成分含量达到最大值,尤其是2J1较之3J1的含量更大,之后缓慢下降;而CK和5J2在7 d时达到最大含量,YB则从0 d时就呈现下降趋势。表明由2J1和3J1处理过的油樟幼苗,其挥发油含量增长时间较长,达到21 d,且在整个培养周期内,其挥发油含量都显著高于其它菌种;而CK与5J2在7 d后挥发油含量逐渐下降,且增长的量较0 d时无显著差异。

|
| 图 1 内生真菌作用下油樟1,8-桉叶油素含量的变化 |

|
| 图 2 内生真菌作用下油樟α-松油醇含量的变化 |
综上所述,说明添加2J1和3J1对油樟进行处理,可以促进油樟挥发油含量显著增加,添加YB则可能对油樟挥发油积累有抑制作用,而添加5J2没有明显促进挥发油的增加。因此,通过内生真菌影响油樟挥发油增长的时间差异,可以找到最佳取油时间,从而获得更多的油料。
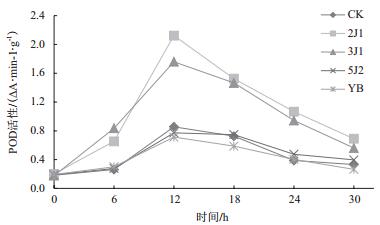
2.3 内生真菌对油樟生理生化特性的影响 2.3.1 内生真菌对油樟自由基清除系统保护酶的影响油樟经过内生真菌处理后,过氧化物酶(POD)(图 3)和过氧化氢酶(CAT)(图 4)的活性发生了相应变化。POD活性在处理后的12 h达到最高值,其中2J1和3J1的活性显著高于对照,分别为对照的2.48和2.06倍,而5J2和YB的POD活性则略低于对照;在处理后的18 h,2J1和3J1的CAT活性达到最大值并显著高于对照,5J2和YB的活性虽达到峰值,但与对照相比差异不显著。2J1和3J1在一段时间内维持了相对较高的POD活性,而CAT活性在0-6 h基本与对照保持一致,随后大幅增加,并一直显著高于对照,从而消除了过量积累的H2O2对植株产生的毒害作用;5J2与YB对油樟POD和CAT活性的影响不大。以上说明,经2J1和3J1两种内生真菌处理后能引起油樟植株活性氧的增加,并促进具有防御能力的酶活性的增加。由于自由基清除系统中氧化还原酶活性的动态变化,可能改变油樟植株中细胞的氧化还原态势,并刺激其生理状态和代谢结构发生变化。
|
| 图 3 内生真菌对油樟POD活性的影响 |

|
| 图 4 内生真菌对油樟CAT活性的影响 |
丙二醛(MDA)含量可以反映植物遭受逆境伤害的程度。从图 5可以看出,油樟在添加内生真菌后,各个处理叶片的MDA含量都有上升,其中2J1和3J1从一开始就呈上升趋势,3J1在12 h后开始下降,2J1在18 h后出现下降,它们在整个培养周期的MDA含量都显著高于对照;CK、5J2和YB的MDA含量变化基本一致,出现先下降再上升,而后再下降的趋势。说明在油樟中加入2J1和3J1两种内生真菌进行培养能够引起MDA含量的上升,并促使植株膜脂过氧化程度上升。

|
| 图 5 内生真菌对油樟MDA含量的影响 |
近年来,研究者从多种植物中分离得到了能产生与宿主相同物质或成分的内生真菌[16, 17]。这些内生真菌能促进植物中有效物质或成分的合成和积累,参与到植物这些物质的形成过程中,并与宿主植物有相似的代谢途径,从而形成相同或相似的代谢产物[18, 19]。本研究表明,不同内生真菌对油樟挥发油积累的影响是有差异的,用2J1和3J1两种内生真菌对油樟进行处理,能促进挥发油的合成和积累,大幅提高挥发油的产量,且2J1较之3J1有更大的积累量;YB处理的油樟挥发油含量从一开始呈现下降趋势,5J2则在7 d后逐渐下降,两者在整个培养周期的挥发油含量都低于CK,可能对油樟挥发油的积累具有抑制或无明显促进作用,其具体原因还有待进一步研究。综上所述,本研究的内生真菌促进油樟挥发油积累能力大小依次为:2J1﹥3J1﹥5J2﹥YB,因此根据内生真菌挥发油产量上的差异,可寻找出优势菌种,从而利用其培育出高油量的油樟品种。
另外,内生真菌处理不仅可以提高植物次生代谢产物的含量,而且还能使植物某些酶的活性发生变化。一般来说,特征酶诱导活性和次生代谢产物积累具有直接相关性[20, 21]。本研究表明,2J1和3J1两种内生真菌能显著促进油樟挥发油的合成,同时能引起POD和CAT活性以及MOD含量大幅上升,说明油樟酶活性的变化在一定程度上与挥发油合成存在正相关。这可能是由于添加内生真菌后使得某些特定的次生代谢途径被启动,路径中有一些相关酶的表达被加强,进而引起挥发油含量的增加。
本研究虽然找出了能提高油樟挥发油含量的内生真菌以及最大含油量的时间,但是它们的相关机制还不清楚,特别是如何促进代谢通路中某些关键酶活性的提高,以及内生真菌在分离出来培养一段时间后合成挥发油能力开始“退化”,这种“退化”现象与宿主之间关系如何都需进一步研究。因此,今后将继续探讨内生真菌对油樟油产量与品质影响的作用机制,并为相关调控基因的克隆和油樟挥发油合成的人工调控提供参考依据。
4 结论本研究以4株内生真菌作为材料,将内生真菌孢子悬浮液均匀喷洒在油樟叶片上进行处理后,提取油樟叶片中的挥发油,利用GC-MS测定挥发油中1,8-桉叶油素、α-松油醇的量,结果表明,采用2J1和3J1两种内生真菌对油樟进行处理,在处理21 d时挥发油含量达到最大值,其主要成分1,8-桉叶油素和α-松油醇的含量显著高于对照。同时,两种内生真菌能引起POD、CAT活性及MOD含量大幅上升,证明油樟酶活性的变化在一定程度上与挥发油合成存在正相关。
| [1] | 陶光复, 丁靖垲, 孙汉董. 湖北油樟叶精油的化学成分. 武汉植物学研究, 2002, 20(2): 75–77. |
| [2] | 王坚, 罗永明, 刘贤旺. 樟科樟属植物的化学成分与组织培养研究. 江西中医学院学报, 2004, 16(2): 69–70. |
| [3] | Xu S, Yin ZQ, Wei Q, et al. Anti-hepatoma effect of safrole from Cinnamomum longepaniculatum leaf essential oil in vitro. Int J Clin Exp Pathol, 2014, 7 : 2265–2272. |
| [4] | 王涛, 魏淑芳, 魏琴. 油樟叶内生真菌的多样性研究. 云南大学学报:自然科学版, 2007, 29(3): 300–302. |
| [5] | Hyde K, Frohlich J, Taylor J. Diversity of ascomycetes on palms in the tropics[M]. Hong Kong University Press, 1997: 141-156. |
| [6] | Zhuang T, Cheng L. Soil microbial function of Kandelia candel mangrove:degradation of diesel oil[A]. Hongkong university Press, 1998:389-395. |
| [7] | 林燕青, 洪伟. 植物内生真菌研究及应用前景. 福建林业科技, 2012, 39(3): 186–193. |
| [8] | Spiering MJ, Lane GA, Christensen MJ, et al. Distribution of the fungal endophyte Neotyphodium lolii is not a major determinant of the distribution of fungal alkaloids in Lolium perenne plants. Phytochemistry, 2005, 66 (2): 195–202. DOI:10.1016/j.phytochem.2004.11.021 |
| [9] | Chandra S. Endophytic fungi:novel sources of anticancer lead molecules. Applied Microbiology and Biotechnology, 2012, 95 (1): 47–59. DOI:10.1007/s00253-012-4128-7 |
| [10] | Hussain H, Krohn K. Bioactive chemical constituents of two endophytic fungi. Biochem Systemat Ecol, 2007, 35 : 898–900. DOI:10.1016/j.bse.2007.04.011 |
| [11] | Phongpaichitl S, Nikom J. Biological activities of extracts from endophytic fungi isolated from Garcinia plants. FEMS Immunol Med Microbiol, 2007, 51 : 517–525. DOI:10.1111/j.1574-695X.2007.00331.x |
| [12] | Kuklinsky-Sobral J, Araújo WL, Mendes R, et al. Isolation and characterization of soybean-associated bacteria and their potential for plant growth promotion. Environmental Microbiology, 2004, 6 (12): 1244–1251. DOI:10.1111/emi.2004.6.issue-12 |
| [13] | Kuldau G, Bacon C. Clavicipitaceous endophytes:their ability to enhance resistance of grasses to multiple stresses. Biological Control, 2008, 46 : 57–71. |
| [14] | Kusari S, Hertweck C, Spiteller M. Chemical ecology of endophytic fungi:origins of secondary metabolites. Chemistry and Biology, 2012, 19 (7): 792–798. DOI:10.1016/j.chembiol.2012.06.004 |
| [15] | 姚祥, 李秀璋, 朱小晓, 等. 两种杀菌剂对中华羊茅种传内生真菌的影响. 草业学报, 2013, 30(10): 1517–1522. |
| [16] | Aly A H, Debbab A, Proksch P. Fungal endophytes-secret producers of bioactive plant metabolites. Pharmazie, 2013, 68 (7): 499–505. |
| [17] | Photital W, Hyde KD. Endophytic fungi of wild banana (Musa acuminata) at DoiSuthep Pui National Park, Thailand. Mycological Research, 2001, 105 (12): 1508–1513. DOI:10.1017/S0953756201004968 |
| [18] | 杜素娟, 郭晓恒. 植物内生真菌对植物次生代谢产物的影响. 现代农业科学, 2009, 16(5): 17–19. |
| [19] | 刘吉华, 余伯阳. 喜树内生真菌的分离及其抗肿瘤活性代谢产物的筛选方法. 植物资源与环境学报, 2004, 13(4): 6–10. |
| [20] | 赵鸿莲, 于荣敏. 诱导子在植物细胞培养中的应用研究进展. 沈阳药科大学学报, 2000, 17(2): 152–155. |
| [21] | 陶金华, 濮雪莲, 江曙. 内生真菌诱导子对茅苍术细胞生长及苍术素积累的影响. 中国中药杂志, 2011, 36(1): 27–31. |