拟盘多毛孢属(Pestalotipsis)真菌在自然界广泛存在,生活习性多样,包括致病、腐生、内生、重寄生等[1, 2]。既是重要的植物病原菌,又是一类具有经济价值的无性型真菌[3, 4]。近年来发现该属真菌具有高效产生次生代谢产物的能力,因此受到广泛关注[5]。重寄生拟盘多毛孢因其特殊生境,可产生区别于内生或病原拟盘多毛孢的次生代谢产物,前期从茶麃生柱锈菌的重寄生拟盘多毛孢中分离得到多个结构新颖的ambuic acid衍生物和聚酮类化合物,具有较好的抗肿瘤活性和抗细菌活性[6, 7]与内生拟盘多毛孢的代谢产物有明显差异[8]。因此,从拟盘多毛孢中提取和筛选新的生物活性物质尚有很大的潜力,而重寄生拟盘多毛孢资源的收集是其利用的基础。
石楠锈孢锈菌(Aecidium pourthiaea)是石楠(Photinia prionophylla)锈病的病原菌,主要危害3年生以下的石楠幼树及幼苗[9]。目前还未见石楠锈孢锈菌重寄生拟盘多毛孢代谢产物的报道。本研究对石楠锈孢锈菌的重寄生拟盘多毛孢进行分离鉴定和抑菌活性筛选,旨为石楠锈病的生物防治及次生代谢产物的研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 植物材料及处理石楠锈孢锈病的病叶于2013年11月采集自西南林业大学苗圃。从病叶中,选取锈子器已枯死或表面已被其他真菌覆盖的叶片若干,放入洁净的培养皿中保湿约1-2 d。然后进行表面消毒:于75%酒精中漂洗10-15 s,然后用无菌水冲洗3-4次,再用0.1%升汞消毒30 s,用无菌水冲洗3-4次。
1.1.2 常见的10种植物病原真菌辣椒炭疽病菌(Sclerotinia sclerotiorum)、水稻稻瘟病菌(Magnapor-the grisea)、小麦雪腐病菌(Typhula incarnate)、黄瓜枯萎病菌(Fusarium oxysporium sp. Cucumebrium)、白菜黑斑病菌(Alternaria brassicae)、辣椒镰刀病菌(Fusarium solani)、三七丝核病菌(Verticillium cinnabarium)、番茄灰霉病菌(Botrytis cinerea)、梨黑星病菌(Venturia pyrina)、棉花枯萎病菌(Fusar-ium oxysporium sp. Vasinfectum)。
1.2 方法 1.2.1 菌株的分离纯化将经表面消毒的材料上的锈病病斑连同周围组织用无菌手术刀切下,切成大小约0.5×0.5 cm的小块,用无菌镊子将各小块置入含有50 mg/L链霉素的PDA培养基平板上,每个平板放置3-4小块,于25℃下培养。
培养3 d后,注意观察,及时挑取小块边缘长出的菌丝体少许,转接到新的PDA平板上,经2-3次纯化获得纯菌落,并从纯菌落上切取小块,转接到试管中的PDA斜面上,保存,备用。
1.2.2 回接验证将患有锈病且无其他杂菌污染的石楠叶片放入洁净的培养皿中,2-3片叶片/皿。每皿分别放入纯化所得的真菌的菌丝体(不含培养基),置于叶片的锈子器上,设置空白对照组。在室温下,保湿培养7-10 d,观察接上的菌丝是否萌发生长并将锈子器覆盖。拨开菌丝后,挑取锈孢子在显微镜下镜检,观察锈孢子的形态及颜色,并拍照。
将上述叶片锈孢子堆上的菌丝再转接到新的PDA培养基平板上培养,待菌落长成后,观察其形态特征,并与原始菌落的形态比较,再镜检新产孢子的形态特征与原菌株的孢子比较,以确认覆盖锈孢子的菌株就是原分离纯化的菌株。
1.2.3 菌株的鉴定 1.2.3.1 形态学描述将分离纯化的菌株分别接种在PDA、改良Fries和理查培养基上进行培养直至产孢,进行培养性状和显微特征的观察、描述。
1.2.3.2 分子鉴定采用SK8259(真菌)试剂盒进行DNA的提取,按照试剂盒的说明进行操作。用通用引物ITS4和ITS5扩增ITS序列:ITS4(5' -TCC TCC GCT TAT TGA TAT-3' ),ITS5(5' -GGA AGT AAA AGT CGT AAC AAG-3' )。PCR产物经切胶回收所需DNA目的条带,纯化方式见说明书(SK8131)。
回收产物送上海生物工程有限公司进行序列测定,测序结果经Bioedit等软件分析和手工校正后,用BLAST软件在GenBank(http://www.ncbi.nlm.nih.gov/BLAST)中进行同源性比较分析,初步确定它们与已知基因的同源关系。
1.2.4 抑菌活性采用滤纸片法[10]测定3株菌粗提物的抑菌活性。
2 结果 2.1 菌株的分离纯化从患锈病的石楠叶片上分离得到分离纯化出3株疑似拟盘多毛孢真菌,编号分别为PG52、PG53、PG90。
2.2 三株真菌处理锈孢子的结果3株真菌的菌丝体接在石楠叶锈菌的锈子器上保湿培养一段时间后,均能在锈子器上生长,并覆盖锈子器(图 1)。对菌丝覆盖的锈孢子镜检后发现,锈孢子的内含物明显浓缩,大部分完全成了空壳(图 2)。

|
| 图 1 三株真菌在石楠锈孢锈菌上的生长 A:PG52;B:PG53;C:PG90 |

|
| 图 2 三菌株处理后的锈孢子显微特征 C0:对照;A:PG52;B:PG53;C:PG90 |
PDA培养基上的菌落白色,绒絮状,放射状生长,环纹不明显;背面菌落略呈粉色,呈放射状,培养基平板不变色(图 3-A1,A2)。改良Fries培养基上的菌落白色,厚,绒状,环纹明显;背面棕色至褐色,环纹和放射状明显;培养基平板不变色(图 3-B1,B2)。理查培养基上的菌落白色,绒状,环纹明显;背面粉色,有环纹;培养基平板不变色(图 3-C1,C2)。

|
| 图 3 菌株PG52培养性状和孢子显微特征 A1-2:PDA培养基上未产分生孢子时培养性状;B1-2:改良Fries培养基上的培养性状;C1-2:理查培养基上的培养性状;D1-2:PDA培养基上产生分生孢子时的培养性状;E:菌株PG52分生孢子显微特征 |
产孢时,PDA培养基上菌落白色,环纹尤为明显,黑色墨汁状孢子团稀少;背面浅棕色,环纹明显;培养基平板不变色(图 3-D1,D2)。
菌株PG52显微特征(图 3-E):分生孢子梭形,直或微弯,大小为(25.0-30.0 µm×5.0-6.5 µm);5个细胞中,三色胞长16.0-19.0 µm,同色或异色,异色者,中间色胞色深,呈棕色,前后两色胞同色;顶端附属丝2-3根,先端无勺状膨大,不分支,长9.5-13.5 µm;基部柄长可达6.5 µm。
2.3.2 菌株PG53培养性状PDA培养基上的菌落浅粉灰色,平铺于平板,呈放射状,气生菌丝不发达,无环纹;背面中部为浅棕色,明显呈放射状,周围菌丝体白色;培养基平板不变色(图 4-A1,A2)。改良Fries培养基上的菌落较紧密,中部白色,边缘一圈棕色,下面似有暗褐色色素沉着,略有环纹;背面菌落中部白色,由外向内渐变褐色、暗褐色,边缘棕色,环纹明显;培养基平板不变色(图 4-B1,B2)。理查培养基上的菌落中部白色,边缘浅褐色,气生菌丝不发达,大部分平铺于平板上,仅中部成稀疏絮状;背面棕色,呈放射状;培养基平板不变色(图 4-C1,C2)。
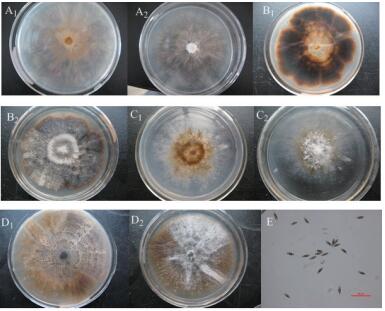
|
| 图 4 菌株PG53培养性状和孢子显微特征 A1-2:PDA培养基上未产分生孢子时的培养性状;B1-2:改良Fries培养基上的培养性状;C1-2:理查培养基上的培养性状;D1-2:PDA培养基上产分生孢子时的培养性状;E:菌株PG53分生孢子显微特征 |
产孢时,PDA培养基上,菌落平铺于平板,气生菌丝不发达,菌丝体有白色和棕色两种,棕色的放射状尤为明显,黑色孢子团多出现在白色菌落上,呈颗粒状,小而密聚;背面棕色、浅褐色,呈放射状,有大量密集的黑点,且呈环状排列;培养基平板不变色(图 4-D1,D2)。
菌株PG53显微特征(图 4-E),分生孢子梭形,直或微弯,大小为24.0-31.0×5.0-7.5 µm,5个细胞中,三色胞长15.5-19.0 µm,异色,前二色胞颜色深于第三色胞,尤中间色胞呈棕色;顶端2-3根附属丝,先端无勺状膨大,不分支,长12.0-18.0 µm;基部柄长3.0-8.5 µm。
2.3.3 菌株PG90培养性状在PDA培养基上,菌落粉白色,绒絮状,厚,环纹非常明显,略呈放射状,气生菌丝发达;背面粉白色,环纹明显;培养基平板不变色(图 5-A1,A2)。改良Fries培养基上,菌落絮状,环纹不明显,略呈放射状生长;背面呈浅棕色,有环纹,明显呈放射状;培养基平板不变色(图 5-B1,B2)。理查培养基上(图 5-C1,C2),菌落白色,绒絮状,无环纹;背面略显粉色,无环纹;培养基平板不变色。

|
| 图 5 菌株PG90培养性状和孢子显微特征 A1-2:PDA培养基上未产分生孢子时培养性状;B1-2:改良Fries培养基上的培养性状;C1-2:理查培养基上的培养性状;D1-2:PDA培养基上产生分生孢子时的培养性状;E为菌株PG52分生孢子显微特征 |
产孢时,PDA培养基上地菌落白色,绒絮状,黑色墨汁状的孢子团数量少分布不均匀;背面浅粉黄色,略呈放射状;培养基平板不变色(图 5-D1,D2)。
显微特征(图 5-E),分生孢子梭形,直或微弯,大小为(23.0-31.0)µm×(5.0-6.0)µm,5个细胞中,三色胞长15.5-20.5 µm,异色,最后一个色胞近无色,中间色胞颜色明显深于第一个色胞,呈褐色;顶端2-4根附属丝,先端无勺状膨大,不分支,长10.0-17.5 µm;基部柄长3.0-5.0 µm。
2.4 ITS序列扩增及分析通过1%琼脂糖电泳检测PCR扩增产物,在600 bp左右出现目的条带。扩增产物经纯化、测序,得到如下序列。序列在GenBank中进行同源性比较分析,结果(图 6)显示菌株PG52与Pestalotiopsis vismiae(Accession number FJ481027.1)、Pestalotiop-sis disseminata(Accession number JQ323000.1)、Pestalosphaeria hansenii(Accession number JF4395-05.1)等的ITS序列均有100%的相似性;PG53与Pestalotiopsis neglecta(Accession number JX8545-41.1)、Pestalotiopsis vismiae(Accession number AB-251916.1)、Pestalotiopsis sp.(Accession number JF-773663.1)等的ITS序列均有100%的相似性;PG-90与Pestalotiopsis neglecta(Accession number JX854-541.1)、Pestalotiopsis sp.(Accession number HE608-797.1)、Pestalotiopsis sp.(Accession number JF773-663.1)等的ITS序列均有100%的相似性。根据序列比对结果,确定3株菌均属于拟盘多毛孢属真菌。

|
| 图 6 PG52、PG53、PG90序列分析 |
抑菌结果(表 1、表 2)显示,菌株PG90的粗提物对番茄灰霉和白菜黑斑没有活性,对其他8种植物病原菌有微弱的活性;菌株PG53对番茄灰霉和黄瓜枯萎没有活性,对棉花枯萎的抑菌圈直径达到4.6 cm,但是抑菌圈完全不透明;菌株PG52对番茄灰霉和白菜黑斑无活性,对黄瓜枯萎和小麦雪腐的抑菌圈较小,对其余6种植物病原菌的抑菌圈均超过2 cm,且抑菌圈透明,由此可见菌株PG52的抑菌活性明显优于其他2个菌株。
拟盘多毛孢属至今已报道220多个种,目前对该属的分类主要沿袭Guba(1961)的分种方法。但因种间分生孢子等形态特征过于重叠,许多种之间的界限模糊不清,不同作者的描述相差甚远[11, 12]。为鉴定分离得到的3株重寄生菌,除形态观察描述外,还对ITS序列进行了分析,但3个菌株的ITS序列均与3-7个已知种有100%的相似度,因此暂时不能确定种名。今后的研究中,除了测定ITS序列,还将借助其他分子标记片段如28S和beta-tubulin基因将拟盘多毛孢鉴定到种。
本研究分离获得的3株重寄生拟盘多毛孢形态特征差异明显,对石楠锈孢锈菌的锈孢子有强寄生作用,被作用的锈孢子内含物明显浓缩,大部分成了空壳;对10种常见植物病原真菌有一定抑制作用,本研究为重寄生拟盘多毛孢在锈病生物防治中的应用及其次生代谢产物的研究奠定了良好的基础。
4 结论本研究从患有锈病的球花石楠叶片上分离纯化出3株拟盘多毛孢真菌,均为石楠锈孢锈菌的重寄生菌。三株重寄生拟盘多毛孢形态特征差异明显,对石楠锈孢锈菌的锈孢子均有强寄生作用,被作用的锈孢子内含物浓缩,大部分完全成了空壳;同时对十种常见植物病原真菌有一定的抑制作用。
| [1] | Maharachchikumbura SS, Guo LD, Chukeatirote E, et al. Pestalotiopsis-morphology, phylogeny, biochemistry and diversity. Fungal Diversity, 2011, 50 (1): 167–187. DOI:10.1007/s13225-011-0125-x |
| [2] | Hopkins KE, Mcquilken MP. Characteristics of Pestalotiopsis associated with hardy ornamental plants in the UK. European Journal of Plant Pathology, 2000, 106 : 77–85. DOI:10.1023/A:1008776611306 |
| [3] | Taylor JE, Crous PW, Palm ME. Foliar and stem fungal pathogens of Proteaceae in Hawaii. Mycotaxon, 2001, 78 : 449–490. |
| [4] | Keith LM, Velasquez ME, Zee FT. The relationship between an endangered North American tree and an endophytic fungus. Plant Disease, 2006, 90 : 16–23. DOI:10.1094/PD-90-0016 |
| [5] | Xu J, Ebada SS, Proksch P. Pestalotiopsis a highly creative genus:chemistry and bioactivity of secondary metabolites. Fungal Diversity, 2010, 44 (1): 15–31. DOI:10.1007/s13225-010-0055-z |
| [6] | Li J, Xie J, Yang YH, et al. Pestalpolyols A-D, cytotoxic polyketides from Pestalotiopsis sp. cr013. Planta Medica, 2015, 81 : 1285–1289. DOI:10.1055/s-00000058 |
| [7] | Xie J, Li J, Yang YH, et al. Two new ambuic acid analogs from Pestalotiopsis sp. cr013. Phytochemistry Letters, 2014, 10 : 291–294. DOI:10.1016/j.phytol.2014.10.002 |
| [8] | 白志强, 林秀萍, 刘永宏. 内生拟盘多毛孢菌化学成分研究进展. 天然产物研究与开发, 2013, 25: 706–715. |
| [9] | 蔡灿, 伍建榕. 球花石楠锈病病原物的初步研究. 北方园艺, 2008(1): 208–210. |
| [10] | 李向楠, 周稚凡, 刘风路, 等. 云南榧种子内生真菌的分离鉴定及抑菌活性筛选. 生物灾害科学, 2016, 39(1): 20–26. |
| [11] | 韦继光, 徐同, 廖旺姣, 等. 拟盘多毛孢属的分类学研究进展. 广西农业生物科学, 2006, 25(1): 78–85. |
| [12] | 韦继光, 徐同. 植物内生拟盘多毛孢的生物多样性. 生物多样性, 2003, 11(2): 162–168. |






