2. 江西省农科院质标所,南昌 330200
2. Agricultural Product Quality Safety and Standards Institute, Jiangxi Academy of Agricultural Sciences, Nanchang 330200
富营养化(Eutrophication)是指在人类活动影响下,水体接纳了过量的氮、磷等营养物质,造成水质恶化、水体生态系统和水功能受到阻碍和破坏的现象[1, 2]。氮、磷污染物是导致水体富营养化的主要因素,它们的协同去除是污水生物处理的主要目标。传统的生物脱氮除磷过程中,反硝化细菌和聚磷菌之间往往因碳源竞争、泥龄适应不统一等问题使得传统的生物脱氮除磷工艺有着自身难以解决的矛盾[3]。20世纪80年代以来,研究者发现了在有氧条件下利用好氧反硝化酶进行反硝化作用的好氧反硝化菌[4, 5],从而拓宽了传统厌氧反硝化现象的认识。此类现象也使好氧条件下同时完成反硝化和除磷两种功能成为可能,有效地解决了原有反硝化除磷技术不同步的矛盾。
在污水处理的工程中多采用A/O、A2/O、O/A等工艺,这些工艺在工程应用中占地大、成本高、运行周期长。好氧反硝化菌的应用,可以使硝化反硝化在同一环境下同时进行,大大减少占地面积和建设资金。反硝化过程中产生的碱度可以部分补偿硝化过程中损失的碱度,能使系统中的pH值保持相对稳定。反硝化阶段不需要另外添加碳源,可以减少碳源,降低成本。尤其在水产养殖水体污染物的去除上,由于亚硝酸盐氮和可溶性磷的有效去除是水产业亟需解决的关键问题之一,在鱼虾养殖过程中必须充氧来保证水中的溶解氧量,好氧反硝化除磷菌的筛选与应用为解决该问题提供了思路。
本研究从福州某养猪场污水处理池中的水样中筛选获得两株具有在好氧状态下脱氮聚磷效果的反硝化聚磷菌,并考察了菌株对人工合成污水和富营养化水体脱氮除磷的效果,旨在为好氧反硝化除磷技术的应用与推广提供一定的参考。
1 材料与方法 1.1 材料 1.1.1 培养基BTB培养基[6];限P和P过量的葡萄糖-MOPS固体培养基[7];硝酸盐还原培养基[7]YG培养基[7];反硝化细菌培养基[7];反硝化除磷培养基(mg/L):琥珀酸钠4.72,NaNO2 0.05,KH2PO4 0.09,MgSO4·7H2O 1.0,pH7.2;人工合成污水(mg/L):葡萄糖360,酵母膏80,磷酸二氢钾14,七水硫酸镁24,氯化铵60,氯化钙18,碳酸氢钠24,七水硫酸锰6,三氯化铁0.3,亚硝酸钠30,硝酸钾30,pH7.0,1000 mL水。
1.1.2 主要试剂格里斯(Griess)试剂Ⅰ:磺胺酸0.5 g,溶于150 mL醋酸溶液(30%),棕色瓶保存。格里斯(Griess)试剂Ⅱ:a-萘胺0.5 g,加入50 mL蒸馏水中,煮沸后,缓缓加入100 mL醋酸溶液中,保存于棕色瓶子中。二苯胺试剂:二苯胺0.5 g溶于100 mL浓硫酸中,用20 mL蒸馏水稀释。所用化学试剂均为分析纯。
1.1.3 主要仪器Nikon fci-LZ生物显微镜(NIKON仪器(上海)有限公司);紫外分光光度计(SP752,上海光谱仪器有限公司);ZHWY-3112B摇床(上海智城分析仪器制造有限公司);PCR扩增仪(S1000,Bio-Rad公司);电泳仪(6003EN,上海申能博彩生物科技有限公司);HH-4恒温水浴锅(上海江星仪器有限公司);5B-1(F)型COD快速测定仪(联华科技)。
1.2 方法 1.2.1 样品采集污水样品采集自福州某养猪场污水处理池中的水样。
1.2.2 菌种分离吸取5 mL水样,加入0.8%无菌生理盐水100 mL,混匀。按5%(v/v)比例接入反硝化细菌培养基中,于28℃、120 r/min的摇床上振荡富集培养5 d。用0.8%无菌生理盐水稀释富集培养液,采用梯度稀释及涂布法,将培养液均匀涂布于BTB培养基,28℃培养1-2 d。挑取周围培养基出现蓝色的单菌落为初筛菌,将菌体接种至装有10 mL硝酸盐还原培养基的试管中,培养1、3、5、8 d。每株细菌做3个平行样,并设置不接种的体系作为对照。选取硝酸盐还原阳性的的菌株点种于限磷和磷过量的葡萄糖-MOPS培养基,28℃培养1-2 d。观测蓝白斑的生长情况。挑取在两种培养基上同时都产生蓝斑的菌株,接入反硝化除磷培养基,培养30 h。挑选能够在有氧条件下高效去除亚硝酸盐氮及PO43--P的菌株,接种到YG培养基中,厌氧培养24 h。挑取细菌,按常规制成涂片,采用苏丹黑染色法进行PHB染色[8]。再好氧培养24 h。挑取细菌,按常规制成涂片,利用Albert染色法进行Poly-P染色[9]。
1.2.3 菌种DNA的提取、扩增和分析取培养至对数生长期的菌液5 mL,8 000 r/min离心10 min,倾去上清液,收集菌体。采用CTAB/NaCl法[10]提取菌体基因组DNA。步骤如下:菌体中加入1.35 mL TE溶液(pH8.0),悬浮,加入0.3 mL 10%十二烷基硫酸钠(SDS)、100 μL 100 mg/mL溶菌酶和100 μL 100 mg/mL蛋白酶K,混匀,60℃水浴1 h,加0.25 mL 5 mol/L NaCl和0.2 mL CTAB/NaCl溶液,65℃水浴10 min,以等体积的苯酚/氯仿/异戊醇和氯仿/异戊醇各抽提1次,异丙醇沉淀DNA,DNA溶于50 μL TE中,-20℃保存备用。利用1%琼脂糖凝胶电泳检测抽提的基因组DNA完整性。采用16S rRNA基因的通用引物27F(5' -AGAGTTTGATCCTGGCTC-AG-3' )和1492R(5' -GGTTACCTTGTTACGACTT-3' )对提取的DNA进行PCR扩增。将扩增后的DNA产物送至上海生物工程有限公司进行测序。用BLAST软件与NCBI的GenBank数据库收录的的16S rRNA序列进行比对分析。
1.2.4 菌株拮抗试验采用平板对峙法观察菌株之间有无拮抗作用,选取其中一株菌作为指示菌,其余菌株以十字划线的方式接种到含有指示菌的平板上,培养72 h至更长,观察有无抑菌现象的出现。
1.2.5 人工合成污水吸磷实验用接种环从斜面挑起少量菌体,接入YG培养基中,28℃、120 r/min培养3-4 d至对数生长期,菌液8 000 r/min离心5 min,弃上清液得到菌体,用0.8%生理盐水洗去菌体上的培养基,用无菌水溶解,离心,弃上清液得到菌体,重复3次,获得单株菌菌体。称取等量的以上单株菌菌体混合配比成复合菌剂。
将上述制备的菌体分别以1%的接种量接入人工合成污水中。28℃、120 r/min培养24 h。培养液8 000 r/min离心5 min,吸取上清液测定其中的磷含量。
1.2.6 富营养化水体的净化实验采集福州某富营养化河水(COD在100 mg/L以下)作为实验对象。量取10 L河水,加入到处理容器中,设置实验组和对照组,实验组分别投加2.5%(v/v)的单菌菌体和复合菌体,在室温下采用间歇曝气方式,即曝气8 h,停曝16 h。不同时间取样测定水中总氮、NO3--N和总磷的含量。
1.2.7 测定方法总氮采用碱性过硫酸钾消解紫外分光光度法测定,NO3--N采用二苯胺试剂检测;总磷采用过硫酸钾氧化-钼酸铵分光光度法测定[11]。
2 结果 2.1 富集、分离培养经反硝化细菌培养基富集和BTB平板划线纯化后共获得89个单菌落,其中65株菌硝酸盐还原阳性。从限磷和磷过量的葡萄糖-MOPS培养基上挑取能同时产生蓝斑的单菌落,共获得21个单菌落。对该21株细菌进行反硝化除磷性能的比较研究,最终筛选出两株能够在有氧条件下去除亚硝酸盐氮及PO43--P的菌株,它们对亚硝酸盐氮的去除率可达80.5 %、84.2%,对PO43--P的去除率可达87.2 %、80.4%。菌株N1和N2经碱性美蓝染色后显微镜油镜观察(图 1,图 2)。

|
| 图 1 菌株N1碱性美蓝染色形态(1 000×) |
|
| 图 2 菌株N2碱性美蓝染色形态(1 000×) |
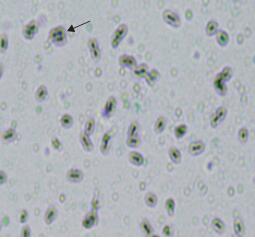
菌株N1和N2经苏丹黑染色法和Albert染色法染色后油镜观察。在培养过程中菌株N1和N2菌体内均有poly-P和PHB累积。由于N1和N2的染色结果相类似,所以以N1的染色图片(图 3,图 4)为代表。可以看出,菌株N1经苏丹黑染色法染色后,膜内除细胞质外有明显的黑色颗粒,说明胞内有PHB。菌体呈粉红色,类脂粒呈蓝黑色。通常聚磷菌体内PHB为细菌细胞内储存能量的脂质内含物。它分解产生能量,一部分供聚磷菌正常的生长繁殖,另一部分供其主动吸收环境中的磷合成聚磷。图 4可以看出,菌株N1经Albert染色法染色后菌体呈绿色,poly-P呈黑色。

|
| 图 3 菌株N1的PHB颗粒染色 箭头所指即为PHB颗粒 |
|
| 图 4 菌株N1的poly-P染色 箭头所指即为poly-P |
用BLAST软件将菌株N1和N2与NCBI的GenBank数据库收录的的16S rRNA序列进行比对分析。N1与Achromobacter sp. NT 5-04的16S rRNA基因序列的相似性为99%,鉴定为无色杆菌属(Achr-omobacter sp.)。N2与Brevundimonas sp. H208和Brevundimonas sp. KACC10191的相似性分别为100%和99%,鉴定为短波单胞菌属(Brevundimonas sp.)。
2.3 菌株拮抗试验通过菌株之间的拮抗试验,确定菌株N1和N2之间无拮抗作用,将菌株N1和N2等量配比,获得复合菌FIM-1,进行后续试验。
2.4 人工合成污水吸磷实验人工合成污水吸磷实验结果(表 1)表明,菌株N1、N2和复合菌FIM-1具有一定的除磷效果,但随着水体中磷含量的增加,磷的去除率明显下降,说明这两株菌可能更适合于低浓度磷废水的净化。
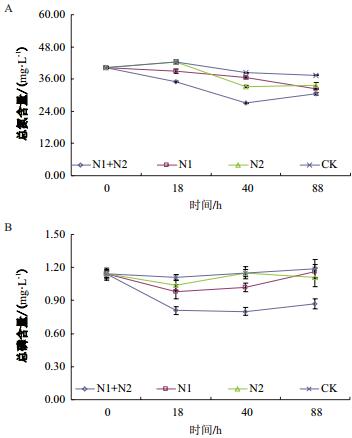
富营养化水体的净化实验结果(图 5)表明,加入菌剂的试验组的总氮和总磷初始阶段均呈下降趋势,总氮至40 h降至最低,随后上升,对照组的总氮在18 h内上升,18 h后下降(加入N1、N2、FIM-1和对照组CK的总氮在40 h内去除率分别为9.20%、17.16%、32.84%和4.72%)。总磷则至18 h降至最低(加入N1、N2、FIM-1和对照组CK的总磷在18 h内去除率分别为14.04%、8.77%、28.95%和2.63%),随后上升,可能是后期菌体自溶释放出磷,导致水体中磷浓度上升。加入菌剂的实验组对总氮、总磷的去除效果均优于空白对照组,而混合菌对总氮、总磷的去除效果优于单菌。
|
| 图 5 富营养化水体脱氮(A)除磷(B)实验结果 |
目前已报道的好氧反硝化细菌主要归属于假单胞菌属(Pseudomonas sp.)、克雷伯菌属(Klebsiella sp.)、红球菌属(Rhodococcus sp.)、产碱杆菌属(Alcaligenes sp.)、动胶菌属(Zoogloea sp.)、副球菌属(Paracoccus sp.)、苍白杆菌属(Ochrobacterium sp.)、生丝微菌属(Hyphomicrobium sp.)和芽孢杆菌属(Bacillus sp.)等[12-16],本研究中筛选获得的无色杆菌属(Achromobacter.sp)和短波单胞菌属(Brevundimonas.sp)在好氧反硝化细菌的研究报道中较少见。
虽然好氧反硝化技术引起越来越多的关注,但是在好氧条件下反硝化和除磷的研究报道甚少。于大禹等[17]研究了一株假单胞菌的好氧脱氮除磷的效能。Ma等[18]探讨了不同氧浓度对农杆菌Agrobacterium sp. LAD9脱氮除磷的影响。马放等[19]分离到一株高效除磷的芽孢杆菌。安健等[20]从养虾塘中筛选到在有氧条件下同时具有反硝化和除磷功能的蜡样芽胞杆菌。本研究中筛选获得具有好氧反硝化脱氮除磷特性的无色杆菌属和短波单胞菌属菌株,扩大了好氧反硝化聚磷菌的菌源。
根据生物除磷代谢机理模式可知,厌氧/好氧或厌氧/缺氧环境的交替变化都可以诱导磷的超量吸收,前者以分子氧作为电子受体、后者以NO3-作为电子受体。由于NO3--N电子受体传递链短、氧化还原电位低,产生ATP只有氧电子受体的2/3,因此,从生物除磷的角度分析,缺氧吸磷的效果不如好氧吸磷[21, 22]。在序批式生物膜工艺中,缺氧反硝化吸磷速率较好氧反硝化吸磷速率明显降低,约为好氧吸磷速率的1/6[23];方茜等[24]考察了SBR系统内DO浓度对反硝化除磷的影响,发现在有氧条件下,更有利于反硝化除磷效率的发挥,因此好氧反硝化聚磷菌在实际废水脱氮除磷工艺中具有更好的应用潜力,应加强对此方面的深入研究。
虽然投加筛选到的某些高效菌株对特定废水进行处理能够在一定程度上弥补活性污泥工艺的不足,但单一聚磷菌在实际应用中因影响因素较多,并不能很好表现超量聚磷特性。本研究也证实了此观点,筛选到的两株反硝化聚磷菌在实际的富营养化水体初步净化试验中,虽然对总氮和总磷具有一定的去除能力,但其脱氮除磷效果尚不理想。但复合菌剂FIM-1表现出比单菌N1和N2更显著的脱氮除磷效果,说明投加优势菌株的生物强化技术在实际应用中,须考虑各类微生物协同脱氮除磷的作用。在加入菌剂的初始期总磷和总氮下降明显,因此可根据此特性调整处理工艺以提高脱氮除磷效率。特定菌株的反硝化特性与碳源类型、碳氮比、温度、盐度、溶解氧和pH等因素有关[25-30],后续将进行该方面的相关研究。
即使是经过运行稳定的污水处理系统处理过的污水(磷含量在1.0 mg/L以下),排入自然水体后,磷含量仍然远远超出使水体呈现安全状态的16-30倍,仍旧会引发“藻华”的爆发,不能有效防止富营养化的发生。所以,在当前污水除磷的基础上,对于已经处理的出水及其它磷浓度相对较低(1.0 mg/L左右)的污水进行进一步的除磷,也是非常必需和重要的。该无色杆菌N1和短波单胞菌N2及其复合菌FIM-1较适合于低浓度磷废水的净化。因而有必要对其在低浓度磷废水净化中的应用做进一步的研究。
4 结论本实验从福州某养猪场污水处理池的底泥样品中分离获得2株反硝化聚磷菌N-1和N-2,其属于无色杆菌属和短波单胞菌属。将菌株N-1和N-2复配,获得脱氮除磷复合菌FIM-1。富营养化水体的净化实验结果表明,加入单菌N1、N2和复合菌FIM-1的富营养化水体的总氮在40 h内去除率分别为9.20%、17.16%和32.84%,而总磷在18 h内去除率分别为14.04%、8.77%和28.95%,复合菌比单菌表现出更佳的脱氮除磷效果。
| [1] | 秦伯强, 高光, 朱广伟, 等. 湖泊富营养化及其生态系统响应. 科学通报, 2013, 58(10): 855–864. |
| [2] | 赵永宏, 邓祥征, 战金艳, 等. 我国湖泊富营养化防治与控制策略研究进展. 环境科学与技术, 2010, 33(3): 92–98. |
| [3] | 徐亚同. 水中氮磷的处理[M]. 上海: 华东师范大学出版社, 1996: 130-133. |
| [4] | Robertson LA, Kuenen JG. Aerobic denitrification:a controversy revived. Archives of Microbiology, 1984, 139 (4): 351–354. DOI:10.1007/BF00408378 |
| [5] | Robertson LA, Van Niel EWJ, Torremans RAM, et al. Simultaneous nitrification and denitrification in aerobic chemostat cultures of Thiosphaera pantotropha. Applied and Environmental Microbiology, 1988, 54 (11): 2812–2818. |
| [6] | Takaya N, Catalan-Sakairi MAB, Sakaguchi Y, et al. Aerobic denitrifying bacteria that produce low levels of nitrous oxide. Appl Environ Microbio, 2003, 69 (6): 3152–3157. DOI:10.1128/AEM.69.6.3152-3157.2003 |
| [7] | 杨金水. 资源与环境微生物学实验教程[M]. 北京: 科学出版社, 2014: 36-46. |
| [8] | 东秀珠, 蔡妙英编著. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [9] | Serafim LS, Lemos PC, Levantesi C, et al. Methods for detection and visualization of intracellular polymers stored by polyphosphate-accumulating microorganisms. Journal of Microbiological Methods, 2002, 51 (1): 14–18. |
| [10] | 朱旭芬. 现代微生物学实验技术[M]. 杭州: 浙江大学出版社, 2011: 141-142. |
| [11] | 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002: 244-248. |
| [12] | 王薇, 蔡祖聪, 钟文辉, 等. 好氧反硝化菌的研究进展. 应用生态学报, 2007, 18(11): 2618–2625. |
| [13] | Su JJ, Liu BY, Liu CY. Comparison of aerobic denitrification under high oxygen atmosphere by Thiosphaera pantotropha ATCC 35512 and Pseudomonas stutzeri SU2 newly isolated from the activated sludge of a piggery wastewater treatment system. Journal of Applied Microbiology, 2001, 90 (3): 457–462. DOI:10.1046/j.1365-2672.2001.01265.x |
| [14] | Joo HS, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4. Journal of Bioscience and Bioengineering, 2005, 100 (2): 184–191. DOI:10.1263/jbb.100.184 |
| [15] | Patureau D, Zumstein E, Delgenes JP, et al. Aerobic denitrifiers isolated from diverse natural and managed ecosystems. Microbial Ecology, 2000, 39 (2): 145–152. DOI:10.1007/s002480000009 |
| [16] | 杨希, 刘德立, 邓灵福, 等. 蜡状芽孢杆菌好氧反硝化特性研究. 环境科学研究, 2008, 21(3): 155–159. |
| [17] | 于大禹, 郭威, 张金榜, 等. 好氧反硝化菌的筛选及其脱氮除磷性质的研究. 微生物学通报, 2009(4): 598–603. |
| [18] | Ma T, Chen Q, Gui M, et al. Simultaneous denitrification and phosphorus removal by Agrobacterium sp. LAD9 under varying oxygen concentration. Applied Microbiology and Biotechnology, 2016, 100 (7): 1–10. |
| [19] | 马放, 杨菲菲, 张倩, 等. 一株高效反硝化聚磷菌的筛选及脱氮除磷效能. 哈尔滨工业大学学报, 2011, 43(12): 42–47. |
| [20] | 安健, 伏光辉, 阮记明, 等. 反硝化除磷菌筛选及其特性研究. 微生物学通报, 2012, 39(2): 162–167. |
| [21] | 赵林林, 王海燕, 杨慧芬, 等. 废水反硝化除磷技术研究进展. 化工环保, 2011, 31(1): 38–41. |
| [22] | 李勇智, 彭永臻, 王淑滢, 等. 强化生物除磷体系中的反硝化除磷. 中国环境科学, 2003, 23(5): 543–546. |
| [23] | 李军, 彭永臻, 杨秀山, 等. 序批式生物膜法反硝化除磷特性及其机理. 中国环境科学, 2004, 24(2): 219–223. |
| [24] | 方茜, 张朝升, 张可方, 等. 溶解氧对反硝化聚磷菌的影响研究. 中国给水排水, 2008, 24(1): 35–39. |
| [25] | 潘玉瑾, 刘芳, 孟爽, 等. 好氧反硝化菌P. chengduensis ZPQ2的筛选及其反硝化条件优化. 环境工程, 2016, 34(1): 41–46. |
| [26] | 方茜, 张朝升, 张立秋, 等. 曝气量对同时硝化/反硝化除磷工艺效能的影响. 中国给水排水, 2014, 30(21): 14–18. |
| [27] | 吕冬梅, 彭永臻, 赵伟华, 等. A2O-BAF工艺反硝化聚磷效果的影响因素. 中国环境科学, 2015, 35(11): 3266–3274. |
| [28] | 孙庆花, 于德爽, 张培玉, 等. 1株海洋异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性. 环境科学, 2016, 37(2): 647–654. |
| [29] | Yang M, Xue D, Meng F. The effects of salinity on coupled nitrification and aerobic denitrification in an estuarine system. Water Sci Technol, 2015, 71 (11): 1718–1726. DOI:10.2166/wst.2015.159 |
| [30] | Bang DY, Watanabe Y. An experimental study on aerobic denitrification with polyvinyl alcohol as a carbon source in biofilms. Water Science & Technology, 2015, 32 (8): 235–242. |





