在植物遗传转化过程中,需要检测外源基因在受体细胞、组织或完整植物体内是否表达,报告基因即应用而生[1],绿色荧光蛋白(green fluorescent protein,GFP)即是其中一种。GFP是Douglas Prasher在1962年从发光水母(Aequorea victoria)中克隆得到的一种发光蛋白[2]。在450-490 nm蓝光波长下可以发出稳定的绿色荧光[3]。GFP已大量应用于多种细菌、真菌、植物和哺乳动物细胞的研究[4],因为其具有无毒害、易于检测、易于构建载体和获得突变体、适于进行活细胞检测,以及具有良好的通用性等特点,而成为目前被广泛应用的标记基因[5]。Cormack等[6]最先将gfp基因应用于玉米黑粉菌的标记,随后GFP在真菌中得以广泛应用。目前,绿色荧光蛋白基因已经被应用于真菌蛋白质及细胞器定位、致病性机理、生态学行为、细胞动力学及真菌的定殖情况进行检测[7]。
植物内生真菌是指一定阶段或全部阶段生活于健康植物的各种组织和器官内部而不使植物患病的真菌或细菌[8],目前已被广泛研究的一种微生物资源[9],通过与宿主植物的相互作用,表现丰富的生物学功能[10]。本研究选取了一株分离于盘锦红海滩碱蓬组织的内生真菌JP4-1菌株,经鉴定其为小丛壳属(Glomerella sp.),是一种丝状真菌[11]。以往研究证明JP4-1菌株对水稻具有一定的促生长作用。本实验参考肖荣凤等[12-15]的真菌原生质体制备、再生与转化的方法并加以改进,制备JP4-1菌株的原生质体并进行绿色荧光蛋白转化标记,期望通过gfp基因的标记,探究菌株在水稻幼苗中的定殖情况,为内生真菌的促生作用机理研究奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒菌株JP4-1分离于辽宁省盘锦红海滩碱蓬,由沈阳师范大学生命科学学院微生物学实验室提供;pCT74质粒(保存于E. coli DH5α)由中国科学院北京微生物研究所赠送,含真菌pyrenophora ticirepentis的Tox A启动子和潮霉素B(HmB)磷酸转移酶基因(hygr)。
1.1.2 水稻种子常规水稻辽星1号,由辽宁省稻作研究所提供。
1.1.3 培养基LB培养基:酵母浸粉5 g、蛋白胨10 g、NaCl 5 g、水1 000 mL;马铃薯蔗糖琼脂培养基(PSA):马铃薯200 g、蔗糖20 g、琼脂20 g、水1 000 mL;马铃薯蔗糖培养基(PSB):马铃薯200 g、蔗糖20 g、水1 000 mL;再生固体培养基:马铃薯200 g、山梨醇182 g、琼脂20 g、水1 000 mL;再生半固体培养基:马铃薯200 g、山梨醇182 g、琼脂10 g、水1 000 mL。上述培养基于120℃灭菌20 min,待用。
1.1.4 主要试剂氨苄青霉素(Ampicillin,Amp);潮霉素B(Hygromycin,HmB);山梨醇溶液(STC):含1.2 mol/L山梨醇,10 mmol/L Tris-HCl(pH7.5),50 mmol/L CaCl2;2×STC:含2 mol/L山梨醇,100 mmol/L Tris-HCl(pH8.0),100 mmol/L CaCl2;0.8 mol/L NaCl、60% PEG4000;Hoagland营养液:含0.5 mol/L Ca(NO3)2、0.5 mol/L KNO3、0.25 mol/L MgSO4、0.2 mol/L KH2PO4;50 mmol/L H3BO3、0.6 mmol/L MnSO4、0.3 mmol/L CuSO4·5H2O、0.7 mmol/L ZnSO4·7H2O、0.6 mmol/L H2MoO4、0.6 mmol/L Na2MoO4、20 mmol/L Na-EDTA、20 mmol/L FeSO4·7H2O。
1.1.5 酶和引物崩溃酶(Drislase,购自Sigma公司);溶壁酶(Lysing Enzyme,购自广东微生物所);裂解液:含20 mg/mL崩溃酶和20 mg/mL溶壁酶,酶液用预冷的0.8 mol/L NaCl溶液配制,30℃,80 r/min震荡溶解30 min,0.22 μm微孔过滤器除去杂质。GFP特异性引物[11](P28:5' -TAGTGGACTGATTGGAATGCATGGAGGAGT-3' 、P29:5' -GATAGAACCCATGGCCTATATTCATTCAAT-3' )由生工生物工程(上海)股份有限公司合成。
1.2 方法 1.2.1 菌株JP4-1对潮霉素B(HmB)的敏感性测定分别在含有0、50、100、150、200、250、300、350和400 μg/mL HmB的PSA培养基上用点接法接种活化的JP4-1菌丝,25℃培养7 d,观察菌丝的生长状态,测量生长第7天的菌落直径,以确定潮霉素B的最低抑菌浓度。
1.2.2 pCT74质粒的提取与验证接种携带pCT74质粒的载体E. coli DH5α菌液1 mL于50 mL含50 μg/mL Amp的LB培养基中,37℃,135 r/min震荡培养24 h。用质粒快速抽提试剂盒提取质粒。利用GFP特异性引物P28、P29进行PCR扩增。反应条件为:95℃预变性3 min;95℃变性30 s,55℃退火30 s,延伸72℃ 60 s,共35个循环;延伸72℃ 10 min;4℃保存。8%琼脂糖凝胶电泳检测所提质粒,-20℃保存备用。
1.2.3 菌株JP4-1原生质体的制备接种JP4-1菌株于PSB培养基,120 r/min,25℃震荡培养120 h,用移液器吸取3 mL菌液于50 mL PSB培养基,135 r/min,25℃震荡培养72 h。三层擦镜纸过滤并收集菌丝,用0.8 mol/L预冷的NaCl溶液充分洗涤菌丝两次。在50 mL无菌三角瓶中加入10 mL裂解液和约800 mg菌丝体,30℃,80 r/min作用2.5 h。三层擦镜纸过滤并收集滤液于15 mL离心管,4 000 r/min离心10 min,弃上清。加入10 mL STC溶液洗涤沉淀,4 000 r/min离心10 min,收集沉淀。用STC溶液调整原生质体浓度为2×107-3×107 CFU/mL,立即转化。
1.2.4 原生质体的转化取1 mL原生质体加入20 μg pCT74质粒,25 μL 2×STC,25 μL 60% PEG4000,室温作用20 min,再加入1.2 mL 60% PEG4000,室温作用5 min。加入4 mL STC溶液,3 000 r/min离心10 min,沉淀用1 mL 2×STC悬浮。将所得溶液加入50 mL冷却至50℃的含50 μg/mL Amp和200 μg/mL HmB的再生半固体培养基中,震荡混匀,迅速倒入含有一层再生固体培养基的平板上,待凝固后25℃倒置培养,直至长出菌落。
1.2.5 转化子菌株的荧光检测及稳定性分析选择长在平板中央的第一代转化子菌落,挑取边缘菌丝置于荧光显微镜蓝光波长下镜检。选择具有荧光的菌落,接种于含200 μg/mL HmB和50 μg/mL Amp的PSA平板连续传代3次,接种最后一代转化子菌落于不含抗性的PSA平板并连续传代3次。用荧光显微镜检测每一代转化子菌落的荧光稳定性。
1.2.6 转化子对水稻幼苗的侵染与定殖检测 1.2.6.1 菌株的液体培养将具有荧光的转化子菌株和野生型菌株分别接种于PSB培养基,130 r/min,25℃培养120 h。
1.2.6.2 水稻幼苗的培育与接种取饱满健康的水稻种子,加水没过种子浸泡24 h,将种子平铺于湿润滤纸表面,覆盖浸湿的六层纱布于暗处催芽48 h。取发芽的种子平铺于覆盖纱网并装满Hoagland营养液的塑料烧杯中央,于人工气候培养箱培养。培养条件:第一阶段:16 h,湿度80%,温度28℃,光照100%;第二阶段:8 h,湿度80 %,温度26℃,光照0%。培养期间每天补充营养液。待水稻种子生根,加入上述培养转化子菌丝球,继续培养3-5 d。用野生型菌株处理的水稻幼苗作对照,以不加菌的水稻幼苗作空白对照。
1.2.6.3 转化子菌株的定殖检测取水稻幼苗的根用1 N盐酸解离并压片,同时,分别取水稻幼苗叶片和茎部,制成临时装片,于荧光显微镜下检测菌株的定殖情况。分别取水稻幼苗的叶片、茎部和根部,进行常规石蜡切片制备,封片后,于荧光显微镜下检测菌株的定殖位置。
1.2.7 转化子和水稻幼苗中gfp基因的PCR检测用真菌基因组快速提取试剂盒分别提取野生型菌株基因组DNA和第6次传代培养的转化子基因组DNA,并标记为D-YJ和D-ZJ。分别取未被内生真菌侵染的水稻幼苗、被野生型菌株侵染的水稻幼苗和被转化子侵染的水稻幼苗的根和叶,于液氮中研磨至匀浆状,并用真菌基因组快速提取试剂盒提取其中的菌株DNA,分别标记为D-SD、D-WZ、D-Z-G和D-Z-Y,采用GFP特异性引物P28、P29对提取到的DNA样品进行PCR扩增。反应条件为:预变性95℃ 3 min;变性95℃ 30 s,退火温度55℃ 30 s,延伸72℃ 60 s,共35个循环;延伸72℃ 10 min;4℃保存。8%琼脂糖凝胶电泳检测。以野生型菌株基因组作对照。
2 结果 2.1 菌株JP4-1对潮霉素B(HmB)的敏感性测定JP4-1菌株的HmB敏感性试验结果,见图 1。接种时的初始菌落直径忽略不计,菌落生长第7天时,菌株JP4-1在含有150 μg/mL HmB的PSA平板上仅能微弱生长,在含有200 μg/mL HmB的PSA平板上不能生长,因此选择该浓度为原生质体再生及转化子菌株筛选的抗生素选择压。

|
| 图 1 从上到下、从左到右:HmB的浓度依次为0、50、100、150、200、250、300、350、400 μg/mL 从上到下、从左到右:HmB的浓度依次为0、50、100、150、200、250、300、350、400 μg/mL |
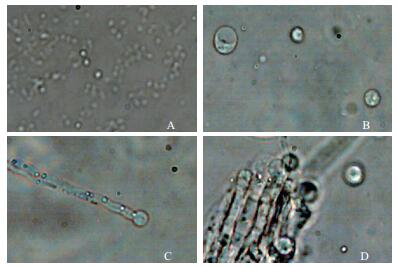
取酶解2.5 h的菌丝观察,可见JP4-1菌株的原生质体为大小不一的圆球形(图 2),其形成方式为顶端释放。转化子的菌落与野生型菌株的菌落差别不大。菌落白色,致密,如图 3所示。
|
| 图 2 JP4-1菌株的原生质体 A:JP4-1的原生质体形态(10×);B:JP4-1的原生质体形态(40×);C,D:JP4-1原生质体的形成方式(40×) |

|
| 图 3 转化子菌株在含有200 μg/mL HmB的再生培养基的菌落形态 |
经观察,转化子的菌丝和孢子在蓝光的激发下可以发出较强的绿色荧光。在含有HmB和Amp的PSA平板上连续传代3次后,能继续发出较强的绿色荧光。不含抗性的PSA平板上连续传代3次仍能发出绿色荧光,发光强度保持稳定(图 4)。

|
| 图 4 转化子菌株的菌丝在荧光下的形态 A:转化子的菌丝在荧光下的形态(40×);B:转化子的菌丝在可见光下的形态(40×) |
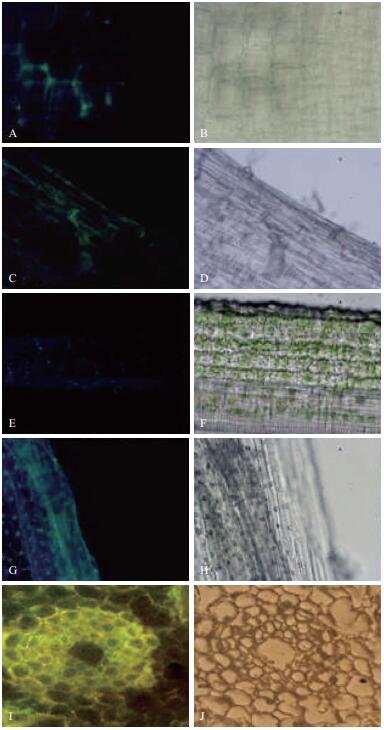
取经转化子处理培养的水稻幼苗根茎叶分别制片于荧光显微镜下检测,结果(图 5)表明,在水稻幼苗的根部、茎部和叶部均可检测到带有绿色荧光的转化子菌株。菌株定殖于水稻的细胞间隙。在野生型菌株处理的水稻幼苗和未加菌处理的水稻幼苗中,均未检测到绿色荧光,水稻幼苗侵染实验的结果(图 6)表明,转化子和野生型菌株处理的水稻幼苗长势均明显优于空白对照组水稻幼苗长势,转化子和野生型菌株对水稻幼苗具有相似的促生长作用,证明gfp基因已成功标记菌株JP4-1并定殖于水稻幼苗组织内。
|
| 图 5 水稻幼苗的根、茎、叶的显微形态(40×) A:水稻幼苗根在荧光下的形态(纵切);B:水稻幼苗根在可见光下的形态(纵切);C:水稻幼苗根在荧光下的形态(纵切);D:水稻幼苗根在可见光下的形态(纵切);E:水稻幼苗茎在荧光下的形态(纵切);F:水稻幼苗茎在可见光下的形态(纵切);G:水稻幼苗叶片在荧光下的形态(纵切);H:水稻幼苗叶片在可见光下的形态(纵切);I:水稻幼苗根的石蜡切片在荧光下形态(横切);J:水稻幼苗根的石蜡切片在可见下形态(横切) |

|
| 图 6 转化子菌株对水稻幼苗的促生长作用 从左至右依次为:未加菌处理的水稻幼苗、转化子菌株侵染的水稻幼苗、野生型菌株侵染的水稻幼苗 |
转化子与水稻幼苗中的gfp基因的PCR检测结果如图 7。通过对比野生型菌株(D-YJ)与转化子(D-ZJ)的PCR结果可知,转化子DNA经PCR扩增得到一条约417 bp的目的条带,证明转化成功。通过对比未侵染的水稻幼苗(D-SD)、野生型菌株侵染的水稻幼苗(D-WZ)和被转化子侵染的水稻幼苗(D-Z-G、D-Z-Y)的PCR结果,未侵染水稻和用野生型菌株侵染的水稻中,均未获得目的条带,而被转化子侵染的水稻幼苗(根、叶)均扩增出了约417 bp的目的片段,由此说明gfp基因已成功与菌株基因组整合表达,稳定遗传。同时被gfp标记的转化子侵染进入到水稻幼苗的根、茎和叶,JP4-1菌株为植物内生真菌。

|
| 图 7 转化子菌株的PCR检测 1:DNA Marker;2:D-YJ;3:D-ZJ;4:D-SD;5:D-WZ;6:D-Z-G;7:D-Z-Y |
GFP具有稳定、便于观察、不需添加外源底物就可以在活细胞中直接进行定位检测等优点[12],因此越来越多地被应用于真菌定殖标记。目前将gfp基因与真菌基因组整合的方法主要有原生质体转化法、基因枪法和电激法[16-18],与后两种相比,原生质体转化的方法不受昂贵实验仪器的限制在实验室条件下即可完成[18]。因此,本实验选择PEG-CaCl2介导的原生质体转化方法。在原生质体制备的过程中,参考Souza等[19]的实验,选择目前比较常用的两种酶液对菌丝体进行消化,实验表明将不同浓度和种类的酶液混合制成裂解液处理新鲜菌丝相比于用单一酶液处理菌丝,菌株的原生质体在相同时间内得率较高,利于试验的进一步进行。
实验结果表明,菌株在含有200 μg/mL HmB的PSA平板上基本不能生长,因此确定此HmB浓度为原生质体再生及转化子菌株筛选的抗生素选择压。但是在原生质体再生的试验过程中发现,在再生培养基中同时加入50 μg/mL的Amp作为pCT74质粒的抗性筛选选择压会大大提高转化的成功率。同时,实验表明,在平板边缘生长的转化子一般未被成功转入质粒,这与张俊[14]对芒果尖孢炭疽病原菌的绿色荧光蛋白标记的试验结果一致。
在转化子对水稻幼苗的侵染实验中,经荧光显微镜检测,被标记的菌株可以定殖于水稻幼苗的根部、茎部、叶部的细胞间隙。值得注意的是菌株在水稻幼苗的叶部主要定殖于气孔及叶肉细胞。这与Souza等[20]的研究结果一致。该实验结果进一步说明被标记的菌株具有迁移性,具备从根传输到茎及叶部的能力[21]。同时,实验结果表明转化子处理的水稻幼苗与野生型菌株对水稻幼苗的促生长作用没有明显差别,这说明菌株的定殖部位可能与菌株促生作用的机理有关。
4 结论本实验通过PEG-CaCl2介导的原生质体转化方法,成功获得了能够稳定表达GFP的转化子,通过gfp标记菌株对水稻幼苗的侵染,证明JP4-1菌株可以成功定殖于水稻组织细胞间隙。
| [1] | 黄淑贤. 绿色荧光蛋白在植物上应用研究进展. 北京农业, 2010(21): 8–10. |
| [2] | Lorang JM, Touri RP, Martinez JP. Green fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology, 2001, 67 (5): 1987–1994. DOI:10.1128/AEM.67.5.1987-1994.2001 |
| [3] | 吴沛桥, 胡海, 赵静, 等. 绿色荧光蛋白GFP的研究进展及应用. 生物医学工程研究, 2009, 28(1): 83–86. |
| [4] | Chalfie M, Tu Y, Euskirchen G, et al. Green fluorescent protein as a marker for gene expression. Science, 1994, 263 (5148): 802–805. DOI:10.1126/science.8303295 |
| [5] | 唐孝青, 李斌, 伍小兵, 等. 绿色荧光蛋白及其应用的研究进展. 陕西农业科学, 2007(1): 123–124. |
| [6] | Cormack B. Green fluorescent protein as a reporter of transcription and protein localization in fungi. Curr Opin Microbiol, 1998, 1 (4): 406–410. DOI:10.1016/S1369-5274(98)80057-X |
| [7] | 徐莹, 刘太国, 何月秋, 等. 绿色荧光蛋白及其在丝状真菌研究中的应用. 植物保护, 2008, 34(6): 6–11. |
| [8] | Stone JK, Bacon CE, White JF Jr. An overview of endophytic microbes:endopytism defined. Microbial Endophytes, 2000 : 3–29. |
| [9] | 任安芝, 高玉葆. 植物内生真菌--一类应用前景广阔的资源微生物. 微生物学通报, 2001, 28(6): 90–93. |
| [10] | 杨春平, 陈华保, 吴文君, 等. 植物内生真菌次生代谢产物的多样性及潜在应用价值. 西北农业学报, 2005, 14(2): 126–132. |
| [11] | 于飞, 谷玥, 张奇, 等. 一株碱蓬内生真菌的鉴定及促生活性产物的初步研究. 生物技术通报, 2016, 32(5): 151–157. |
| [12] | 肖荣凤, 张育菁, 李燕丹, 等. 西瓜尖孢镰刀菌FOV-135的绿色荧光蛋白基因转化. 福建农业学报, 200(6): 521–524. |
| [13] | 张欣.香蕉枯萎病菌遗传多态性及绿色荧光蛋白基因转化的研究[D]儋州:华南热带农业大学, 2007. |
| [14] | 张俊, 吕延超, 刘晓妹, 等. 芒果尖孢炭疽病原菌的绿色荧光蛋白基因标记. 热带作物学报, 2011, 32(9): 1708–1710. |
| [15] | 张中义, 冷怀琼, 张志铭, 等. 植物病原真菌学[M]. 成都: 四川科学技术出版社, 1996. |
| [16] | 徐齐军, 胡小平, 陈婷, 等. PEG介导的棉花枯萎病菌原生质体转化体系的建立. 棉花学报, 2012, 24(3): 222–228. |
| [17] | 茅文俊, 鮑大鹏, 周陈力, 等. 运用基因枪法进行蛹虫草遗传转化的研究. 园艺学报, 2015, 42(9): 1837–1842. |
| [18] | 刘昌燕, 赵培静, 汪军, 等. 生防真菌遗传转化方法研究进展. 中国植保导刊, 2009(1): 13–16. |
| [19] | Souza AGC, Herrero S, Maffia LA, et al. Methods for Cercospora coffeicola protoplast isolation and genetic transformation with the green fluorescent protein. Eur J Plant Pathol, 2014, 139 (2): 241–244. DOI:10.1007/s10658-013-0301-9 |
| [20] | Souza AGC, Rodrigues FA, Maffia LA. Infection process of Cercospora coffeicola on coffee leaf. Journal of Phytopathology, 2011, 159 (1): 6–11. DOI:10.1111/jph.2010.159.issue-1 |
| [21] | 任嘉红, 姜楠, 魏玉宏, 等. GFP标记溶磷草木樨中华根菌CHW10B及其定殖. 林业科学, 2015, 52(1): 74–79. |




