油葵是油用向日葵(Helianthus annuus L.)的简称,菊科向日葵属植物,其适应性广,耐干旱、抗盐碱、耐贫瘠,是中国北方重要的油料作物。以油葵种子榨取的葵花油具有丰富的营养价值,富含不饱和脂肪酸,如油酸、亚油酸,其中亚油酸含量高达50%-70%,而且富含维生素E和蛋白质,是一种优质的食用油,同时也是具有广阔开发前景的生物柴油能源植物[1, 2]。基于向日葵重要的经济价值以及遗传转化技术在向日葵中的应用[3-6],各类型的启动子迫切需要应用到油葵的基因工程研究中。
目前用于农作物遗传改良的启动子多属于组成型启动子,如CaMV 35S启动子[7]。由于其为组成型表达,在转基因植物的所有组织和发育时期高表达外源基因,将会增加植物的代谢负担和能量浪费,而且容易对农作物的生长造成不良影响,导致转基因作物的农艺性状较差。种子特异启动子(Seed-specific promoter)可以使外源基因在种子里特异表达,按照人们的意愿调节植物代谢途径,特异性提高种子中特定营养物质的含量,最大限度地减少对农作物其他代谢途径的影响。因此,种子特异启动子的研究对于基因工程的发展和农作物品质改良具有重要意义,也为转基因植物的安全性推广提供了新思路[8, 9]。
晚期胚胎发生丰富蛋白(Late embryogenesis abundant protein,LEA)是植物胚胎发育后期大量积累的一大类蛋白质,一般伴随着种子或胚胎的成熟而形成,在种子萌发时很快消失。除此之外,许多营养组织可以在ABA、水分和低温胁迫等诱导下转录LEA基因[10]。根据氨基酸序列或亲水性,可将LEA蛋白分为6个家族,其中第一组LEA蛋白具有多拷贝串连的20个亲水氨基酸序列,富含高比例的带电荷氨基酸和甘氨酸[11]。Almoguera[12]和Prieto-Dapena等[13]对向日葵(Helianthus annuus L.)种子LEA蛋白基因Ha ds10 G1进行了克隆和表达调控模式研究发现,该基因属于第一组(Group 1)LEA蛋白家族,具有种子特异性表达的特点,尤其在成熟的干种子(dry seed)中大量积累。
烟草是研究植物启动子功能常用的模式植物,具有遗传转化方法成熟,转化效率高,生长周期短,研究背景清楚,易于后续分析等优点。本研究从油葵品种“矮大头”基因组中克隆该基因上游1 417 bp的调控序列,分析其顺式作用元件,并将该片段与GUS报告基因重组,构建报告表达载体,转入烟草中进行功能验证,以期为油葵遗传改良提供可利用的组织特异性启动子奠定基础。
1 材料与方法 1.1 材料植物材料为油葵(Helianthus annuus L.)品种“矮大头”,种植于石河子大学试验场。其籽实含油率高达50%,且抗病耐旱,适应性强;野生型烟草(Nicotiana tabacum)为NC89品种,为本实验室保存。
pBI121质粒为本实验室保存,大肠杆菌Top10,农杆菌GV3101,pUC-T载体,各种限制性内切酶、反转录酶以及实验所用试剂盒均购自TaKaRa生物有限公司,Taq DNA聚合酶购自康为世纪生物科技有限公司(北京),其他试剂均为进口或国产分析纯,实验所用引物均由上海生工生物工程股份有限公司合成。
1.2 方法 1.2.1 油葵基因组DNA的提取以油葵的幼叶为材料提取DNA,采用改良的CTAB法[14]。
1.2.2 Hads10 G1启动子的克隆和序列分析根据Prieto等[13]报道的序列(AJ224116),应用Primer Premier 5.0设计引物扩增Hads10 G1基因的启动子。引物序列为:上游引物(SL73):5'-CCCAAGCTTAGGATACTCGTACACACC-3'(Hind Ⅲ);下游引物(SL80):5'-TGCTCTAGATTTGTTCACTCTTTTAAC-3'(Xba I)。其中划线部分为加入的酶切位点。PCR扩增条件为:94℃预变性3 min;94℃ 1 min,52℃ 1 min,72℃ 1.5 min,35个循环;72℃延伸10 min。
PCR扩增产物经琼脂糖凝胶电泳分离,用DNA凝胶回收试剂盒纯化后连入pUC-T载体,连接产物转化大肠杆菌Top 10感受态细胞,通过菌落PCR筛选、酶切和测序鉴定获得重组质粒,命名为pUC-T-Ha ds10。测序由生工生物工程有限公司完成,并用DNAMAN软件对其进行序列分析。使用在线工具PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子的特征元件。
1.2.3 pBI121-PHa ds10种子特异性表达载体的构建以植物表达载体pBI121为基础,用油葵Ha ds10 G1启动子替换原有的CaMV 35S启动子,与GUS报告基因融合构建获得种子特异性表达载体pBI-PHa ds10。利用Hind Ⅲ、Xba I分别双酶切pUC-T-Ha ds10和pBI121质粒,并分别回收pUC-T-Ha ds10小片段和pBI121大片段,用T4 DNA连接酶连接,转化大肠杆菌Top 10感受态细胞,然后提取质粒DNA,经PCR、酶切和测序鉴定正确后,获得重组种子特异性表达载体pBI-PHa ds10。
1.2.4 农杆菌介导烟草的遗传转化利用冻融法将重组种子特异性表达载体pBI-PHa ds10转化到根癌农杆菌GV3101中,采用农杆菌介导的叶盘法转化烟草NC89品系[15]。用100 mg/L卡那霉素对转化植株进行筛选,转化烟草的筛选培养基为MS附加2.0 mg/L 6-BA、0. 3 mg/L IAA、100 mg/L卡那霉素、400 mg/L利福平、200 mg/L羧苄青霉素;诱导生根培养基为1/2 MS附加100 mg/L卡那霉素、400 mg/L利福平、100 mg/L羧苄青霉素。
1.2.5 转基因烟草的分子鉴定采用天根生化有限公司的植物总DNA提取试剂盒提取烟草叶片基因组DNA。以种子特异性表达载体pBI-PHa ds10为阳性对照,以非转基因烟草为阴性对照,以Ha ds10 G1基因启动子的特异性引物SL73和SL80进行PCR扩增,扩增条件同1.2.2。PCR扩增产物经琼脂糖凝胶电泳检测。
采用天根生化有限公司的植物总RNA提取试剂盒提取烟草种子总RNA。然后将1 μg RNA反转录成cDNA。以cDNA为模板,使用GUS基因特异性引物GUS-F:5'-GCAACTGGACAAGGCACT-3'和GUS-R:5'-GCGTCGCAGAACATTACA-3'进行PCR反应;同时,以烟草β-actin基因为内参,引物序列为:Actin-F:5'-AAGGGATGCGAGGATGGA-3',Actin-R:5'-CAAGGAAATCACCGCTTTGG-3'。扩增条件同上。
1.2.6 GUS活性的组织染色采用组织化学染色法[16]检测GUS基因在转基因烟草各组织中的表达。将待测材料的根、茎、叶和种子分别放入1.5 mL的Eppendorf中,加入GUS染色液(1 mmol/L X-gluc,50 mmol/L磷酸盐缓冲液,0.1% Triton X-100),37℃保温过夜,然后用75%乙醇脱色数小时,种子放在10倍显微镜下观察,并照相记录结果。由于烟草外面有较坚硬的种皮,会影响染色效果,因此我们在染色前先将烟草种子用刀片从中部割开,再置于GUS染液中进行染色。
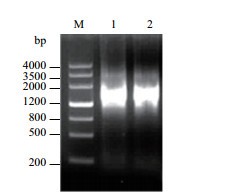
2 结果 2.1 油葵Ha ds10 G1基因启动子的克隆以油葵“矮大头”幼叶的基因组DNA为模板进行PCR扩增,经0.8%琼脂糖凝胶电泳,与DNA分子量标准进行分析(图 1),表明SL73和SL74引物扩增出1条约1.4 kb的条带,与预期大小一致。
|
| 图 1 PCR产物电泳结果 M:DNA Marker Ⅲ;1,2:Ha ds10 G1启动子扩增产物 |
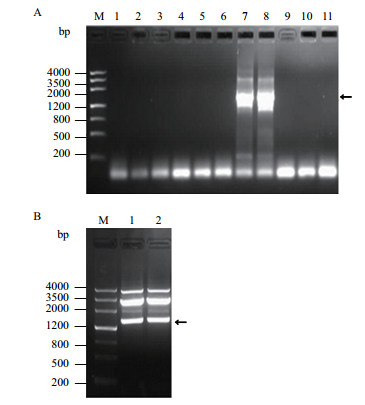
将PCR产物回收后与克隆载体pUC-T连接,获得重组质粒pUC-T-Ha ds10,经菌落PCR鉴定(图 2-A)表明,7、8单菌落能扩增出一条大小约1.4 kb的条带,与目的片段的大小一致,而未转化的菌株没有扩增出该条带。提取7、8号的质粒进行Hind Ⅲ / Xba I双酶切鉴定,结果二者均能切出大小约1.4 kb的目的条带(图 2-B),进一步通过测序证实了序列的正确性,说明pUC-T-Ha ds10载体构建成功。
|
| 图 2 pUC-T-Ha ds10重组子检测结果 A为菌落PCR;M:DNA Marker Ⅲ;1-10:pUC-T-Ha ds10质粒;11:阴性对照。B为Hind Ⅲ/Xba I双酶切,其中1号泳道为7号单菌落的酶切结果,2号泳道为8号单菌落的酶切结果 |
对pUC-T-Ha ds10进行测序,序列分析结果(图 3)表明,该片段长度为1 417 bp,与已报道的Ha ds10 G1启动子序列(AJ 224116)相似性为89.42%。通过PlantCARE在线软件对Ha ds10 G1启动子序列进行元件预测分析,发现Ha ds10 G1启动子除了含有TATA box和CAAT box等保守的启动子元件外,还存在许多与光反应、非生物胁迫相关的顺式作用元件,以及胚乳和种子特异性表达所必须的调控元件Skn-1motif、参与多种植物基因种子特异性调节的RY重复元件(CATGCATG)。(1)光响应元件:I-Box(ACCCTTATCT)、G-Box(CACGTG)、ACE(AAAACGTTTA)、MRE(TTAGGTT)。(2)胁迫应答元件:低温响应元件LTR(TTTCGG),干旱诱导相关元件MBS(TAACTG),胁迫防御元件TC-rich repeats(ATTTTCTTCA)。(3)激素应答元件:脱落酸响应元件ABRE(TTTTTTCC),赤霉素响应元件P-box,生长素响应元件TGA-element、AuxRR-core(GGTCCAT)等。(4)种子特异表达元件:胚乳表达必需的元件Skn-1 motif(GTCAT)、种子特异表达的调控元件RY-repeat element(CATGCATG)。

|
| 图 3 Ha ds10 G1启动子序列分析 |
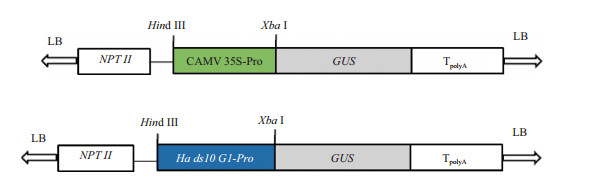
植物表达载体pBI121是含有CaMV 35S启动子和GUS基因的双元载体。为了研究Ha ds10 G1基因启动子的功能,本研究将Ha ds10 G1启动子替换pBI121载体上的CaMV 35S组成型启动子,构建种子特异表达载体pBI-PHa ds10,构建策略见图 4。
|
| 图 4 植物表达载体pBI121与pBI-PHa ds10的T-DNA区域示意图 CaMV35S-pro:CaMV35S启动子;NPT Ⅱ:卡那霉素抗性选择标记基因;TpolyA:polyA终止子;Ha ds10 G1-pro:油葵种子特异启动子;LB:T-DNA左界;RB:T-DNA右界 |
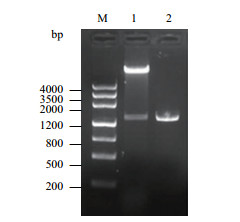
利用限制性内切酶Hind Ⅲ和Xba I分别双酶切pUC-T-Ha ds10和pBI121载体,然后将pUC-T-Hads10小片段和pBI121大片段用T4 DNA连接酶连接,转化大肠杆菌Top10感受态细胞,经PCR和双酶切鉴定,得到1条约1.4 kb的特异性条带(图 5),与预期片段大小一致。进一步通过测序验证了其正确性,表明pBI-PHa ds10载体构建成功。
|
| 图 5 pBI-PHa ds10质粒双酶切鉴定 M:DNA分子量标准;1:Hind Ⅲ和Xba I双酶切;2:Ha ds10 G1启动子 |
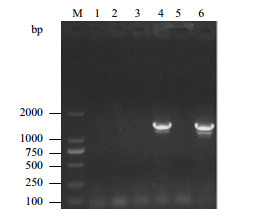
将种子特异性表达载体pBI-PHa ds10通过冻融法转化到根癌农杆菌GV3101中,然后采用农杆菌介导法转化烟草NC89,通过卡那霉素筛选获得阳性转化植株。然后从阳性植株幼叶中提取基因组DNA,用克隆油葵Ha ds10 G1基因启动子的引物SL73和SL80进行PCR检测。结果(图 6)表明,转基因烟草株系4号和6号(泳道4和6)扩增出大小约为1.4 kb的片段,与预计大小相符,而野生型烟草(泳道1)没有扩增出该片段,表明油葵Ha ds10 G1基因启动子已整合入烟草的基因组DNA中。
|
| 图 6 转基因烟草的PCR检测 M:DNA分子量标准DL 2000;1:野生型烟草;2-6:转基因烟草 |
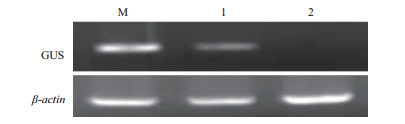
为了确证所克隆启动子的功能,取转基因植株不同部位的组织进行GUS检测,以野生型烟草为对照。结果(图 7)表明,野生型烟草的种子、根、茎和叶片不能被GUS染色,转pBI-PHads10质粒的烟草只有种子能被染成蓝色,而根、茎和叶片不能被GUS染色。为了进一步验证GUS基因在烟草中的表达,分别提取转基因和野生型烟草种子的总RNA,进行半定量RT-PCR。结果(图 8)表明,从转基因烟草中扩增获得预期的目的基因片段,而野生型烟草中未扩增出该片段;同时,在转基因和野生型烟草中均扩增出内标β-actin基因片段。由此可以确认,所克隆获得的启动子为种子特异性表达启动子。

|
| 图 7 阳性转基因植株营养器官和种子的GUS组织化学染色 A,C:野生型烟草的种子和营养器官(根、茎和叶);B,D:转基因烟草的种子和营养器官(根、茎和叶) |
|
| 图 8 转基因烟草种子GUS基因的RT-PCR检测 1,2:转pBI-PHa ds10的烟草RT-PCR产物;3:非转基因烟草 |
植物的种子,尤其是油料作物和粮食作物的种子与人类的生产生活密切相关,因此,以种子作为生物反应器一直是人们研究的热点和重点。种子特异性表达启动子是基因工程研究中必不可少的有利工具。近20年来,随着人们对种子特异启动子的结构、功能的深入研究,发现了一系列种子特异启动子,并且已在芝麻、大豆等农作物的品质改良中得到应用。如在芝麻种子特异性2S清蛋白(2Salb)启动子驱动下,将大豆脂肪酸去饱和酶基因在芝麻种子中特异表达,提高了芝麻种子α-亚麻酸的含量[17]。栽培大豆球蛋白(vicillin)种子特异性启动子驱动紫苏γ-生育酚甲基转移酶基因在印度大豆中表达,促进转基因大豆种子中γ-生育酚转化为α-生育酚,提高了种子中α-生育酚的含量[18]。
油葵是世界上重要的油料作物,同时也是具有广阔开发前景的可再生能源植物,通过基因工程方法调控油葵的代谢路径可以提高其产量、品质和抗病性[3, 5, 6],而种子特异性启动子的开发和应用将有助于实现这些目标。虽然人们已从油菜、大豆等植物中克隆了一些种子特异启动子,并成功应用到油料作物品质改良工作中,但在油葵基因工程研究中使用来源于向日葵自身的种子特异启动子,不仅可以降低同源转基因沉默的风险,而且在某种程度上避免生物安全性带来的问题。因此研究油葵本身的种子特异启动子应用于油葵中具有重要意义。本研究以油葵品种“矮大头”的基因组DNA为模板,应用PCR技术扩增了油葵LEA蛋白家族中的Ha ds10 G1基因起始密码前1 417 bp序列,与已报道的向日葵Ha ds10 G1基因启动子(AJ 224116)序列同源性为89.42%。进一步对Ha ds10 G1基因启动子序列进行分析,结果表明,该序列除含有CAAT box和TATA box等真核生物启动子基本元件外,还存在大量光反应元件,如I-Box、G-Box、ACE、MRE,说明Ha ds10 G1基因的表达受到光的调控。同时该启动子上也存在多个胁迫应答元件,如低温响应元件LTR、干旱诱导相关元件MBS(也是MBY转录因子结合位点),胁迫防御元件TC-rich repeats和激素应答元件(脱落酸响应元件ABRE,赤霉素响应元件P-box,生长素响应元件TGA-element、AuxRR-core等),暗示该基因的表达可能受到多种逆境胁迫和激素的调控。另外,该启动子还含有2个胚乳特异表达必需的顺式调节元件Skn-1 motif和2个RY重复序列(RY repeat)。RY重复序列广泛存在于单子叶和双子叶植物的种子特异性基因启动子中,如1.7S油菜贮藏蛋白(napin)基因启动子[19]和7S大豆贮藏蛋白(β-conglycinin)基因启动子[20]等。RY重复序列常以多拷贝的形式存在,是核蛋白的结合位点,对种子特异性基因的高水平表达十分重要,具有种子特异性时序调控功能[21, 22]。Ha ds10 G1基因启动子中RY重复序列的存在进一步证实了该启动子为种子特异性启动子。
通过对启动子功能进行验证,用Ha ds10 G1启动子替换pBI121中GUS上游的CAMV35S启动子,构建重组表达载体,经农杆菌介导转化烟草获得转基因植株,对其种子和营养器官进行GUS染色。结果表明,Ha ds10 G1启动子序列能驱动GUS基因在烟草种子中特异表达。研究结果不仅为油葵基因调控的理论研究提供新资料,同时也为油葵基因工程提供更有效的启动子和调控元件,对于将向日葵作为生物反应器并在其中表达和储存有价值的营养物质具有较大的应用前景。
4 结论油葵Ha ds10 G1启动子上游1 417 bp片段具有种子特异性表达的特点,可用于植物种子特异表达载体的构建和进一步的遗传转化。
| [1] | 刘公社, 陈中岳. 向日葵生物柴油的开发前景. 中国油料作物学报, 2006, 28(2): 224–227. |
| [2] | Senkoylu N, Dale N. Nutritional evaluation of a high-oil sunflower meal in broiler starter diets. J Appl Poult Res, 2006, 15 : 40–47. DOI:10.1093/japr/15.1.40 |
| [3] | Sujatha A, Vijay S, Vasavi S. Agrobacterium-mediated transfor-mation of cotyledons of mature seeds of multiple genotypes of sunf-lower (Helianthus annuus L.). Plant Cell, Tissue and Organ Culture (PCTOC), 2012, 110 (2): 275–287. DOI:10.1007/s11240-012-0149-2 |
| [4] | Lewi DM, Hopp HE, Escandon AS. Sunflower (Helianthus annuus L.). Methods Mol Biol, 2006, 343 : 291–297. |
| [5] | Skorić D, Jocić S, Sakac Z, et al. Genetic possibilities for altering sunflower oil quality to obtain novel oils. Can J Physiol Pharmacol, 2008, 86 (4): 215–221. DOI:10.1139/Y08-008 |
| [6] | Tishchenko EN, Komisarenko AG, Mikhal'skaia SI, et al. Agrobacterium-mediated sunflower transformation (Helianthus annuus L.) in vitro and in Planta using strain of LBA4404 harboring binary vector pBi2E with dsRNA-suppressor proline dehydrogenase gene. Tsitol Genet, 2014, 48 (4): 19–30. |
| [7] | Covey SN, Lomonossoff GP, Hull R. Characterisation of cauliflower mosaic virus DNA sequences which encode major polyadenylated transcripts. Nucleic Acids Res, 1981, 9 : 6735–6748. DOI:10.1093/nar/9.24.6735 |
| [8] | 李田, 孙景宽, 刘京涛. 植物启动子研究进展. 生物技术通报, 2015, 31(2): 18–25. |
| [9] | Zhao Y, Sha W, Wang QY, et al. Molecular cloning and activity analysis of a seed-specific FAD2-1B gene promoter from Glycine max. Cell Mol Biol, 2015, 61 (4): 85–89. |
| [10] | Hincha DK, Thalhammer A. LEA proteins: IDPs with versatile functions in cellular dehydration tolerance. Biochem Soc Trans, 2012, 40 (5): 1000–1003. DOI:10.1042/BST20120109 |
| [11] | Dure L. A repeating 11-mer amino acid motif and plant desiccation. Plant J, 1993, 3 (3): 363–369. DOI:10.1046/j.1365-313X.1993.t01-19-00999.x |
| [12] | Almoguera C, Jordano J. Developmental and environmental concurrent expression of sunflower dry-seed-stored low-molecular-weight heat-shock protein and Lea mRNAs. Plant Mol Biol, 1992, 19 (5): 781–792. DOI:10.1007/BF00027074 |
| [13] | Prieto-Dapena P, Almoguera C, Rojas A, et al. Seed-specific expression patterns and regulation by ABI3 of an unusual late embryogenesis-abundant gene in sunflower. Plant Mol Biol, 1999, 39 : 615–627. DOI:10.1023/A:1006178220289 |
| [14] | Doyle JJ, Doyle JL. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochem Bull, 1987, 19 : 11–15. |
| [15] | Horsch RB, Fry JE, Hoffman NL. A simple and general method for transferring gene into plant. Science, 1985, 227 (4691): 1229–1231. |
| [16] | Jefferson RA, Kavanagh TA, Bevan MW. GUS fusions: β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J, 1987, 6 (13): 3901–3907. |
| [17] | Bhunia RK, Chakraborty A, Kaur R, et al. Seed-specific increased expression of 2S albumin promoter of sesame qualifies it as a useful genetic tool for fatty acid metabolic engineering and related transgenic intervention in sesame and other oil seed crops. Plant Mol Biol, 2014, 86 : 351–365. DOI:10.1007/s11103-014-0233-6 |
| [18] | Arun M, Subramanyam K, Theboral J, et al. Transfer and targeted overexpression of γ-tocopherol methyltransferase (γ-TMT) gene using seed-specific promoter improves tocopherol composition in Indian soybean cultivars. Appl Biochem Biotechnol, 2014, 172 (4): 1763–1776. DOI:10.1007/s12010-013-0645-9 |
| [19] | Sohrabi M, Zebarjadi A, Najaphy A, et al. Isolation and sequence analysis of napin seed specific promoter from Iranian Rapeseed (Brassica napus L.). Gene, 2015, 563 (2): 160–164. DOI:10.1016/j.gene.2015.03.040 |
| [20] | Yoshino M, Tsutsumi K, Kanazawa A. Profiles of embryonic nuclear protein binding to the proximal promoter region of the soybean β-conglycinin α subunit gene. Plant Biol (Stuttg), 2015, 17 (1): 147–152. DOI:10.1111/plb.12218 |
| [21] | Reidt W, Wohlfarth T, Ellerstrom M, et al. Gene regulation during late embryogenesis: the RY motif of maturation-specific gene promoters is a direct target of the FUS3 gene product. Plant J, 2000, 21 : 401–408. DOI:10.1046/j.1365-313x.2000.00686.x |
| [22] | Nie DM, Ouyang YD, Wang X, et al. Genome-wide analysis of endosperm-specific genes in rice. Gene, 2013, 530 (2): 236–247. DOI:10.1016/j.gene.2013.07.088 |



