核苷(Nucleosid)是一类糖苷胺(Glycosylamine)分子,组成物是核酸碱基加上核糖(Ribose)或脱氧核糖(Deoxyribose),碱基包括嘌呤(Purine)和嘧啶(Pyrimidine)两类,根据碱基的不同又可将核苷分为嘧啶类核苷和嘌呤类核苷两类。嘧啶类核苷主要有胸苷、尿苷和胞苷,嘌呤类核苷主要有腺苷和鸟苷。近几十年来,核苷生物合成代谢调控机制的研究逐渐受到关注,国外学者在核苷产生菌遗传改造方面开展了一些研究。核苷的分泌是一个非常复杂的代谢过程,是高产菌株特有的遗传与生化机制和培养条件共同起作用的结果,受到多个因素的调控,包括细胞分泌系统的调控、细胞膜的通透性、代谢网络的自身调节、代谢分流的限制、膜蛋白的调节及环境因子的动态调节等[1, 2]。近年来,微生物通过跨膜转运分泌代谢物质受到愈来愈多的关注,成为一个重要的研究领域。微生物细胞膜是一类超分子体系,由蛋白质、糖类及脂类等组成,与细胞的能量转换、物质运送、信号的感受与传导等基本生命活动都密切相关,能够控制物质出入细胞进行物质和信息交换[1]。细胞对溶质的选择性吸收和排放主要是通过细胞膜上以膜转运蛋白为基础的运输系统实现的[2]。由于核苷是亲水性的分子,不能直接通过扩散跨越生物膜,主要是通过一些跨膜转运载体来实现细胞膜的跨越,其中,核苷转运蛋白通过介导核苷的转运,具有分泌代谢产物、调节生命以及分泌其他生物大分子等的功能[3, 4]。
本文主要阐述核苷转运蛋白NupC和NupG在微生物细胞内核苷分泌过程中的作用。旨在为提出构建胞苷高产菌株的育种策略,大规模、单一地发酵生产核苷,降低其生产成本,提高发酵生产效率提供参考。
1 核苷转运蛋白的分类和结构由于核苷是亲水性的分子,它们被动扩散跨越生物膜的能力是有限的,不能自由通过细胞膜的脂质双层结构,需要专门的核苷转运蛋白协助核苷来完成细胞膜的跨越[5, 6]。细胞膜上的转运蛋白能够控制细胞内、外物质交流,对细胞的基本生命活动起到关键作用。转运蛋白一般具有多次跨膜的拓扑结构,能够特异性识别转运底物,利用能量驱动逆浓度梯度主动转运。根据跨膜转运蛋白的转运机制在转运过程对底物特异性识别及转运蛋白间的同源性,Paulsen等[7]对细胞跨膜转运蛋白进行了系统分类,归结为两类核苷转运蛋白:一种为扩散型核苷转运蛋白(Equilibrative nucleoside transporter,ENT),另一种是富集型核苷转运蛋白(Concentrative nucleoside transporter,CNT)。扩散型核苷转运蛋白又称为依赖于浓度梯度的核苷转运蛋白,它只能利用浓度梯度将核苷从高浓度一侧转运到低浓度一侧。富集型核苷转运蛋白又称为不依赖于浓度梯度的核苷转运蛋白,它既能将核苷从高浓度的一侧转运到低浓度的一侧,又能利用Na+协同转运提供的动力逆浓度梯度将核苷从低浓度的一侧向高浓度的一侧转运。
对大肠杆菌中2种核苷酸转运蛋白NupG和NupC的拓扑学结构进行了预测研究[8]。虽然这2种蛋白质都是核苷转运蛋白,其功能比较相似,但在细胞内的分布及拓扑学结构明显不同。其研究发现,NupG有12个跨膜螺旋,N端和C端位于胞内一侧,而NupC只有10个跨膜螺旋,N端和C端位于细胞外侧。NupG和NupC除了其拓扑学结构的不同,两种蛋白空间上的折叠方式也有明显的不同[9]。NupG N端的6个螺旋和C端的6个螺旋以同向平行假对称的方式排列,对称轴垂直于膜平面,N端和C端的两个对称部分在细胞内一侧距离很近,所以是以向外开口的构象存在(图 1)。而NupC是以不对称方式排列,并以向内开口的构象存在(图 2)。
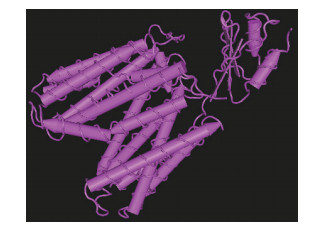
|
| 图 1 NupG结构示意图 |

|
| 图 2 NupC结构示意图 |
Villas-Boas等[10]的研究认为细胞的生长、细胞膜上受体蛋白的嵌入、细胞内外的物质交换以及再循环等细胞生理功能的实现都与细胞分泌活动有关,都涉及膜转运蛋白及其分子机制。张星元[11]、Baranyi等[12]提出了微生物的细胞经济学原理(节约原理、适应原理、生命保障原理),细胞中存在经济性自我响应机制。由此可知,若生产菌株细胞内核苷浓度超过其阈值,必将受到细胞内相关代谢调节机制的干预,胞内核苷的浓度过高,就会对合成核苷的代谢过程施加负反馈调节,促进核苷向胞外空间分泌,迫使其回到正常浓度。因此,无论从化学平衡的角度还是从生物学信息反馈的角度,及时将核苷转移到细胞外,都将有利于载流路径上代谢主流的流动。Chokkathukalam等[13]的研究也表明,细胞能够感受环境的变化,产生应激反应,在面对内外界一些环境因素变化时也会做出相应的代谢变化,要不断地通过细胞内的代谢调控途径来调节代谢水平以达到一种稳态,若这些应激反应失调,就会使细胞代谢发生异变,并排出代谢产物,这可能是导致核苷向胞外分泌的因素之一。
目前对代谢产物分泌机制的报道多见于对氨基酸特别是谷氨酸的研究,对于如何诱导谷氨酸分泌的认识是最清楚的,但是对胞苷分泌过程调控机制方面的研究未见报道。分析谷氨酸棒杆菌谷氨酸分泌的研究成果,对于胞苷分泌机制的研究有重要的借鉴意义。张星元等[14]提出3种氨基酸分泌机制的模型:溢流代谢模型、受限的分解代谢模型和去调节的合成代谢模型;姚辉等[15]也提出3种谷氨酸分泌的假定模式:“泄漏”模式、“载体功能逆转”模式及“特殊载体系统”模式,这3种假定模式是从细胞膜的组成、载体蛋白等方面研究谷氨酸的分泌,而且在细胞壁上存在的孔蛋白能允许亲水溶质透过细胞壁;Eggeling等[16]提出了解释谷氨酸分泌机理的渗漏模型和代谢流改变模型;也有人采用局部麻醉和对细胞壳层施加渗透压的方法来调节膜状态,认为膜应力可能激活谷氨酸的分泌[17]。但是,在每一种模式的输送系统中,并不仅存在一种模型,几种模型往往同时存在。这些研究结果在研究微生物的核苷分泌机制中具有重要参考价值,依据氨基酸及谷氨酸的分泌机理推测,在微生物中核苷的分泌过程可能也有类似的模式及分泌机制。
3 转运蛋白NupC对核苷分泌的作用NupC属于易化扩散性核苷转运蛋白(ENT),通过介导核苷由胞内向胞外分泌,该转运蛋白是根据电化学势梯度驱动的单向跨膜转运,将核苷由高浓度一侧转运到低浓度一侧[18]。同时,NupC能够在向外开口的状态和向内开口的状态间发生异构变化,引发核苷的结合位点交替开口向细胞膜的两侧,从而将核苷分泌到细胞外。而NupC的C端和N端均位于大肠杆菌的细胞外侧,组氨酸含正电荷侧链,引入多聚组氨酸亲和标签会影响NupC的表达。NupC转运蛋白对核苷的分泌机制可能与核苷内分子的磷酸化、去磷酸化有关。Zhu等[19]由非特异性5-磷酸酶催化,抑制其转运核苷的内在活性,细胞内的CMP和UMP可以去磷酸化形成胞嘧啶和尿嘧啶。胞嘧啶核苷脱氨酶(cdd基因编码)作用于胞嘧啶核苷可以进一步脱去氨基形成尿苷[20]。在dra-nupC-pdp操纵子中,pdp基因编码嘧啶核苷磷酸化酶催化降解的尿苷形成尿嘧啶并分泌到细胞外[21]。最初研究大肠杆菌,证明NupC可作为核苷转运蛋白,利用H+协同转运提供动力转运腺苷和胞嘧啶核苷[22]。类似大肠杆菌的还有金黄色葡萄球菌、幽门螺旋杆菌、枯草芽孢杆菌等,以NupC作为能量来源或核苷酸从头合成的核苷转运蛋白[23]。
4 转运蛋白NupG对核苷分泌的作用NupG属于主动扩散载体超家族(major facilita-tor superfamily,MFS)。Munch-Petersen等[24]研究发现,通过NupG染色体突变证明已被克隆在质粒载体的DNA片段能够诱导合成NupG核苷转运蛋白。转运蛋白NupG需要有相应的结合位点与之结合才能对核苷的分泌起到作用。有研究表明,核苷转运蛋白NupG与所需的羟基基团结合,必须存在C-3' 和C-5' 核糖位置。更重要的是用于结合核糖部分NupG核苷转运蛋白和低聚糖之间的进化关系是一致的[25]。可以用20世纪60年代提出的交替开放模型(alternating access model)[26]来解释其对核苷分泌的机制。转运蛋白NupG首先在膜的一侧暴露其与底物的结合位点,底物分子在与蛋白结合的同时可以诱导蛋白的构象发生较大变化,使蛋白的开口由向胞外开放变成向细胞另外一侧开放,进一步引起对核苷物质的分泌,从而完成整个转运的过程[27];当底物结合时可以引起盐桥弱化,使底物结合产生的能量驱动蛋白的构象变化[28]。
5 转运蛋白的修饰改造对于核苷合成的影响通过改造核苷酸转运系统的代谢工程对于核苷类物质的合成具有重要作用,可以通过过表达编码核苷转运蛋白NupC和NupG来提高转运效率。NupG作为大肠杆菌核苷酸转运蛋白,属于主动扩散载体超家族,其N端位置位于胞质一侧,在构建重组NupG时,不需要考虑引入和包含信号序列[29],类似的蛋白质还有LacY和GlpF[30, 31]。NupG转运蛋白其C端位于胞质一侧,可以在该位置引入多聚组氨酸亲和标签,符合正电荷氨基酸向内原则,重组构建NupG其表达不受影响[29]。
对于生产菌株来说,赵伟睿等[32]认为控制细胞膜通透性的方法有控制磷脂的合成、控制细胞壁的合成等。在微生物中,通过改变细胞膜渗透性对代谢控制具有非常重要的作用[33]。微生物自身存在着许多种负责物质跨膜运输的特异和非特异转运蛋白,因此加强这些通道蛋白的表达就有可能降低细胞对底物和产物的传质阻力。这对于解决发酵过程中由于产物不能及时排出而造成的产物抑制效应是一个极其有效的方法。因此,可通过基因敲除和过量表达实验,验证这些基因在核苷生产菌株中的功能,将为核苷生产菌的设计与核苷分泌机制的研究提供更有价值的理论依据。
6 可能存在的其他核苷分泌机制在微生物细胞内核苷分泌过程中,除了转运蛋白NupC和NupG之外,还有一些转运蛋白也起到了重要的作用。大多数已知功能的NAT家族的蛋白都与核酸(包括嘌呤和嘧啶)特异性的转运有关。根据序列比较,有研究对NAT家族提出利用质子或钠离子共转运底物的分子机理。自2007年开始颜宁教授等对NAT家族蛋白进行研究,首先利用现代结构生物学的方法对这一家族代表性成员大肠杆菌尿嘧啶-质子共转运蛋白(Uracil:proton Symporter)UraA进行研究,终于在2010年4月首次获得了UraA与底物尿嘧啶高分辨率三维精细结构,其分辨率高达2.8Å,研究表明,蛋白底物尿嘧啶在跨膜转运的过程中首先被准确地定位在两个结构域之间,进而通过门控结构域和核心结构域之间的构像变化完成整个转运过程,其中胞嘧啶(cytosine)分子的运输也是通过协同运输的蛋白CodB完成的[31],经过脱氨基作用,又进一步被尿嘧啶磷酸核糖基转移酶(UPRTase)修饰,从而被细胞利用。UraA不但对尿嘧啶转运功能,对尿嘧啶的衍生物5-氟尿嘧啶也能够特异性转运。这为解释5-氟尿嘧啶作为抗癌的化疗药物如何进入细胞提供了良好的分子机理[34]。另外,还存在一些膜转运蛋白,如在大肠杆菌中发现的乳糖转运蛋白LacY以及大肠杆菌甘油-3-磷酸转运蛋白GlpT,大肠杆菌蛋白NhaA在对Na+、H+反向转运的机制研究也有类似的结果。Mohanty等[35]通过对位于胞质侧的肠杆菌水通道N端和C端的研究表明,虽然其N端或C端分别含有6-10个组氨酸的重组AqpZ蛋白,但不会受多聚组氨酸的长度和位置对表达产生影响。Sheremet等[36]在对解淀粉芽胞杆菌AJ1991中研究发现,途径末端代谢物存在强烈的酶水平反馈抑制作用,过表达编码核苷酸转运蛋白的pbuE基因,肌苷产量较AJ1991提高100%,达到6 g/L,而过表达来自大肠杆菌的编码核苷酸转运蛋白的nepl基因,肌苷产量可以提高190%。
7 结语随着膜蛋白和代谢组学等研究技术的日益发展,核苷代谢调控机制受到了广泛的关注,核苷转运蛋白通过介导核苷跨膜转运起到了关键作用,而不同的核苷转运蛋白有各自的底物转运特点和选择性。目前已经发现许多已知功能转运蛋白家族都与核酸(包括嘌呤和嘧啶)特异性的转运有关,但是关于转运蛋白的转运机理仍知之甚少,如底物识别与结合机制、水解机制、跨膜方式等。本文结合核苷分泌机理的理论研究,对核苷转运蛋白NupC和NupG结构及分泌机制进行分析,阐述了它们对核苷分泌的作用,提出了通过修饰改造NupC和NupG来提高转运效率的策略,为大规模、单一地发酵生产核苷,降低其生产成本,提高发酵生产效率提供参考。由于转运蛋白的研究越来越深入,这些转运蛋白的功能将需要利用更多先进的实验技术手段并可能利用分子动力学模拟(molecular dynamics simulation)等方法对核苷转运蛋白的转运机理从分子水平上得以全面诠释。
| [1] | 刘永康, 陈国民. 细胞膜对大分子物质及颗粒物质的跨膜转运. 现代医药卫生, 2006(5): 674–675. |
| [2] | 马蓉, 张立军, 丁锐, 等. 大肠杆菌氨基酸转运蛋白的研究进展. 科技通报, 2012, 3: 49–56, 99. |
| [3] | 王晶敏. 核苷转运蛋白在细胞水平跨膜转运作用的研究进展. 国外医学·药学分册, 2003, 1: 17–22. |
| [4] | 李剑, 李光永, 王道文. 核苷转运蛋白的研究进展. 科学通报, 2002, 7: 481–484. |
| [5] | Martinussen J, Willemoës M, Kilstrup M. Nucleotide metabolism[M]. Second Edition. Comprehensive Biotechnology: 2011: 91-107. |
| [6] | Charles L, Turnbough Jr, Robert L, et al. Regulation of pyrimidine biosynthetic gene expression in bacteria: repress ion without repressors. Microbiology and Molecular Biology Reviews, 2008, 72 (2): 266–300. DOI:10.1128/MMBR.00001-08 |
| [7] | Paulsen IT, Sliwinski MK, Saier MH. Microbial genome analyses: Global comparisons of transport capabilities based on phylogenies, bioenergetics and substrate specificities. J Mol Biol, 1998, 277 : 573–592. DOI:10.1006/jmbi.1998.1609 |
| [8] | http//bioweb.pasteur.fr/seqanal/interfaces/toppred.html |
| [9] | Madej T, Lanczycki CJ, Zhang D, et al. MMDB and VAST+: tracking structural similarities between macromolecular complexes. Nucleic Acids Res, 2014, 42 (Database issue): D297–303. |
| [10] | Villas-Boas S, Han TL, Liu T, et al. What is the relationship between intracellular and extracellular metabolites? The theory of "metabolic overflow" put into test. New Biotechnology, 2014, 31 : S28–S29. |
| [11] | 张星元. 发酵原理[M]. 北京: 科学出版社, 2011. |
| [12] | Baranyi J, Metris A, George SM. Bacterial economics: Adaptation to stress conditions via stage-wise changes in the response mechanism. Food Microbiology, 2015, 45 : 162–166. DOI:10.1016/j.fm.2014.05.023 |
| [13] | Chokkathukalam A, Kim DH, Barrett MP, et al. Stable isotope-labeling studies in metabolomics: new insights into structure and dynamics of metabolic networks. Bioanalysis, 2014, 6 (4): 511–524. DOI:10.4155/bio.13.348 |
| [14] | 张星元, 李秀敏, 杨毅, 等. 谷氨酸棒杆菌的氨基酸输送系统的存在、功能及其在氨基酸生产上的重要性. 无锡轻工大学学报, 2004, 23(3): 105–110. |
| [15] | 姚辉, 张建华, 毛忠贵. 谷氨酸棒状杆菌的谷氨酸分泌模式初探. 食品与发酵工业, 2013, 39(5): 54–58. |
| [16] | Eggeling L, Krumbach K, Shahm H. L-Glutamate efflux with Corynebacterium glutamicum: why is penicillin treatment or Tween addition doing the same. J Mol Microbiol Biotechnol, 2001, 3 (1): 67–68. |
| [17] | Puech V, Chami M, Lemassu A, et al. Structure of the cell envelope of corynebacteria: importance of the non-covalently bound lipids in the formation of the cell wall permeability barrier and fracture plane. Microbioloy, 2001, 147 : 1365–1382. |
| [18] | Ramadan A, Naydenova Z, Stevanovic K, et al. The adenosine transport ENT1 in cardiomyocytes is sensitive to inhibition by ethanol in akinase-dependent manner: implications for ethanol-dependent cardioprotection and nucleoside analog drug cytotoxicity. Purinergic Signalling, 2014, 10 (2): 305–312. DOI:10.1007/s11302-013-9391-2 |
| [19] | Zhu H, Yang SM, Yuan ZM, et al. Metabolic and genetic factors affecting the productivity of pyrimidine nucleoside in Bacillus subtilis. Microbial Cell Factories, 2015, 14 : 54. DOI:10.1186/s12934-015-0237-1 |
| [20] | Song BH, Jan N. Chromosomal location, cloning and nucleotide sequence of the Bacillus subtiliscdd gene encoding cytidine/deoxycytidine deaminase. Mol Gen Genet, 1989 (216): 462–468. |
| [21] | Saxild HH, Andersen LN, Hammer K. Dra-nupC-pdp operon of Bacillus subtilis: nucleotide sequence, induction by deoxyribonucleosides, and transcriptional regulation by the deoR-encoded DeoR repressor protein. J Bacteriol, 1996, 178 : 424–434. DOI:10.1128/jb.178.2.424-434.1996 |
| [22] | Henderson PJ, Herbert RB. The nucleoside transport proteins, NupC and NupG, from Escherichia coli: specific structural motifs necessary for the binding of ligands. Org Biomol Chem, 2005, 3 : 462–470. DOI:10.1039/b414739a |
| [23] | Karatza P, Frillingos S. Cloning and functional characterization of two bacterial members of the NAT/NCS2 family in Escherichia coli. Mol Membr Biol, 2005, 22 (3): 251–261. DOI:10.1080/09687860500092927 |
| [24] | Munch-Petersen A, Jensen N, et al. Cloning and expression of genes encoding the nupG nucleoside transport system in Escherichia coli. The Cell Membran, 1984, 411 (2): 85–99. |
| [25] | Zhu H, Yang SM, Yuana ZM, et al. Metabolic and genetic factors affecting the productivity of pyrimidine nucleoside in Bacillus subtilis. Microbial Cell Factories, 2015, 14 (54): 2–12. |
| [26] | Jardetzky O. Simple allosteric model for membrane pumps. Nature, 1966, 211 : 969–970. DOI:10.1038/211969a0 |
| [27] | Mitchell P. A general theory of membrane transport from studies of bacteria. Nature, 1957, 180 (4577): 134–136. DOI:10.1038/180134a0 |
| [28] | Smirnova I, Kasho V, Choe JY, et al. Sugar binding induces an outward facing conformation of LacY. Proc Natl Acad Sci USA, 2007, 104 : 16504–16509. DOI:10.1073/pnas.0708258104 |
| [29] | Monné M, Chan KW, Slotboom DJ, et al. Functional expression of eukaryotic membrane proteins in Lactococcus lactis. Protein Sci, 2005, 14 (12): 3048–3056. DOI:10.1110/ps.051689905 |
| [30] | Abramson J, Smirnova I, Kasho V, et al. Structure and mechanism of the lactose permease of Escherichia coli. Science, 2003, 301 (5633): 610–615. DOI:10.1126/science.1088196 |
| [31] | Huang Y, Lemieux MJ, Song JM. Structure and mechanism of theglycerol-3-phosphate transporter from Escherichia coli. Science, 2003, 301 (5633): 616–620. DOI:10.1126/science.1087619 |
| [32] | 赵伟睿, 胡升, 黄俊, 等. 微生物细胞通透性改善方法与策略. 中国生物工程杂志, 2014, 34(3): 125–131. |
| [33] | Yamada S, Awano N, Inubushi K, et al. Effect of drug transporter genes on cysteine export and overproduction in Escherichia coli. Applied and Environmental Microbiology, 2006, 72 (7): 4735–4742. DOI:10.1128/AEM.02507-05 |
| [34] | Kuhn JG. Fluorouracil and the new oral fluorinated pyrimidines. Ann Pharmacother, 2001, 35 (2): 217–227. DOI:10.1345/aph.10096 |
| [35] | Mohanty AK, Wiener MC. Membrane protein expression andproduction: effects of polyhistidine tag length and position. Protein Expr Purif, 2004, 33 (2): 311–325. DOI:10.1016/j.pep.2003.10.010 |
| [36] | Sheremet AS, Gronskiy SV, Akhmadyshin RA, et al. Enhancement of extrancellular purine nucleoside accumulation by Bacillus strains through genetic modifications of genes involved in nucleoside export. Jlnd Microbiol Biotechnol, 2011, 38 (1): 65–70. DOI:10.1007/s10295-010-0829-z |




