产生抗冻蛋白(Antifreeze protein,AFP)是许多昆虫应对低温胁迫的方式之一,抗冻蛋白依靠吸附抑制理论吸附在冰晶表面,通过降低溶液的非平衡结冰温度(Non-equilibrium freezing point),从而在溶液降温过程中阻滞冰晶生长,其与溶液熔点(Melting point)间的差值称为热滞值(Thermal Hysteresis Activity,THA)[1, 2]。AFP的THA随其结构和浓度进行变化,THA常用于比较不同类型AFP的抗冻活性及评价AFP对于冰晶生长的抑制作用。
AFP结构中的冰晶结合位点对于其发挥抗冻活性具有重要作用,通过该位点上规则排列的一些特定氨基酸与冰晶晶格中的水分子进行相互匹配[3, 4],通过疏水作用力与冰晶晶体面结合。大多数昆虫AFP具有相似的β-螺旋结构[5],在其结构的单个平面中包含由4-7个冰晶结合域(Ice binding domains,IBD)组成的冰晶结合位点(Ice binding site,IBS),而在每个冰晶结合域中都包含由苏氨酸组成的TXT基序,这些基序在一个面上的累积形成AFP的IBS[6]。通过对松皮天牛Rhagium mordax AFP的TXT基序进行点突变实验表明,将TXT基序中非规则的氨基酸替换为苏氨酸后,在低浓度下THA增强了2倍[7],而非TXT基序位点的突变对于RmAFP热滞活性没有显著影响。通过计算机模拟AFP与水分子在低温下的相互作用,TXT基序经过负向突变后,在冰晶生长过程中,突变体蛋白不能稳定的结合在其表面[8, 9]以抑制冰晶生长。
目前已有研究表明,增加AFP结构中的规则重复序列可以成倍地提高其THA活性[9-11],然而AFP的THA并没有随着重复序列的不断增加而提高,虽然在一定程度上增加了蛋白与冰晶的结合面,然而当重复序列数超过一定值后会出现热滞活性下降的情况[11]。因此昆虫AFP重复序列与THA的关系,还有待于进一步研究。
本研究以光滑鳖甲ApAFP-914为蓝本,采用DNA合成法,对ApAFP-914基因进行序列改造,在其中增加一个规则重复序列的基因片段,使得蛋白结构中的重复序列数达到8个,并将人工改造后的ApAFP-C914亚克隆构建至原核表达载体pET-32a上,与pET32a-ApAFP-914同步进行诱导表达,纯化获得融合蛋白Trx-ApAFP-914及Trx-ApAFP-C914,用差示扫描量热法(Differential scanning calorimetry,DSC)测定其热滞活性[12, 13],并比较两种蛋白在不同浓度下的热滞活性,以探索增加规则重复序列对ApAFP-914热滞活性的影响。
1 材料与方法 1.1 材料质粒pET32a-ApAFP-914为本实验室保存,人工改造基因ApAFP-C914由上海捷瑞(GENEray)公司合成,质粒提取试剂盒购自上海生工(Sheng gong),SDS-PAGE试剂盒购自北京赛驰(Cell chip),Ni+纯化柱料购自Qiagen公司,感受态细胞BL21(DE3)及DH5α为北京全式金(Trans gene)公司产品,蛋白纯化柱购自Bio-Rad公司,透析袋、超滤膜、超滤管等购自美国Millipore公司,其余试剂为国产分析纯。
1.2 方法 1.2.1 pET32a-ApAFP-C914原核表达载体的构建以合成的pET28a-ApAFP-C914为模板,用上游引物:5' -CGCGGATCCGAGTATTATTGTCAAACATGC-3' (BamH Ⅰ)及下游引物:5' -CCGCTCGAGTTATGGACATCCTGTTGAACGAGT-3' (Xho Ⅰ)进行PCR扩增,产物经双酶切,用DNA连接酶于16℃过夜连接至pET32a载体上。将连接产物转化大肠杆菌菌株DH5α进行质粒扩增,重组载体经BamH Ⅰ和Xho Ⅰ酶切鉴定后,送予上海生工测序。
1.2.2 TrxA-ApAFP-914和TrxA-ApAFP-C914的表达及SDS-PAGE检测将测序正确的pET32a-ApAFP-C914及pET32a-ApAFP-914转入大肠杆菌菌株BL21(DE3),将含重组质粒的单菌落于37℃培养过夜,以1%比例接种,37℃培养4-5 h,当菌液的吸光度(OD600)值达到0.6时,取1 mL未诱导菌液,加入IPTG至终浓度0.5 mmol/L,于37℃诱导4 h,将诱导前及诱导后的菌液进行SDS-PAGE电泳检测。
1.2.3 TrxA-ApAFP-914和TrxA-ApAFP-C914的纯化及Western bolt鉴定蛋白经IPTG诱导后,菌体6 000 r/min离心10 min,用7 mL Ni2+-NTA His结合缓冲液(50 mmol/L NaCl,20 mmol/L Tris-HCl,10 mmol/L Imidazole,pH7.9)充分悬浮,经超声破碎后12 000 r/min离心10 min取上清,过0.22 mm滤器至蛋白纯化柱,4℃下结合3-4 h,而后用10-70 mmol/L咪唑的洗杂缓冲液(500 mmol/L NaCl,20 mmol/L Tris-HCl,pH8.0)进行梯度洗杂,及含200 mmol/L和250 mmol/L咪唑洗脱缓冲液对目的蛋白进行洗脱。将洗脱得到的蛋白于4℃下于1×PBS(pH7.4)溶液中进行充分透析,经超滤浓缩后用Bradford法测定蛋白含量并4℃下保存。参考蛋白Western bolt鉴定方法[14]:将已表达的TrxA-ApAFP-914及TrxA-ApAFP-C914经SDS-PAGE电泳分离并转移至NC膜上,5%脱脂奶粉于4℃过夜封闭,加入1:3 000稀释的鼠抗His(室温反应1.5 h、PBST洗涤3次)及1:5 000羊抗鼠IgG(室温反应1 h、PBST洗涤3次),DAB避光显色并拍照。
1.2.4 TrxA-ApAFP-914及TrxA-ApAFP-C914热滞活性测定参考DSC测定蛋白样品的方法[12]并稍加修改,采用差式扫描量热仪DSC2000(TA Instruments,USA)对样品进行THA测定,对照为TrxA蛋白。将融合蛋白TrxA-ApAFP-914及TrxA-ApAFP-C914溶于1×PBS,实验前准确称取参比盘、样品盘及样品质量,据此设定实验参数。测定流程:将仪器温度设定至4℃平衡3 min,以保证测定样品时热流基线稳定,以3℃/min从4℃降至-30℃,使得待测样品溶液进行过冷却(Super cooling),-30℃保持3 min,再以3℃/min从-30℃升温至10℃保持3 min,依据溶液的溶解温度(Tm)设定样品的保持温度(Th)并保持5 min,以3℃/min降至-30℃,根据THA的定义计算Th与溶液冰晶爆炸生长温度(To)间的差值(THA=Th-To)。在降温过程中,溶液中冰晶比例[Nuclei(%)=[1-(-△Hr/△Hm)]×100%,△Hm及△Hr分别是溶液的溶解焓和重结晶时的放热焓]会影响AFP的THA[12, 15],设定程序在不同保持温度之间循环,测定不同晶核比例下的THA活性。
2 结果 2.1 pET32a-ApAFP-C914载体构建ApAFP-914结构中具有7个包含TXT基序的重复序列,在分析ApAFP-914蛋白结构后,选取其中一段规则重复序列插入于第3-第4个重复序列之间(表 1),以构成具有8个重复序列的ApAFP-C914。
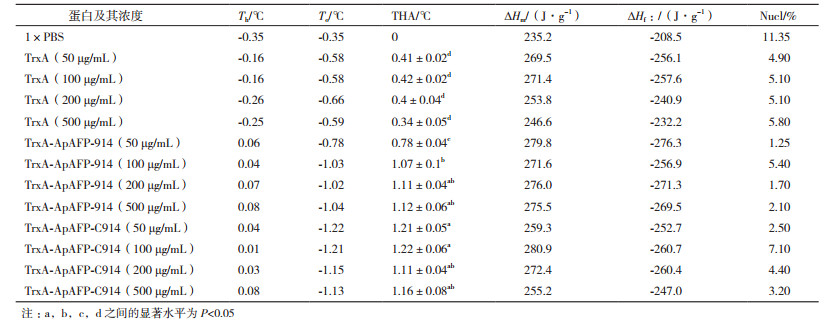
将ApAFP-C914亚克隆至pET32a载体上,提取6个单克隆的质粒经BamH Ⅰ及Xho Ⅰ酶切得到了大小为312 bp的目的片段(图 1),与预期合成的ApAFP-C914基因大小一致。

|
| 图 1 pET32a-ApAFP-C914双酶切鉴定 1-6:6个单克隆所提质粒经BamH Ⅰ及XhoⅠ双酶切;M:标准2000核酸分子量 |
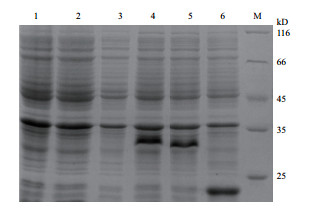
融合蛋白TrxA-ApAFP-C914、TrxA-ApAFP-914条带经SDS-PAGE电泳检测,结果(图 2)显示,TrxA-ApAFP-C914、TrxA-ApAFP-914、TrxA大小分别为34 kD、33 kD和23 kD。
|
| 图 2 TrxA-ApAFP-C914、TrxA-ApAFP-914及标签TrxA的SDS-PAGE检测 1:pET32a-ApAFP-C914/BL21经0.5 mmol/L IPTG诱导前;2:pET32a-ApA-FP-914/BL21经0.5 mmol/L IPTG诱导前;3:pET32a/BL21经0.5 mmol/L IPTG诱导前;4:pET32a-ApAFP-C914/BL21经0.5 mmol/L IPTG诱导后;5:pET-32a-ApAFP-914/BL21经0.5 mmol/L IPTG诱导后;6:pET32a/BL21经0.5 mmol/L IPTG诱导后;M:蛋白标准分子量 |
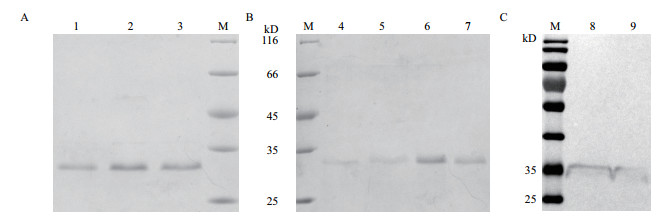
TrxA-ApAFP-C914及TrxA-ApAFP-914经诱导后进行蛋白纯化,TrxA-ApAFP-C914及TrxA-ApAFP-914用含有10-70 mmol/L咪唑进行梯度洗杂,洗至60 mmol/L及70 mmol/L咪唑时杂蛋白已彻底去除(图 3),200 mmol/L及250 mmol/L下洗脱出单一的目的条带。Western bolt结果表明,TrxA-ApAFP-C914及TrxA-ApAFP-914蛋白大小相近,位于35 kD左右,与预期蛋白分子量相符。
|
| 图 3 TrxA-ApAFP-914(A)和TrxA-ApAFP-C914(B)的蛋白纯化及Western bolt(C)鉴定 M:蛋白标准分子量;1-4:分别为60、70、200及250 mmol/L咪唑洗脱后的TrxA-ApAFP-C914;5-7:分别为70、200及250 mmol/L咪唑洗脱后的TrxA-ApAFP-914条带;8:纯化后的TrxA-ApAFP-C914;9:纯化后的TrxA-ApAFP-914 |
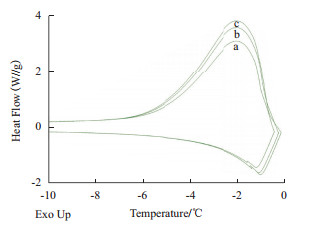
TrxA不具有AFP结构中独特的冰晶结合域(IBD),理论上不能与冰晶表面结合并抑制冰晶生长。TrxA在50 μg/mL浓度下,随着设定温度的不断升高,溶液中的冰核率逐渐降低(表 2),测得的THA分别为0、0.01及0.42℃,并且略微改变了溶液冰晶生长过程中的放热焓曲线(图 4)。
|
| 图 4 TrxA(50 μg/mL)不同晶核率下DSC曲线 当Th逐渐向Tm=0.9℃移动,曲线a-c随着Th从-0.44、-0.27至-0.16℃的不断改变,THA分别为0、0.01及0.42℃ |
AFP结合在冰晶的基本面和棱柱面上阻止水分子结合在冰晶的表面[6, 16]抑制冰晶的进一步生长,当温度降至某一临界点时,AFP不能继续阻止冰晶从而产生爆炸性生长。TrxA-ApAFP-C914在50 μg/mL浓度下随着Th向溶液Tm逐渐移动,溶液的冰核比例逐渐降低,TrxA-ApAFP-C914的THA活性从0.92℃提高至1.26℃(表 3),在DSC测定的热流峰曲线表征为:随着温度降低溶液的起始结冰过程产生一个延滞(图 5),而后当达到某一临界点时冰晶进行爆炸生长并释放大量的热(表 3)。

|
| 图 5 TrxA-ApAFP-C914(50 μg/mL)在不同停滞温度下的DSC曲线 停滞温度Th逐渐向Tm=1.6℃移动,曲线a-d随着Th从-0.18、-0.08、0.04至0.04℃的不断改变,THA分别为0.92、0.96、1.28及1.26℃ |
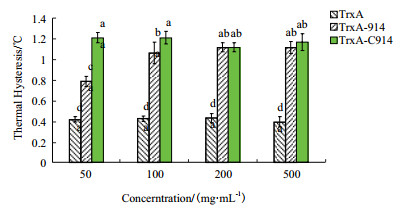
溶液中的冰晶晶核比例会影响AFP的THA,因此采用最低晶核率下的THA进行相互比较。TrxA-ApAFP-914与多数AFP一样,THA活性具有浓度依赖性:即随着蛋白浓度增加,THA也在逐步提高。作为对照的TrxA不具有THA(表 4),TrxA-ApAFP-914随着浓度提高其THA活性从0.84℃提高至1.12℃,而TrxA-ApAFP-C914的THA则没有随着蛋白浓度的提升而改变,且一直稳定在一个较高的水平(1.1-1.2℃)。TrxA-ApAFP-C914在50 μg/mL浓度下THA(1.21±0.056℃)显著高于同浓度下TrxA-ApAFP-914(0.78±0.04℃),然而随着浓度逐渐提高,差异不显著(图 6)。
|
| 图 6 不同浓度下TrxA、TrxA-ApAFP-C914及TrxAApAFP-914的THA分析 在50 μg/mL时TrxA-ApAFP-C914与TrxA-ApAFP-914的THA具有极显著差异(P < 0.01),100 μg/mL时具有显著差异(P < 0.05),而在200及500 μg/mL时不具有显著差异(每组测3个重复)。不同小写字母之间表示差异显著(P < 0.05) |
在低温保存中,冰晶的形成和生长会导致细胞组织结构发生破坏和功能性损伤。昆虫AFP具有较高的THA,其与冰晶结合面广[7]具有较高的亲和性,因此在食品药品及动物组织细胞的低温储存中可发挥重要作用,研究其蛋白结构和功能有助于解释昆虫AFP的低温抗冻机制及其潜在开发与应用。
AFP结合在冰晶的基本面和棱柱面上阻止水分子结合在冰晶的表面[6, 16],抑制冰晶的进一步生长,TrxA对冰晶生长的热流曲线有影响,却没有明显的抑制作用,因此不具有热滞活性。AFP的冰晶结合面大小随着IBDs改变而改变,TrxA-ApAFP-914增加单个规则重复序列后,改变了TrxA-ApAFP-914的IBS大小,从而提高其THA。云杉卷叶蛾CfAFP501相较于CfAFP337多增加的两个重复序列结构,使得CfAFP的IBS提高了34%,显著提高CfAFP的THA[10]。ApAFP-914与黄粉虫TmAFP具有类似结构,TmAFP的多重复序列构建实验显示,增加单个重复序列的TmAFP在0-0.1 mmol/L时THA活性有显著提高,并且通过NMR对蛋白结构分析表明IBDs位于同一面上[11],同样地,松皮天牛RmAFP增加单个重复序列后在0-0.1 mmol/L浓度范围内THA活性也有显著提高[8]。
TrxA-ApAFP-914增加单个规则重复序列后,在50 μg/mL和100 μg/mL下THA有显著提高,然而随着蛋白浓度的提升,逐渐降低了THA之间的差异。TrxA-ApAFP-C914的THA活性在50-500 μg/mL范围内不具有浓度依赖性,原因可能为:在此浓度范围内到达了其活性的平台期,RmAFP和TmAFP在增加单个规则重复序列后,导致蛋白THA更快的进入平台期,即随着蛋白浓度的增加,THA活性保持不变[8, 11]。因而,本研究中融合蛋白热滞活性在达到1.1-1.2之间不再变化,与文献中所报道的规律相一致。
影响AFP与冰晶结合的因素包括:抗冻蛋白结构与冰晶晶体的结合面[6, 16, 18]、AFP浓度,无机盐等小分子物质对于AFP和冰晶分子形成及生长的作用[18, 19]、冰晶生长速率及冰晶生长形成时的机理和过程[16, 20]。虽然增加重复序列提高了ApAFP-914的THA,然而ApAFP-914结构中重复序列的增加是否改变了蛋白与冰晶晶体面的结合作用及结合速率等因素,有待进一步研究。
4 结论本研究构建了增加一个规则重复序列的ApAFP-C914并将其进行原核表达和纯化,获得具有THA活性的TrxA-ApAFP-C914,将TrxA-ApAFP-C914、TrxA-ApAFP-914及TrxA蛋白进行THA活性测定和比较,结果表明增加单个重复序列,在低浓度下能够显著提高ApAFP-914的热滞活性。
| [1] | Devries AL. Antifreeze glycopeptides and peptides:interactions with ice and water. Methods in Enzymology, 1986, 127 (127): 293–303. |
| [2] | Duman JG, Wu DW, Olsen TM, et al. Thermal hysteresis proteins. Adv Low Temp Biol, 1993, 2 : 131–182. |
| [3] | Bang JK, Lee JH, Murugan RN, et al. Antifreeze peptides and glycopeptides, and their derivatives:potential uses in biotechnology. Marine Drugs, 2013, 11 (6): 2013–2041. DOI:10.3390/md11062013 |
| [4] | Davies PL. Ice-binding proteins:a remarkable diversity of structures for stopping and starting ice growth. Trends in Biochemical Sciences, 2014, 39 (11): 548–555. DOI:10.1016/j.tibs.2014.09.005 |
| [5] | Graether SP, Kulper MJ, Gagné SM, et al. β-Helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect. Nature, 2000, 406 (6793): 325–328. DOI:10.1038/35018610 |
| [6] | Olijve LL, Meister K, DeVries AL, et al. Blocking rapid ice crystal growth through nonbasal plane adsorption of antifreeze proteins. Proceedings of the National Academy of Sciences, 2016, 113 (14): 3740–3745. DOI:10.1073/pnas.1524109113 |
| [7] | Graether SP, Sykes BD. Cold survival in freeze-intolerant insects:the structure and function of beta-helical antifreeze proteins. European Journal of Biochemistry, 2004, 271 (16): 3285–3296. DOI:10.1111/ejb.2004.271.issue-16 |
| [8] | Friis DS, Kristiansen E, Solms NV, et al. Antifreeze activity enhancement by site directed mutagenesis on an antifreeze protein from the beetle Rhagium mordax. Febs Letters, 2014, 588 (9): 1767–1772. DOI:10.1016/j.febslet.2014.03.032 |
| [9] | Kuiper MJ, Morton CJ, Abraham SE, et al. The biological function of an insect antifreeze protein simulated by molecular dynamics. Elife Sciences, 2015, 4 . DOI:10.7554/eLife.05142 |
| [10] | Leinala EK, Davies PL, Doucet D, et al. A β-helical antifreeze protein isoform with increased activity. Journal of Biological Chemistry, 2002, 277 (36): 33349–33352. DOI:10.1074/jbc.M205575200 |
| [11] | Marshall CB, Daley ME, Sykes BD, et al. Enhancing the activity of a beta-helical antifreeze protein by the engineered addition of coils. Biochemistry, 2004, 43 (43): 11637–11646. |
| [12] | Mao XF, Liu ZY, Li H, et al. Calorimetric studies on an insect antifreeze protein ApAFP752 from Anatolica polita. Journal of Thermal Analysis & Calorimetry, 2011, 104 (1): 343–349. |
| [13] | Amornwittawat N, Wang S, Duman JG, et al. Polycarboxylates enhance beetle antifreeze protein activity. Biochimica Et Biophysica Acta Proteins & Proteomics, 2008, 1784 (12): 1942–1948. |
| [14] | Mao XF, Liu ZY, Ma J, et al. Characterization of a novel β-helix antifreeze protein from the desert beetle Anatolica polita. Cryobiology, 2011, 62 (2): 91–99. DOI:10.1016/j.cryobiol.2011.01.001 |
| [15] | Verdu JR, Casas JL, Lobo JM, et al. Dung beetles eat acorns to increase their ovarian development and thermal tolerance. PLoS One, 2012, 5 (4): 61. |
| [16] | Drori R, Celik Y, Davies PL, et al. Ice-binding proteins that accumulate on different ice crystal planes produce distinct thermal hysteresis dynamics. Journal of the Royal Society Interface, 2014, 11 (98): 20140526. DOI:10.1098/rsif.2014.0526 |
| [17] | Pertaya N, Marshall CB, Celik Y, et al. Direct visualization of spruce budworm antifreeze protein interacting with ice crystals:basal plane affinity confers hyperactivity. Biophysical Journal, 2008, 95 (1): 333–341. DOI:10.1529/biophysj.107.125328 |
| [18] | Wen X, Wang S, Amornwittawat N, et al. Interaction of reduced nicotinamide adenine dinucleotide with an antifreeze protein from Dendroides canadensis:mechanistic implication of antifreeze activity enhancement. J Mol Recognit, 2011, 24 : 1025–1032. DOI:10.1002/jmr.1151 |
| [19] | Kim JS, Yethiraj A. The effect of salt on the melting of ice:A molecular dynamics simulation study. Journal of Chemical Physics, 2008, 129 (12): 191–195. |
| [20] | Haji-Akbari A, Debenedetti PG. Direct calculation of ice homogeneous nucleation rate for a molecular model of water. Proc Natl Acad Sci USA, 2015, 112 (34): 10582–10588. DOI:10.1073/pnas.1509267112 |