2. 浙江大学医学院附属第二医院放射科,杭州 310009
2. Department of Radiology, the Second Affiliated Hospital, College of Medical Sciences, Zhejiang University, Hangzhou 310009
核磁共振成像(MRI)由于具有很高的空间分辨率和软组织对比,能够灵活、无创地观察被MR,对比剂标记的目标细胞在体内的迁移、分化及增殖情况[1-5],已成为当前活体检测和干细胞移植监测研究的热点。目前使用转铁蛋白受体探针(转铁蛋白-单晶氧化铁超微粒、抗转铁蛋白受体抗体-单晶氧化铁超微粒)标记细胞进行MRI观察,存在一定的缺陷[6-8],因此,迫切需要发展一种新的标记方法,实现MRI技术对活体标记细胞进行长期监测。铁蛋白可以作为MRI分子影像学研究的报告分子。除标记后的细胞移植不存在近期和远期毒副作用外,其对细胞活性、功能、增殖能力、分化能力、凋亡率和氧自由基生成情况均无明显改变,引起了学者的广泛关注[9-13]。铁蛋白储存了机体铁含量的20%-30%,其由重链蛋白和轻链蛋白两个亚基构成,二者的编码基因分别定位于不同染色体[14]。研究表明,重链蛋白(ferritin heavy chain 1,FTH1)是铁蛋白行使功能的主要亚单位,含有铁氧化酶活性中心,负责铁离子的氧化和整合[15]。目前已经有成功的案例,分别在人神经母细胞瘤细胞[16]、人乳腺癌细胞[17]和小鼠间充质干细胞D1细胞系[18]中成功表达Fth1报告基因。另一方面,通过骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)移植可明显改善肾病患者的肾脏功能,但BMSCs移植后,必须明确移植细胞的迁移、成活和分化状态,以确认其对疾病症状缓解的贡献[19]。本研究通过构建携带大鼠Fth1基因的慢病毒,感染大鼠骨髓间充质干细胞(RMSC),体外观察Fth1的表达及其对细胞生存及增殖的影响,旨为进一步研究移植细胞的活体示踪奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞株大鼠骨髓间充质干细胞RMSC和HEK 293T细胞购自ScienCell生物公司。
1.1.2 目的基因、慢病毒载体及慢病毒包装系统大鼠Fth1基因由省心科技有限公司合成。慢病毒载体pLenti-GFP-C(含有GFP报告基因和C-端HA标签)及慢病毒包装系统由南京爱必梦公司提供。
1.1.3 主要试剂引物合成和测序委托擎科生物有限公司完成。限制性内切酶和T4连接酶为NEB公司产品。DNA Marker、小鼠抗HA标签单克隆抗体及HRP标记山羊抗小鼠二抗购自abm生物公司。DMEM培养基、胎牛血清和羟乙基哌嗪乙硫磺酸(HEPES)为Gibco公司产品。2 × super HIFI-MIX Ⅱ,DNA胶回收试剂盒,WST-1细胞增殖试剂盒购自Sigma公司。大肠杆菌感受态细胞Trans1-T1购自全式金生物技术有限公司。
1.2 方法 1.2.1 大鼠Fth1基因序列及扩增根据从NCBI网站(http://www.ncbi.nlm.nih.gov/)获得的Rattus norvegicus ferritin heavy chain 1,mRNA序列(Fth1,GenBank:NM_012848.2),人工合成其cDNA序列,以其为模板进行PCR扩增。所用正向引物为Fth1F:5' -CAGTGTGGTGGCCTGCAGGTGAATTCGCCACCATGACCACCGCGTCTCCCTC-3' (下划线为EcoR Ⅰ酶切位点),反向引物为Fth1R:5' -CTTGCTCACCATCTCGAGTTTTCTAGAGCTCTCATCACCGTGTCCCAG-3' (下划线为Xho Ⅰ酶切位点)。PCR扩增体系为:模板1 μL,上下游引物各1 μL,2×super HIFI-MIX Ⅱ 25 μL,灭菌的双蒸水20 μL。PCR扩增条件为:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸60 s,共32个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析鉴定。
1.2.2 慢病毒载体构建大鼠Fth1 PCR产物经胶回收试剂盒纯化回收,与慢病毒载体pLenti-GFP-C分别经EcoRⅠ和XbaⅠ双酶切、胶回收,获得带有黏性末端的目的片段及载体,16℃连接过夜。将连接产物转化至大肠杆菌感受态细胞Trans1-T1中,将转化后的菌液涂布含卡那霉素(50 μg/mL)抗性的LB固体培养基平板筛选,37℃,过夜培养。挑取转化子用Fth1F、Fth1R引物进行菌落PCR,挑取扩增出目的大小片段的转化子扩大培养,提取质粒后使用EcoR Ⅰ和Xba Ⅰ双酶切鉴定。鉴定正确的质粒送杭州擎科梓熙生物技术有限公司测序,正确的重组质粒命名为pLenti-GFP-C-Fth1。
1.2.3 慢病毒包装和滴度测定将重组慢病毒质粒pLenti-GFP-C-Fth1或空载体质粒pLenti-GFP-C及包装质粒进行高纯度无内毒素抽提后共转染HEK 293T细胞,获得携带大鼠Fth1基因的重组慢病毒,以及作为对照的空载体慢病毒,并采用逐孔稀释法测定病毒滴度。
1.2.4 RMSC细胞的培养及感染RMSC细胞使用含10%胎牛血清的DMEM培养于37℃,5% CO2培养箱中。感染前一天,将细胞铺于24孔板中,每孔10 000个细胞/500 μL。培养24 h后,分别用Fth1慢病毒及空载体慢病毒以不同的MOI值感染RMSC细胞,继续培养2-6 d。观察细胞形态及绿色荧光蛋白表达情况。
1.2.5 Western blot检测使用Western blot检测验证FTH1在RMSC细胞中的表达情况。收获病毒感染(MOI=100)的RMSC细胞,提取细胞总蛋白,BCA法测定蛋白浓度,聚丙烯酰胺凝胶电泳后转印至硝酸纤维素膜,5%脱脂牛奶室温封闭1 h,HA一抗(1:1 000)和FTH1细胞溶液(1:500)4℃孵育过夜,TBST(TBS + 0.1% Tween 20)洗膜3次后二抗(1:100 000)室温孵育1 h,彻底洗膜后使用ECL发光试剂显影,曝光。实验重复3次。
1.2.6 细胞增殖检测将RMSC细胞以5 000细胞/100 μL/孔的密度铺于96孔板,分别使用Fth1慢病毒(RMSC-Fth1)及空载体慢病毒(RMSC-GFP)进行感染后继续培养3 d。每天观察细胞生长情况。感染后第3天,每孔加入10 μL的WST试剂,继续孵育30 min,1 h和4 h,分别在3个时间点使用酶标仪在OD450 nm下测量各孔光密度值。
2 结果 2.1 pLeni-GFP-C-Fth1载体的构建及鉴定大鼠Fth1基因PCR产物经1%的琼脂糖凝胶电泳分析后,在500-600 bp之间有一条特异性条带,大小与目的基因长度相符(图 1)。产物经纯化、EcoR Ⅰ和Xba Ⅰ双酶切后,与含有相同黏性末端的pLeni-GFP-C载体连接,转化大肠杆菌Trans1-T1,通过菌落PCR筛选阳性克隆。提取质粒后进行双酶切验证(图 2),切下的小片段与Fth1基因PCR产物大小吻合,而大片段与pLeni-GFP-C载体的长度吻合,说明基因片段与载体正确连接。进一步经DNA测序确定连入的基因片段正确无误,慢病毒载体构建成功。
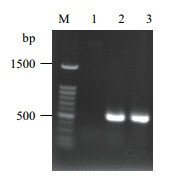
|
| 图 1 PCR扩增大鼠Fth1结果 M:DNA分子量标准100 bp ladder;1:阴性对照(水);2,3:大鼠Fth1 PCR产物 |
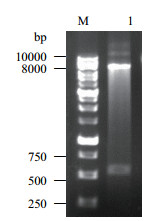
|
| 图 2 pLeni-GFP-C-Fth1载体酶切电泳图 M:DNA分子量标准1kb-Plus Ladder;1:质粒双酶切产物 |
将慢病毒质粒pLenti-GFP-C-Fth1或空载体质粒pLenti-GFP-C及包装质粒共转染HEK 293T细胞,获得携带大鼠Fth1基因的重组慢病毒,以及作为对照的空载体慢病毒。采用逐孔稀释法测定病毒滴度约为3×108 TU/mL。
2.3 慢病毒感染RMSC细胞以及目的基因表达的检测 2.3.1 荧光显微镜观察细胞中绿色荧光蛋白的表达分别将Fth1重组慢病毒和空载体慢病毒以不同MOI值感染RMSC细胞。感染后72 h,荧光显微镜下观察显示RMSC细胞内可见明显的绿色荧光(图 3),表明慢病毒成功感染RMSC细胞。MOI=100时,细胞毒性相对较小并可取得较满意的感染效果,感染阳性率 > 80%。

|
| 图 3 荧光显微镜观察慢病毒感染RMSC细胞72 h后绿色荧光蛋白表达情况 A,C:明场照片;B,D:荧光视野照片。A,B:慢病毒感染;C,D:空白对照 |
Western blot结果(图 4)显示,与空载体慢病毒感染细胞相比,Fth1重组慢病毒感染细胞在42 kD处检测到特异条带。该条带与目的蛋白FTH1的预计分子量(21.2 kD)不符,但正好为其2倍,推测可能是FTH1蛋白形成了二聚体。
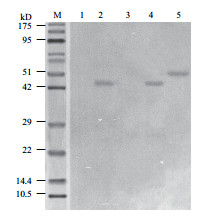
|
| 图 4 Western blot检测骨髓间充质干细胞中Fth1表达 M:蛋白分子量标准;1:未转染的RMSC裂解沉淀;2:转染过的RMSC细胞裂解沉淀;3:未转染RMSC细胞的上清液;4:转染RMSC细胞的上清液 |
实验结果(图 5)显示,铺板后72 h,与空载体对照组相比,Fth1慢病毒感染并未影响细胞增殖,加入WST-1试剂后30 min、1 h及4 h时的吸光度测量结果均无显著差异。30 min内感染与未感染的细胞增殖速度有所不同,随着时间延长,1 h和4 h之间含有Fth1基因的慢病毒对大鼠间充质干细胞增殖无显著影响。
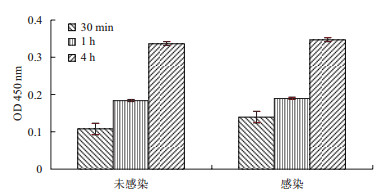
|
| 图 5 细胞增殖活性检测 |
IgA肾病是慢性肾小球肾炎中最常见的一种类型,在我国约占肾活检患者总数的40%-47%[20, 21]。Herrera和Qian等[22, 23]的研究表明,BMSCs参与了肾脏损伤的修复,为IgA肾病的治疗提供了新的策略。本研究的主要目的就是选择铁蛋白作为报告基因,将铁蛋白和GFP修饰的BMSCs移植到IgA肾病模型鼠体内,以期未来通过磁敏感加权成像(SWI)动态监测干细胞在肾脏区域的分布、增殖及分化情况;同时通过相位值的测定来评估BMSCs在体内的增殖情况,为干细胞移植治疗效果的长期随访评估提供一种无创性的影像学手段。
以往大部分研究主要集中在Fth1报告基因在肿瘤细胞中的表达[24-28],在干细胞中进行重链蛋白表达的研究很少,在骨髓间充质干细胞中目前还未见报道。在实验前期,我们采用了腺病毒感染的方式进行基因转染,但是只有血清型4和8有阳性信号,且感染阳性率仅为5%。而使用慢病毒大大提高了感染效率。Pereira等[18]研究了两种报告基因铁蛋白和转铁蛋白受体在小鼠的间充质干细胞中过表达对细胞铁的平衡的影响,结果发现Fth1基因的过表达,在铁含量供应不足的情况下,影响了铁的平衡,导致了细胞的表型发生变化。而本实验表明,在大鼠间充质干细胞中过表达Fth1,正常培养条件下对于细胞的形态、活力及生长增殖均无显著影响。至于过表达的Fth1在RMSC中的聚铁能力以及所聚集的铁离子对细胞的影响,还需要进一步的研究。虽然铁蛋白作为内源性报告基因具有不可比拟的优势,但是转染细胞后,对细胞的生物学特性如BMSC的成骨、成软骨、成脂诱导分化情况的影响,都还需要进行考虑。此外,利用MRI对动物体内成像显示的条件也需做更多的探索,这些都为以后采用SWI取代传统的T2*WI进行在体标记干细胞的示踪研究,以期提高标记干细胞检出的敏感性和进行定量分析提供了技术条件和奠定了基础。
4 结论本研究使用慢病毒感染系统,构建了含有GFP标签的Fth1基因表达载体,并在大鼠骨髓间充质干细胞中成功表达了核磁报告基因Fth1;明确了Fth1基因转染BMSC时不影响细胞的形态和正常增殖,完全可以用于后续细胞分化及细胞移植研究。
| [1] | Cen P, Chen J, Hu C, et al. Noninvasive in-vivo tracing and imaging of transplanted stem cells for liver regeneration. Stem Cell Research & Therapy, 2016, 7 (1): 143. |
| [2] | Ebert SN, Taylor DG, Nguyen HL, et al. Noninvasive tracking of cardiac embryonic stem cells in vivo using magnetic resonance imaging techniques. Stem Cells, 2007, 25 (11): 2936–2944. DOI:10.1634/stemcells.2007-0216 |
| [3] | Massoud TF, Gambhir SS. Molecular imaging in living subjects:seeing fundamental biological processes in a new light. Genes & Development, 2003, 17 (5): 545–580. |
| [4] | Zhu J, Zhou L, XingWu F. Tracking neural stem cells in patients with brain trauma. The New England Journal of Medicine, 2006, 355 (22): 2376–2378. DOI:10.1056/NEJMc055304 |
| [5] | 韩昊君, 韩鸿宾, 孙晓梅, 等. 磁共振成像技术在郁金香花芽分化活体监测上的应用研究. 核农学报, 2009, 23(2): 248–252. |
| [6] | Kim SJ, Lewis B, Steiner MS, et al. Superparamagnetic iron oxide nanoparticles for direct labeling of stem cells and in vivo MRI tracking. Contrast Media & Molecular Imaging, 2016, 11 (1): 55–64. |
| [7] | Korchinski DJ, Taha M, Yang R, et al. Iron oxide as an MRI contrast agent for cell tracking. Magnetic Resonance Insights, 2015, 8 (1): 15–29. |
| [8] | Zheng B, von See MP, Yu E, et al. Quantitative magnetic particle imaging monitors the transplantation, biodistribution, and clearance of stem cells in vivo. Theranostics, 2016, 6 (3): 291–301. DOI:10.7150/thno.13728 |
| [9] | Cohen B, Dafni H, Meir G, et al. Ferritin as an endogenous MRI reporter for noninvasive imaging of gene expression in C6 glioma tumors. Neoplasia, 2005, 7 (2): 109–117. DOI:10.1593/neo.04436 |
| [10] | Matsumoto Y, Chen R, Anikeeva P, et al. Engineering intracellular biomineralization and biosensing by a magnetic protein. Nature Communications, 2015, 6 : 8721–8731. DOI:10.1038/ncomms9721 |
| [11] | Yang C, Tian R, Liu T, et al. MRI reporter genes for noninvasive molecular imaging. Molecules, 2016, 21 (5): 1–16. |
| [12] | Yang Y, Gong MF, Yang H, et al. MR molecular imaging of tumours using ferritin heavy chain reporter gene expression mediated by the hTERT promoter. European Radiology, 2016, 26 (11): 4089–4097. DOI:10.1007/s00330-016-4259-9 |
| [13] | Ziv K, Meir G, Harmelin A, et al. Ferritin as a reporter gene for MRI:chronic liver over expression of H-ferritin during dietary iron supplementation and aging. NMR in Biomedicine, 2010, 23 (5): 523–531. DOI:10.1002/nbm.v23:5 |
| [14] | Arosio P, Ingrassia R, Cavadini P. Ferritins:A family of molecules for iron storage, antioxidation and more. Biochimica et Biophysica Acta (BBA)-General Subjects, 2009, 1790 (7): 589–599. DOI:10.1016/j.bbagen.2008.09.004 |
| [15] | Chasteen ND, Harrison PM. Mineralization in ferritin:an efficient means of iron storage. Journal of Structural Biology, 1999, 126 (3): 182–194. DOI:10.1006/jsbi.1999.4118 |
| [16] | 贺小娅, 蔡金华, 勇秦, 等. 磁共振报告基因FTH1慢病毒载体构建及其在人神经母细胞瘤细胞中的表达. 第三军医大学学报, 2014, 36(23): 2338–2342. |
| [17] | 南翔. GFP/Ferritin双标基因的磁共振成像[D].呼和浩特:内蒙古农业大学, 2012. |
| [18] | Pereira SM, Moss D, Williams SR, et al. Overexpression of the MRI reporter genes ferritin and transferrin receptor affect iron homeos-tasis and produce limited contrast in mesenchymal stem cells. International Journal of Molecular Sciences, 2015, 16 (7): 15481–15496. DOI:10.3390/ijms160715481 |
| [19] | Casiraghi F, Perico N, Cortinovis M, et al. Mesenchymal stromal cells in renal transplantation:opportunities and challenges. Nature Reviews. Nephrology, 2016, 12 (4): 241–253. DOI:10.1038/nrneph.2016.7 |
| [20] | Wyatt RJ, Julian BA. IgA nephropathy. The New England Journal of Medicine, 2013, 368 (25): 2402–2414. DOI:10.1056/NEJMra1206793 |
| [21] | 陈香美, 谢院生. 重视延缓IgA肾病进展的基础和临床研究. 中华肾脏病杂志, 2004, 20(4): 235–254. |
| [22] | Herrera M, Mirotsou M. Stem cells:potential and challenges for kidney repair. American Journal of Physiology. Renal Physiology, 2014, 306 (1): 12–23. DOI:10.1152/ajprenal.00238.2013 |
| [23] | Qian H, Yang H, Xu W, et al. Bone marrow mesenchymal stem cells ameliorate rat acute renal failure by differentiation into renal tubular epithelial-like cells. International Journal of Molecular Medicine, 2008, 22 (3): 325–332. |
| [24] | Aung W, Hasegawa S, Koshikawa-Yano M, et al. Visualization of in vivo electroporation-mediated transgene expression in experimental tumors by optical and magnetic resonance imaging. Gene Therapy, 2009, 16 (7): 830–839. DOI:10.1038/gt.2009.55 |
| [25] | Choi SH, Cho HR, Kim HS, et al. Imaging and quantification of metastatic melanoma cells in lymph nodes with a ferritin MR reporter in living mice. NMR in Biomedicine, 2012, 25 (5): 737–745. DOI:10.1002/nbm.v25.5 |
| [26] | Feng Y, Liu Q, Zhu J, et al. Efficiency of ferritin as an MRI reporter gene in NPC cells is enhanced by iron supplementation. Journal of Biomedicine & Biotechnology, 2011, 2012 : 268–281. |
| [27] | Iordanova B, Hitchens TK, Robison CS, et al. Engineered mitochondrial ferritin as a magnetic resonance imaging reporter in mouse olfactory epithelium. PLoS One, 2013, 8 (8): e72720. DOI:10.1371/journal.pone.0072720 |
| [28] | Kim HS, Cho HR, Choi SH, et al. In vivo imaging of tumor transduced with bimodal lentiviral vector encoding human ferritin and green fluorescent protein on a 1. 5T clinical magnetic resonance scanner. Cancer Research, 2010, 70 (18): 7315–7324. DOI:10.1158/0008-5472.CAN-10-0241 |




