2. 中国农业科学院生物技术研究所,北京 100081;
3. 四川大学生命科学学院,成都 610065;
4. 中国人民大学附属中学,北京 100080
2. Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081;
3. College of Life Sciences, Sichuan University, Chengdu 610065;
4. The High School Affiliated to Renmin University of China, Beijing 100080
非生物胁迫,如干旱、高盐、高渗等都会直接或间接引起细胞水分缺失,导致蛋白聚集、脂质过氧化、DNA损伤,最终对生物体的生物学功能产生造成严重影响[1-4]。研究表明亲水蛋白是一类甘氨酸含量大于6%,亲水指数大于1,广泛存在于植物、真菌、细菌中的小分子蛋白[5, 6]。亲水蛋白拥有高比例的亲水性氨基酸,能形成无规卷曲结构,更好地结合水分子,也可作为分子伴侣稳定蛋白构象,保护胁迫条件下酶、蛋白的活性[7-12],LEA蛋白作为亲水蛋白的重要成员已成为近年来的研究热点[5, 12-18]。
LEA蛋白是一种逆境响应蛋白,低温、干旱、盐渍、ABA等均可诱导其表达。其具有广泛的生物学功能,如清除活性氧自由基、稳定膜结构、保护酶活性等。Battaglia等[15]根据LEA蛋白的保守结构域及亲水系数等将其分为7个家族,其中,LEA3蛋白拥有由11个氨基酸组成的保守结构域(ΦΦΩXΦΨΩΨΦXΩ)[16, 17],可形成亲水的α螺旋[14],能够避免非生物胁迫引起的细胞内离子损伤[18],保护酶的活性不受抑制,尤其是新陈代谢过程中苹果酸脱氢酶(MDH)及乳酸脱氢酶(LDH)的活性[19, 20]。目前关于LEA3蛋白功能已有许多报道,如鹰嘴豆PM2基因在大肠杆菌中异源表达能提高大肠杆菌的耐盐性[21];TaLEA2基因能改善转基因酵母在山梨醇胁迫下的生长情况[22];过表达蛋白TaLEA2与HVA1均可增强酵母对低温和高渗胁迫的抗性[23]。
Makarova等[24-26]报道耐辐射异常球菌(Deino-coccus radiodurans)基因dlp(dr0105)、dr1172编码干燥相关蛋白,为具有较高亲水性的LEA3蛋白。通过生物信息学分析基因dlp编码蛋白Dlp氨基酸组成及结构特征发现,此蛋白分子含量小,含有大量α螺旋结构,高度亲水,含有与LEA3家族蛋白保守结构域相似的串联重复基序,推测为LEA3类似蛋白,将其命名为Dlp(Deinococcus radiodurans LEA3 protein)。本研究构建dlp缺失突变株,探索非生物胁迫条件下其对细胞生存的影响,并测定体外氧化胁迫条件下Dlp蛋白对MDH和LDH酶活性的保护作用,旨在进一步研究非生物胁迫条件下Dlp蛋白的抗逆功能及作用机制。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒及培养条件耐辐射异常球菌(Deinococcus radiodurans,DR1.633)购自中国科学院微生物菌种保藏中心;高频转化受体菌大肠杆菌Escherichia coli trans 109,BL21(DE3)购自北京全式金生物技术公司;pKatAPH3质粒(携带Km抗性基因)、原核表达载体pET32a为本实验室保存。大肠杆菌用LB培养基(1% Typtone,0.5% Yeast extract,1% NaCl,pH7.0,固体培养基含1.5%琼脂)在37℃条件下培养;耐辐射异常球菌使用TGY培养基(1% Typtone,0.5% Yeast extract,0.1% glucose;固体培养基含1.5%琼脂)于30℃下培养。
1.1.2 主要试剂限制性核酸内切酶、T4 DNA连接酶、BSA购自New England Biolabs公司;细菌基因组提取试剂盒购自北京天根科技有限公司,常规质粒提取试剂盒、胶回收纯化试剂盒购自Magen公司;PrimeStar HS DNA Polymerase购自TaKaRa公司;RNA提取试剂盒购自Promega公司;MDH(来自猪心脏)、LDH、NADH、草酰乙酸购于Sigma公司;其他生化试剂均为分析纯。实验涉及到的引物合成及测序均由华大生物技术公司完成。
1.2 方法 1.2.1 Dlp蛋白的生物信息学分析从NCBI中获取耐辐射异常球菌基因dlp序列及其编码蛋白Dlp的氨基酸序列信息,利用软件DNAMAN和MEGA6、Blast检索GenBank进行多重序列比较及同源性分析,并构建进化树;利用Protparam(http://web.expasy.org/protparam/)在线预测Dlp蛋白的分子质量、等电点、稳定系数等性质;结合Kyte等[6]总结出的氨基酸疏水指数,利用Protscale(http://web.expasy.org/protscale/)进行Dlp蛋白的亲/疏水性分析;利用DNAMAN及GOR Ⅳ程序(https://npsa-prabi.ibcp.fr/)预测Dlp蛋白的二级结构;利用Radar进行蛋白重复基序查询(http://www.ebi.ac.uk/Tools/pfa/radar/)。
1.2.2 突变株Δdlp、异源表达菌株E32a-dlp的构建从NCBI数据库中获取dlp基因及其上、下游同源臂片段U、D序列,从质粒pKatAPH3获得带有启动子的卡那抗性基因片段(Km)序列,利用Primer Premier 5.0和DNAMAN软件进行PCR引物设计(表 1)。通过融合PCR反应:98℃预变性5 min;98℃变性30 s,52℃退火20 s,72℃延伸3 min,13个循环;72℃终延伸5 min。将从pKatAPH3质粒上扩增的Km反向插入到dlp基因的上、下游U、D之间,获得三片段融合产物UKD(2 806 bp),将融合产物通过线性转化至野生型D. radiodurans中,通过50 μg/mL卡那霉素抗性筛选最终获得缺失突变株Δdlp。使用表 1中P3/P4、P7/P8、P9/P10及P1/P6 4对引物对Δdlp进行PCR扩增验证,并以野生型D. radiodurans为对照,PCR扩增的融合产物全长片段QUKD进行测序进一步验证实验结果的正确性。从DR基因组上扩增带有酶切位点BamH Ⅰ/ Hind Ⅲ的片段dlp(B/H),将其与双酶切后的pET32a载体片段连接获得重组质粒pET32a-dlp,转化至E. coli BL21获得重组菌株E32a-dlp。转化空质粒pET32a作为对照菌株(E32a)。PCR、BamH Ⅰ/Hind Ⅲ双酶切阳性克隆送至华大生物技术公司测序。
从划线培养的平板上挑取活化的野生型DR与突变株Δdlp单菌落,接种至2 mL TGY液体培养基中(突变株Δdlp培养基中含有10 μg/mL Km抗生素),30℃振荡培养至对数中期,将培养好的种子液以1%的接种量转接到新鲜的20 mL TGY液体培养基中(突变株培养基中含有10 μg/mL Km抗生素),培养至对数初期(OD600约为0.6-0.8),取1 mL菌液(保证DR、Δdlp菌体量一致)。分别同时向DR、Δdlp加入27% H2O2母液,使其终浓度为60 mmol/L和80 mmol/L,对照组不加H2O2,混匀样品30℃避光30 min。3 000 r/min离心5 min收集菌体,菌体重悬于1 mL 4 mol/L和5 mol/L NaCl悬液中,对照菌株重悬于1 mL无菌水中,30℃,200 r/min温育6 h。处理后的菌悬液使用无菌水进行梯度稀释混匀,每个稀释梯度(10-1-10-5)各取10 μL点接于TGY固体培养基上,30℃倒置培养2-3 d,观察DR和Δdlp在培养基上的生长情况,实验进行3次独立重复。
1.2.4 Dlp蛋白的表达与纯化过夜培养的重组大肠杆菌E32a-dlp按1%接种至500 mL含Amp(50 μg/mL)的新鲜LB液体培养基中,37℃培养至OD600≈0.6,加入终浓度为0.2 mmol/L的IPTG,16℃过夜诱导表达。8 000 r/min离心10 min收集菌体,用1/20体积NTA-0 Buffer(20 mmol/L Tris-HCl,0.5 mol/L NaCl,10% Glycerol,pH7.9)重悬菌体,超声破碎细胞,15 000 r/min、15 min离心收集上清。使用镍柱亲和层析纯化Dlp蛋白,使用不同咪唑浓度(10、20、60、80和200 mmol/L)的NTA-0缓冲液梯度洗脱,分别收集各梯度洗脱液,SDS-PAGE电泳检测蛋白纯化情况,确定最终洗脱浓度,收集纯度较高的Dlp融合蛋白,并采用Brandford法测定蛋白浓度,-80℃保存备用。
1.2.5 氧化胁迫下MDH、LDH活性的测定氧化还原酶MDH能催化“苹果酸+NAD+⇌草酰乙酸+NADH+H+”反应,LDH能催化“乳酸+NAD+⇌丙酮酸+NADH+H+”反应,NADH、NAD+分别在340 nm和260 nm波长处有最大吸收峰。参照Reyes等[1, 19]体外检测MDH、LDH活性的方法,通过检测A340变化计算MDH、LDH的活性。酶活性测定所用缓冲液如下:MDH酶溶解液(50 mmol/L磷酸钾缓冲液,pH7.2),LDH酶溶解液(25 mmol/L Tris-HCl,pH7.2),MDH反应液(0.2 mmol/L草酰乙酸、0.2 mmol/L NADH、150 mmol/L磷酸钾缓冲液,pH7.5),LDH反应液(100 mmol/L KCl、2 mmol/L丙酮酸钠、0.15 mmol/L NADH、25 mmol/L Tris-HCl,pH7.5)。
参照表 2,按照MDH、LDH与蛋白1:5的摩尔比混合样品,选用BSA作为正对照,不加实验蛋白作为空白对照。将MDH、LDH混合样品用100和200 mmol/L H2O2分别遮光处理1 h、2 h,取处理后的样品10 μL混匀到1 mL对应反应液中,测定反应体系起始1 min内A340的变化,根据A340吸收值的减少计算MDH、LDH酶活性变化。每个实验重复3次。
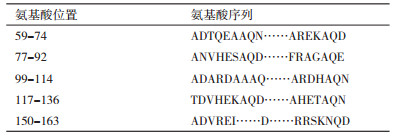
基因dlp位于D. radioduransⅠ号染色体上,全长492 bp,编码蛋白由163个氨基酸组成。氨基酸序列比对(图 1-A)显示,耐辐射异常球菌中含有两个LEA3家族蛋白Dlp(DR0105)和DR1172,其氨基酸序列一致性较低,仅为16.11%;Dlp蛋白与来源于D. gobiensis的DGo_CA1631、Cyberlindnera jadinii的ODV76513序列一致性分别为22.09%和22.94%。系统发育分析结果(图 2-B)显示,Dlp蛋白与来自Lachancea lanzarotensis的蛋白亲缘关系最近,而与同一来源的DR1172蛋白进化关系较远。通过以上分析,推测Dlp蛋白是耐辐射异常球菌所特有的蛋白。

|
| 图 1 Dlp蛋白序列比对(A)及系统发育分析(B) A:Dlp蛋白序列比对;B:Dlp蛋白进化树,分支末端为序列GenBank登录号,括号为物种名称,分支上数据代表置信度;耐辐射异常球菌Dlp蛋白用方框标出 |
|
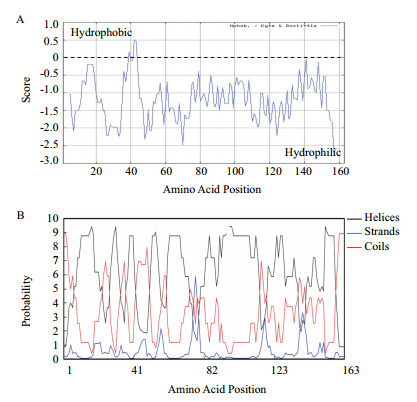
| 图 2 Dlp蛋白的亲/疏水性分析(A)及二级结构预测(B) |
Dlp蛋白分子量为17.83 kD,理论等电点(pI)为5.25,不稳定系数为30.66( < 40),是一类稳定蛋白。亲/疏水性分析(图 2-A)显示,Dlp蛋白疏水氨基酸含量显著少于亲水性氨基酸,平均疏水指数(GRAVY)为-1.263,属于亲水蛋白。二级结构预测(图 2-B)显示,Dlp蛋白有90.18%(147个)氨基酸残基可能形成α螺旋;2.45%(4个)氨基酸残基可能形成延伸链;7.36%(12个)氨基酸残基可能形成无规卷曲。利用Radar进行蛋白重复基序预测(表 3),Dlp蛋白含有5个由16个氨基酸组成的串联重复,与LEA3家族11个氨基酸组成的串联重复序列类似。
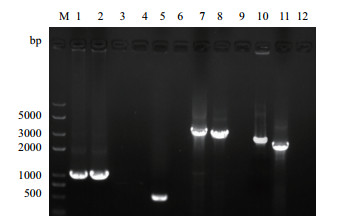
通过融合PCR方法成功构建dlp基因缺失突变株Δdlp。对Δdlp进行PCR验证,结果(图 3)显示,卡那抗性基因成功替换dlp基因整合到DR基因组中,QUKD测序结果进一步验证结果的正确性。
|
| 图 3 突变株Δdlp的PCR验证 M:DNA marker;1:P3/P4验证Δdlp中Km基因(1 010 bp);2:Km基因(以pKatAPH3质粒为模板)阳性对照(1 010 bp);3:Km基因阴性对照;4:P7/P8验证Δdlp中dlp基因;5:dlp基因阳性对照(492 bp);6:dlp基因阴性对照;7:P9/P10验证Δdlp中QUKD基因(3 596 bp);8:QUKD基因阳性对照(3 118 bp);9:QUKD基因阴性对照;10:P1/P6验证Δdlp中UKD基因(2 806 bp);11:UKD基因阳性对照(2 328 bp);12:UKD基因阴性对照 |
对DR、Δdlp进行不同浓度H2O2、NaCl胁迫处理,结果(图 4)显示,正常培养条件下(未加H2O2和NaCl),DR与Δdlp生存能力保持一致;而在60 mmol/L H2O2胁迫处理30 min后,Δdlp对H2O2敏感性高于野生型DR,80 mmol/L H2O2处理30 min后,Δdlp的生存能力急剧下降;同时,在经4 mol/L或5 mol/L NaCl处理6 h后也表现出与H2O2冲击相似的结果(图 4)。该结果表明,Dlp蛋白对耐辐射异常球菌抵抗高盐、氧化胁迫过程中起到了重要作用。

|
| 图 4 不同浓度H2O2、NaCl胁迫对DR、Δdlp生存能力的影响 10-1-10-5:菌液稀释梯度 |
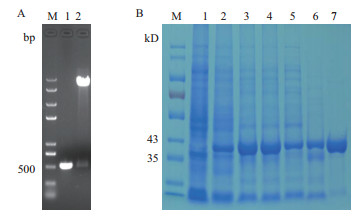
异源表达菌株E32a-dlp的PCR及酶切验证结果如图 5-A所示。BamH Ⅰ/ Hind Ⅲ酶切片段与PCR扩增片段大小一致,测序结果进一步证实重组质粒pET32a-dlp的正确性。对Dlp蛋白进行表达纯化,SDS-PAGE电泳分析结果(图 5-B)显示,以未诱导的E32a为对照,E32a-dlp出现1条与Dlp融合蛋白大小(40.83 kD)吻合的条带。0.2 mmol/L IPTG诱导下Dlp蛋白能大量表达,用含10 mmol/L咪唑的NTA-0洗脱液洗脱能去除大量杂蛋白,含60 mmol/L咪唑的NTA-0洗脱液洗脱能获得较高纯度的目标融合蛋白Dlp,收集NTA-60洗脱液,用Brandford法测定其浓度为3.3 mg/mL,-80℃保存。
|
| 图 5 异源表达菌株E32a-dlp的验证(A)及Dlp蛋白表达纯化(B) A:M:DNA Marker;1:目的片段dlp(B/H)的扩增;2:重组质粒pET32a-dlp酶切。B:M:蛋白Marker;1:未诱导的E32a菌体;2:未诱导的E32a-dlp菌体;3:0.2 mmol/L IPTG诱导的E32a-dlp菌体;4:0.2 mmol/L IPTG诱导的E32a-dlp菌体破碎后上清;5:上清过NI柱穿透液;6:NTA-10洗脱液;7:NTA-60洗脱液 |
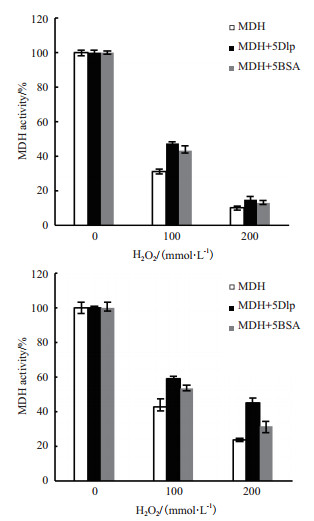
为验证胁迫条件下Dlp蛋白对MDH与LDH酶活性的保护作用,分别用100和200 mmol/L H2O2对酶混合样品进行避光处理,测定MDH和LDH酶活性,每个实验重复3次,将未胁迫样品的酶活性视为100%,对实验结果进行数据处理。MDH样品进行1 h避光处理后其酶活性如图 6-A所示,100 mmol/L H2O2处理后,MDH的酶活性下降为31%,200 mmol/L H2O2处理后,MDH的酶活性下降更为明显(仅剩9.9%);而加入Dlp蛋白后,100 mmol/L H2O2处理后MDH酶活性为47.3%,200 mmol/L H2O2处理后MDH的酶活性为14.9%,其保护作用高于蛋白稳定剂BSA。100和200 mmol/L H2O2对LDH样品进行2 h避光处理后LDH酶活性的变化情况与胁迫条件下MDH酶活性的变化类似(图 6-B)。以上结果表明,在氧化胁迫条件下Dlp蛋白能够保护MDH、LDH酶活性,且其保护作用强于BSA。
|
| 图 6 H2O2胁迫条件下Dlp对MDH(A)及LDH(B)酶活性的保护 |
LEA3蛋白是相对分子质量在10-30 kD的一组小分子亲水多肽,其Cys、Trp、Phe、Tyr相对含量低,而Ala、Arg、Glu、Gln、Gly含量较高[14],包含11个氨基酸组成的保守结构域(ΦΦΩXΦΨΩΨΦXΩ)可形成α螺旋结构,可以使LEA蛋白之间形成二聚体结构[14-17]。本研究对Dlp蛋白进行生物信息学分析发现,Dlp蛋白Cys、Trp、Phe、Tyr总含量为1.2%,而Ala、Arg、Glu、Gln、Gly总含量56.4%,拥有90.18% α-螺旋结构,为小分子亲水蛋白,这与LEA3蛋白的特征相吻合[24-26];但Dlp蛋白包含16个氨基酸组成的5个串联重复基序,该序列特征不同于典型的LEA3蛋白保守结构域,故本研究Dlp蛋白为LEA3类似蛋白。
LEA3蛋白高比例的α-螺旋具有高度亲水性,这一结构特点能保障其自身具有高度的柔性和流动性,促使分子内氢键的形成,无规卷曲结构可使其在各个方向上拉伸、弯曲和伸展,从而起到稳定蛋白和膜结构、束缚无机离子、结合水分子、防止细胞质结晶等作用,进而保护细胞结构[1, 27, 28],这预示着非生物胁迫逆境下LEA3蛋白的积累对细胞具有一定的保护作用。高盐与氧化胁迫均会导致体内活性氧的积累,引发细胞组分破坏、脂质过氧化、蛋白聚集及DNA损伤[19, 29]。野生型和突变株的非生物胁迫实验结果显示,在高盐和氧化胁迫条件下野生型和突变株的生存能力显著弱于正常培养条件下的菌株,且dlp基因的缺失使得细胞对高盐、强氧化胁迫更为敏感,生存能力下降的更为显著。表明Dlp蛋白的表达对耐辐射异常球菌耐盐、抗氧化能力起到了促进作用,其抗氧化功能与华跃进等的研究结果一致[30-32]。
研究表明,大多数LEA3蛋白可作为分子伴侣协助蛋白折叠成有活性的结构,防止蛋白聚集,形成天然复合物从而保护蛋白和酶活性[10, 30]。氧化胁迫产生大量ROS,它们会攻击氨基酸侧链及肽链骨架,导致蛋白发生聚集及片段化,蛋白溶解性降低、蛋白功能遭到破坏、蛋白酶失活[33-36]。MDH、LDH均是对脱水敏感的酶,经胁迫处理后结构发生变化,Reyes等[8, 19]对MDH、LDH进行反复冻融处理发现它们的酶活性均有不同程度的下降,保护蛋白的加入使其活性下降趋势得到缓解。在本研究中,H2O2胁迫下MDH、LDH酶活性也迅速下降(分别为31%、42.5%),随着H2O2浓度的加大,MDH、LDH酶活性会持续下降,Dlp蛋白的添加减缓了MDH、LDH酶活性的下降,表明Dlp蛋白对氧化胁迫条件下MDH、LDH的酶活性具有保护作用,推测Dlp蛋白可能作为分子伴侣对MDH、LDH酶活性发挥保护作用,对于其具体作用机制还需进一步实验验证。
4 结论本研究成功构建了dlp基因缺失突变株Δdlp及其外源表达菌株E32a-dlp。生物信息学分析显示Dlp蛋白为LEA3类似蛋白,是耐辐射异常球菌特有的小分子亲水蛋白,非生物胁迫实验表明该蛋白在耐辐射异常球菌耐盐、抗氧化过程中发挥重要作用,体外酶活测定实验显示其能够保护氧化胁迫条件下MDH和LDH的酶活性。
| [1] | Goyal K, Walton LJ, Tunnacliffe A. LEA proteins prevent protein aggregation due to water stress. Biochemical Journal, 2005, 388 (1): 151–157. DOI:10.1042/BJ20041931 |
| [2] | Caramelo JJ, Iusem ND. When cells lose water:Lessons from biophysics and molecular biology. Progress in Biophysics and Molecular Biology, 2009, 99 (1): 1–6. DOI:10.1016/j.pbiomolbio.2008.10.001 |
| [3] | Potts M. Desiccation tolerance:a simple process?. Trends in Microbiology, 2001, 9 (11): 553–559. DOI:10.1016/S0966-842X(01)02231-4 |
| [4] | Hansen JM, Go YM, Jones DP. Nuclear and mitochondrial compartmentation of oxidative stress and redox signaling. Annu Rev Pharmacol Toxicol, 2006, 46 : 215–234. DOI:10.1146/annurev.pharmtox.46.120604.141122 |
| [5] | Garay-Arroyo A, Colmenero-Flores JM, Garciarrubio A, et al. Highly hydrophilic proteins in prokaryotes and eukaryotes are common during conditions of water deficit. Journal of Biological Chemistry, 2000, 275 (8): 5668–5674. DOI:10.1074/jbc.275.8.5668 |
| [6] | Kyte J, Doolittle RF. A simple method for displaying the hydropathic character of a protein. Journal of Molecular Biology, 1982, 157 (1): 105–132. DOI:10.1016/0022-2836(82)90515-0 |
| [7] | Anchordoquy TJ, Carpenter JF. Polymers protect lactate dehydrogenase during freeze-drying by inhibiting dissociation in the frozen state. Archives of Biochemistry and Biophysics, 1996, 332 (2): 231–238. DOI:10.1006/abbi.1996.0337 |
| [8] | Soulages JL, Kim K, Walters C, et al. Temperature-induced extended helix/random coil transitions in a group 1 late embryogenesis-abundant protein from soybean. Plant Physiology, 2002, 128 (3): 822–832. DOI:10.1104/pp.010521 |
| [9] | Reyes JL, Campos F, Wei H, et al. Functional dissection of hydrophilins during in vitro freeze protection. Plant, Cell & Environment, 2008, 31 (12): 1781–1790. |
| [10] | Grelet J, Benamar A, Teyssier E, et al. Identification in pea seed mitochondria of a late-embryogenesis abundant protein able to protect enzymes from drying. Plant Physiology, 2005, 137 (1): 157–167. DOI:10.1104/pp.104.052480 |
| [11] | Chakrabortee S, Tripathi R, Watson M, et al. Intrinsically disordered proteins as molecular shields. Molecular BioSystems, 2012, 8 (1): 210–219. DOI:10.1039/C1MB05263B |
| [12] | Hara M, Terashima S, Fukaya T, et al. Enhancement of cold tolerance and inhibition of lipid peroxidation by citrus dehydrin in transgenic tobacco. Planta, 2003, 217 (2): 290–298. |
| [13] | Li RH, Liu GB, Wang H, et al. Effects of Fe3+ and Zn2+ on the structural and thermodynamic properties of a soybean ASR protein. Bioscience, Biotechnology, and Biochemistry, 2013, 77 (3): 475–481. DOI:10.1271/bbb.120666 |
| [14] | Wu G, Zhang H, Sun J, et al. Diverse LEA (late embryogenesis abundant) and LEA-like genes and their responses to hypersaline stress in post-diapause embryonic development of Artemia franciscana. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2011, 160 (1): 32–39. DOI:10.1016/j.cbpb.2011.05.005 |
| [15] | Battaglia M, Olvera-Carrillo Y, Garciarrubio A, et al. The enigmatic LEA proteins and other hydrophilins. Plant Physiology, 2008, 148 (1): 6–24. DOI:10.1104/pp.108.120725 |
| [16] | 刘洋, 邢鑫, 李德全. LEA蛋白的分类与功能研究进展. 生物技术通报, 2011(8): 36–43. |
| [17] | Tunnacliffe A, Wise MJ. The continuing conundrum of the LEA proteins. Naturwissenschaften, 2007, 94 (10): 791–812. DOI:10.1007/s00114-007-0254-y |
| [18] | Swire-Clark GA, Marcotte Jr WR. The wheat LEA protein Em func-tions as an osmoprotective molecule in Saccharomyces cerevisiae. Plant Molecular Biology, 1999, 39 (1): 117–128. DOI:10.1023/A:1006106906345 |
| [19] | Reyes JL, Rodrigo MJ, Colmenero-flores JM, et al. Hydrophilins from distant organisms can protect enzymatic activities from water limitation effects in vitro. Plant, Cell & Environment, 2005, 28 (6): 709–718. |
| [20] | Nakayama K, Okawa K, Kakizaki T, et al. Arabidopsis Cor15am is a chloroplast stromal protein that has cryoprotective activity and forms oligomers. Plant Physiology, 2007, 144 (1): 513–523. DOI:10.1104/pp.106.094581 |
| [21] | Liu Y, Zheng Y. PM2, a group 3 LEA protein from soybean, and its 22-mer repeating region confer salt tolerance in Escherichia coli. Biochemical and Biophysical Research Communications, 2005, 331 (1): 325–332. DOI:10.1016/j.bbrc.2005.03.165 |
| [22] | 俞嘉宁, 张林生, 张劲, 等. 小麦耐逆基因-TaLEA3的克隆及在酵母中的功能分析. 生物工程学报, 2004, 20(6): 832–838. |
| [23] | Yu JN, Zhang JS, Shan L, et al. Two new group 3 LEA genes of wheat and their functional analysis in yeast. Journal of Integrative Plant Biology, 2005, 47 (11): 1372–1381. DOI:10.1111/jipb.2005.47.issue-11 |
| [24] | Makarova KS, Aravind L, Wolf YI, et al. Genome of the extremely radiation-resistant bacterium Deinococcus radiodurans viewed from the perspective of comparative genomics. Microbiology and Molecular Biology Reviews, 2001, 65 (1): 44–79. DOI:10.1128/MMBR.65.1.44-79.2001 |
| [25] | Omelchenko MV, Wolf YI, Gaidamakova EK, et al. Comparative genomics of Thermus thermophilus and Deinococcus radiodurans:divergent routes of adaptation to thermophily and radiation resistance. BMC Evolutionary Biology, 2005, 5 (1): 1. DOI:10.1186/1471-2148-5-1 |
| [26] | Khan F, Singh SP, Mishra BN. Conservation of the LexA repressor binding site in Deinococcus radiodurans. J Integr Bioinform, 2008, 5 : 86–92. |
| [27] | Browne J, Tunnacliffe A, Burnell A. Anhydrobiosis:plant desiccation gene found in a nematode. Nature, 2002, 416 (6876): 38. DOI:10.1038/416038a |
| [28] | Park BJ, Liu Z, Kanno A, et al. Genetic improvement of Chinese cabbage for salt and drought tolerance by constitutive expression of a B. napus LEA gene. Plant Science, 2005, 169 (3): 553–558. DOI:10.1016/j.plantsci.2005.05.008 |
| [29] | Tompa P, Kovacs D. Intrinsically disordered chaperones in plants and animals. Biochemistry and Cell Biology, 2010, 88 (2): 167–174. DOI:10.1139/O09-163 |
| [30] | Liu Y, Gao ZQ, She Z, et al. The structural basis of the response regulator DrRRA from Deinococcus radiodurans. Biochemical and Biophysical Research Communications, 2012, 417 (4): 1206–1212. DOI:10.1016/j.bbrc.2011.12.110 |
| [31] | Wang L, Xu G, Chen H, et al. DrRRA:a novel response regulator essential for the extreme radioresistance of Deinococcus radiodurans. Molecular Microbiology, 2008, 67 (6): 1211–1222. DOI:10.1111/mmi.2008.67.issue-6 |
| [32] | Wang L, Hu J, Liu M, et al. Proteomic insights into the functional basis for the response regulator DrRRA of Deinococcus radiodurans. International Journal of Radiation Biology, 2016, 92 (5): 273–280. DOI:10.3109/09553002.2016.1150618 |
| [33] | Liu F, Pang SJ. Stress tolerance and antioxidant enzymatic activities in the metabolisms of the reactive oxygen species in two intertidal red algae Grateloupia turuturu and Palmaria palmate. Journal of Experimental Marine Biology and Ecology, 2010, 382 (2): 82–87. DOI:10.1016/j.jembe.2009.11.005 |
| [34] | Fredrickson JK, Li SM, Gaidamakova EK, et al. Protein oxidation:key to bacterial desiccation resistance?. The ISME Journal, 2008, 2 (4): 393–403. DOI:10.1038/ismej.2007.116 |
| [35] | Daly MJ, Gaidamakova EK, Matrosova VY, et al. Protein oxidation implicated as the primary determinant of bacterial radioresistance. PLoS Biol, 2007, 5 (4): e92. DOI:10.1371/journal.pbio.0050092 |
| [36] | Gebicki S, Gill KH, Dean RT, et al. Action of peroxidases on protein hydroperoxides. Redox Report, 2002, 7 (4): 235–242. DOI:10.1179/135100002125000541 |