四环素诱导调控系统(tetracycline regulatory system)始于原核细胞,后应用于植物细胞,是目前研究最多的诱导调控系统。在大肠杆菌的四环素抗性操纵子的启动子区存在两个基本相同的操纵序列(operator)。转座子Tn10编码的TetR(tet repressor)蛋白可与上述操纵序列紧密结合,阻止转录起始复合物的形成,从而抑制四环素基因的表达。当外源的四环素分子进入细胞后,可特异结合TetR蛋白,改变其构象而从操纵序列脱离,转录起始复合物可以形成。按四环素诱导调控系统的表达特点,可分为激活系统Tet-on和抑制系统Tet-off两类。添加小分子效应剂dox后转录调控子rtTA介导基因表达,虽然在迅速启动基因表达,但是该系统受到dox长半衰期的抑制,所以Schmidt等[1]通过体内选择分离了导致rtTA-介导报告基因表达有效快速关闭的充当dox拮抗剂的rtTA-结合多肽,这个肽代表了新型的效应分子,通过速转换基因表达开、关补充“Tet-系统”。
Normanno等[2]利用TetRs模型寻找多阵列位点,并定量分析人类细胞单分子追踪和单细胞蛋白-DNA联合测定的搜索过程,发现TetRs探索细胞核并零散的通过3D扩散与非同源位点瞬态交互达到靶目标。Huang等[3]分析了蓝藻细菌中人工TetR调控启动子的压制效应下渗漏基因表达,用L09启动子与L10、L11、L12作对比,DNA开放概率间的差异在TetR结合位点上是很小的,表明了它们结合到TetR具有相同的动力学速率常数,L09启动子泄露问题可能是由于下游区域RNA聚合酶-启动子的相互作用的增强。此外,有报道分离了一组与细菌TetR互作来诱导TetR调控体内基因表达的多肽[4-7],这些由1-16个氨基酸组成的多肽可替代Tc的功能,它们通过结合到TetR的Tc结合域发挥功能[8, 9]。
叶绿体基因工程是随着叶绿体基因组研究的深入而出现的。Boynton等[10]利用基因枪法,用带有atpB野生型基因的叶绿体DNA直接轰击3个含atpB突变型基因的衣藻细胞,使其完全恢复了光合能力。Svab等[11]利用类似技术转化烟草,首次获得了可稳定遗传的叶绿体转基因植物。目前叶绿体基因组转化技术已在烟草、番茄、马铃薯、拟南芥、大豆、胡萝卜、花椰菜、油菜、水稻和棉花等高等植物中获得了成功[12]。Iamtham等[13]利用在同一质体中可进行多次重组的现象,通过短的正向重复序列的环出将选择标记基因删除,这是一个持续的过程,删除过程复杂而无法控制。而后Hajdukiewicz等[14]建立了噬菌体Cre/loxp重组酶删除系统,但操作过程复杂,并产生了一些不可预测的叶绿体基因组重排[15],影响植物的正常生长。
四环素调控系统已成为分析生物基因功能的有用工具,Tc很容易通过细胞膜,因此可能在植物细胞中发挥作用。由于Tc属于影响70S核糖体的抗生素,Tc对蛋白合成的影响可能在叶绿体和线粒体中[16]。使用一定浓度的Tc不抑制叶绿体和线粒体蛋白合成,但诱导转基因植株表达仍是一个有效方法。本研究利用四环素诱导调控系统控制叶绿体启动子的活性,避开核基因组对质体基因组的调控干扰,以期为进一步四环素调控的质体基因工程育种提供有效的参考。
1 材料与方法 1.1 材料本式烟草、表达载体Bio3-GFP(带有prrn启动子、GFP报告基因)为本实验保存;Trans T1、Trans(DE3)感受态细胞、TransStart FastPfu Fly DNA聚合酶购自北京全式金公司;四环素购自于Sigma公司。
1.2 方法 1.2.1 引物设计根据本实验中所用到的表达载体及从NCBI中搜索烟草ppsbA启动子序列,设计引物(表 1)。
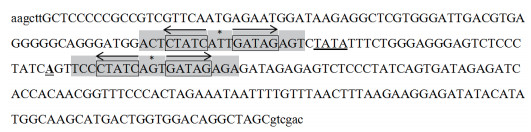
根据已知的叶绿体启动子prrn,将Tet两个核心操纵区嵌入该启动子中(图 2),将该启动子送昆明硕阳生物公司全基因合成,命名该启动子为prrnO1O2。
|
| 图 2 prrnO1O2启动子序列结构 *号碱基代表回文序列的中心碱基;箭头表示回文序列;方框内则代表与TetR蛋白直接作用的碱基序列。上下分别游引入Hind Ⅲ、Xba Ⅰ酶切位点,以小写字母表示 |
根据NCBI中烟草(Nicotiana tabacum)叶绿体基因组序列(GenBank:Z00044.2)设计引物。提取本氏烟草叶片基因组DNA,ppsbA-F/ppsbA-R为引物。RT-PCR扩增体系含ddH2O 14 μL,5×PCR缓冲液(Mg2+)5 μL,2.5 mmol/L dNTPs 2.5 μL,引物各1 μL,DNA聚合酶0.5 μL,稀释模板DNA 1 μL。PCR扩增参数为:95℃ 2 min;95℃ 20 s,54℃ 30 s,72℃ 30 s;35个循环。将回收目的片段分别连接到pEASY-Blunt simple克隆载体,并转化至大肠杆菌感受态细胞,取阳性克隆进行鉴定并测序。将克隆得到的ppsbA启动子与Bio3-GFP载体用Hind Ⅲ/Xba I双酶切,回收目的条带后连接,构建Bio3-ppsbA-GFP载体,转化大肠杆菌,并观察菌体的颜色。
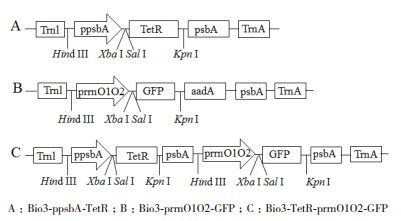
1.2.4 四环素诱导下的GFP基因的表达载体构建用Tet-Sal/Tet-Kpn引物对扩增TetR,并连接到克隆载体构建pB-TetR,然后将pB-TetR载体与Bio3-ppsbA-GFP均使用Sal Ⅰ/ Kpn Ⅰ双酶切构建Bio3-ppsbA-TetR(图 1-A);将合成的prrnO1O2启动子与Bio3-GFP载体均使用Hind Ⅲ/Xba Ⅰ双酶切,回收目的片段后,T4连接酶连接,构建Bio3-prrnO1O2-GFP(图 1-B);ppsbA-F/psbA-Hind引物对扩增ppsbA+TetR+psbA区段,后用Hind Ⅲ单酶切该区段,构建四环素诱导下的GFP基因的表达载体Bio3-TetR-prrnO1O2-GFP(图 1-C)。
|
| 图 1 四环素诱导下的GFP基因的表达载体示意图 A:Bio3-ppsbA-TetR;B:Bio3-prrnO1O2-GFP;C:Bio3-TetR-prrnO1O2-GFP |
将构建正确的Bio3-ppsbA-TetR在60 μg/mL的Amp LB固体培养基上培养,同时设置不同四环素浓度梯度,分别为0、1、2.5、5、10、15和20 μg/mL,检测不同Tc浓度下菌体的生长情况,用于筛选诱导大肠杆菌GFP正常生长、表达四环素浓度。
1.2.6 四环素调控下的叶绿体启动子活性检测将构建好的Bio3-TetR-prrnO1O2-GFP表达载体的菌株在60 μg/mL的Amp培养基平板上划单线。一个平板未加入Tc,另一平板加入5 μg/mL的Tc,培养观察两平板中菌株的生长情况。
2 结果 2.1 prrnO1O2启动子序列结构分析第一个灰色底纹部分为操纵子O1,位于TATA-box(粗下划线)的上游第2个碱基处;第一个灰色底纹部分为操纵子O2,位于prrn启动子转录起始位点A(双下划线)下游第3个碱基处[17, 18]。
2.2 烟草叶绿体ppsbA启动子的克隆及活性鉴定本研究中所构建的载体(图 1-C)含有两个表达盒,故选用不同的启动子来启动不同的表达盒。以本氏烟草DNA为模板,扩增得到烟草叶绿体ppsbA启动子,测序结果(图 3)表明大小为214 bp,含有原核启动子的-35区(TTGACA)和-10区(TATACT),与烟草基因序列(GenBank:Z00044.2)的相似度为100%。构建Bio3-ppsbA-GFP载体,经过PCR和双酶切鉴定正确(图 4泳道2)后,转化大肠杆菌,在加入60 μg/mL的Amp LB固体培养基上,可以明显的观察到菌体呈现绿色(图 5-A),ppsbA启动子启动了下游GFP基因的表达,表明ppsbA启动子在大肠杆菌中具有启动活性。

|
| 图 3 烟草叶绿体启动子ppsbA序列 |

|
| 图 4 三种表达载体的酶切检测 M:Trans2k PlusⅡ DNA marker;1:Bio3-TetR-prrnO1O2-GFP用Hind Ⅲ单酶切;2:Bio3-prrnO1O2-GFP用Hind Ⅲ/Xba Ⅰ双酶切;3:Bio3-ppsbA-TetR用Sal Ⅰ/Kpn Ⅰ双酶切 |
|
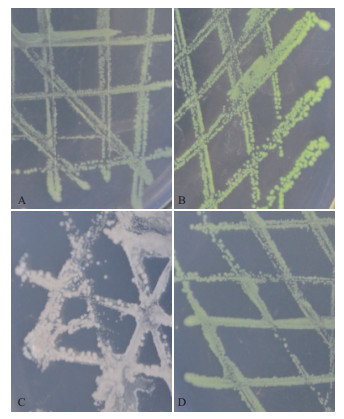
| 图 5 prrnO1O2启动子及四环素诱导下的GFP在大肠杆菌中表达情况 A:Bio-ppsbA-GFP;B:Bio-prrnO1O2-GFP;C:Bio3-TetR-prrnO1O2-GFP未添加Tc;D:Bio3-TetR-prrnO1O2-GFP添加Tc |
如图 4所示,将构建四环素诱导下的GFP基因的表达载体Bio3-TetR-prrnO1O2-GFP使用Hind Ⅲ单酶切,获得大小约为1 100 bp的ppsbA+TetR+psbA表达盒;将Bio3-prrnO1O2-GFP表达载体用Hind Ⅲ/Xba Ⅰ双酶切,得到约为250 bp的prrnO1O2启动子;将Bio3-ppsbA-TetR使用Sal Ⅰ/Kpn Ⅰ双酶切得到约为700 bp的TetR基因。综上,构建的3个表达载体构建成功。
2.4 四环素诱导基因表达的浓度筛选将构建Bio3-ppsbA-TetR在60 μg/mL的Amp LB固体培养基上,同时设置四环素浓度梯度,结果(表 2)显示,在四环素的浓度为5 μg/mL时大肠杆菌菌体正常生长,而10 μg/mL时大肠杆菌没有生长,更高浓度时也没有生长,说明四环素的使用最高浓度为5 μg/mL。
将构建好的表达载体Bio3-prrnO1O2-GFP转化大肠杆菌Transetta(DE3)中,在含60 μg/mL的Amp LB固体培养基上,菌株大量生长,且GFP表达,菌体呈明亮的绿色(图 5-B)。表明新合成的叶绿体启动子prrnO1O2能够在大肠杆菌中启动下游基因的表达。
2.6 四环素调控下的叶绿体启动子活性检测构建四环素诱导下的GFP基因表达载体Bio3-TetR-prrnO1O2-GFP。在60 μg/mL的Amp培养基上(未添加Tc),含有该表达质粒的大肠杆菌能够正常生长,但是GFP基因没有表达出绿色荧光蛋白(图 5-C),说明TetR蛋白表达后结合到prrnO1O2启动子的核心操纵区上,抑制了prrnO1O2启动子的功能;而后加入5 μg/mL的Tc,大肠杆菌能够正常生长,GFP蛋白表达,显示出绿色的菌体(图 5-D)。可以说明,ppsbA+TetR+psbA表达盒表达出的TetR蛋白抑制了prrnO1O2启动子,在四环素存在的情况下重新释放prrnO1O2启动子活性,启动下游基因表达。
3 讨论叶绿体基因在进化历程中有许多转移到核基因组中,遗留在叶绿体中的基因是功能必需的基因,且它们都具有原核性的遗传表达体系。外源基因定点插入整合到叶绿体基因组,具有原核生物基因的特点[19],所以在原核细胞中对叶绿体启动子进行检测,可以说明叶绿体启动子的活性。现在对四环素的TetR-tetO的作用分子机理已经明确:TetR结合大肠杆菌转座子Tn10的两个核心操纵子tetO序列(图 1)DNA,行使转录遏制作用,四环素阻止TetR结合tetO序列,使TetR解除转录抑制作用。O1、O2操纵子均有19 bp,一个核心碱基以及两个反向互补的区域。TetR氨基酸N端的螺旋-转角-螺旋基序与每个区域直接作用,且特异性极高[17, 18]。因此本研究参考该分子机理,将tet两个核心操纵区嵌入prrn启动子中,并连接到GFP基因的上游,在大肠杆菌中表达出绿色荧光蛋白,说明新合成的启动子能够启动下游基因的表达。
植物叶绿体psbA启动子是叶绿体基因工程中常用的启动子,对于该启动子的研究早有报道。Elhai[20]证明启动子psbA是鱼腥藻7120的内源强启动子,成为鱼腥藻穿梭表达载体最常用的启动子之一。张伟等[21]成功地从莱茵衣藻基因组中克隆出叶绿体psbA启动子片段,获得了氨苄青霉素和壮观霉素抗性菌落,验证了启动子活性;晁岳恩等[22]对水稻、小麦、玉米、高粱、大豆、番茄和马铃薯等11种植物的叶绿体psbA基因进行了分析,结果表明,11种植物psbA基因的ENC(effective number condon)值都小于40,显示出了明显的密码子偏好性。由于本研究中的Bio-GFP中的prrn启动子与新合成的prrnO1O2序列基本相同,不便于表达载体的构建与检测,故本研究从烟草基因组中扩增得到叶绿体启动子psbA,并构建了该启动子下的Bio3-ppsbA-GFP验证该启动子的活性,并表明该启动子能够启动GFP基因的表达。
已有报道水培中含有1 mg/L的Tc对植株没有生理影响[23-26]。对四环素诱导的转基因烟草进行了Tc诱导浓度的筛选,结果表明低浓度的Tc(0.1、0.2 mg/L)的诱导效果最好。当用0.2 mg/L的Tc处理TetR转基因烟草时,叶绿素含量达到最高。四环素作为诱导剂的通常使用浓度为200 mg/L,但在大肠杆菌中Tet调控的浓度不同[27]。LoVullo等[28]将Tet操纵子序列克隆到土拉热杆菌ESL启动子中,并带有可表达的TetR,CDABE位于杂合四环素调控启动子的下游,加入无水四环素后转录起始,诱导浓度在达到500 mg/L时细菌无法生长。本研究中适用的E. coli(DE3)诱导表达的最高浓度为5 μg/mL,高于上述的土拉杆菌最高使用浓度相同。构建的Bio3-TetR-prrnO1O2-GFP表达载体在无Tc诱导时,表达出来的TetR蛋白结合到prrnO1O2启动子的核心操纵子区域,使该合成的启动子无法驱动下游GFP基因的表达;而在加入5 μg/mL的Tc时,prrnO1O2启动子重新驱动下游GFP基因的表达,使菌落呈现出绿色,表达量降低,可能是由于aadA抗性基因被切除,影响了GFP的表达,具体原因仍需进一步验证。
4 结论带有四环素核心操纵区的prrnO1O2启动子和叶绿体ppsbA启动子均在大肠杆菌中具有启动活性,在四环素调控下叶绿体prrnO1O2启动子能够启动下游GFP基因的表达,在大肠杆菌中表现出绿色菌体。
| [1] | Schmidt S, Berens C, Klotzsche M. A novel TetR-regulating peptide turns off rtTA-mediated activation of gene expression. PLoS One, 2014, 9 (5): e96546. DOI:10.1371/journal.pone.0096546 |
| [2] | Normanno D, Boudarène L, Dugast-Darzacq C. Probing the target search of DNA-binding proteins in mammalian cells using TetR as model searcher. Nature Communications, 2015, 6 : 7357. DOI:10.1038/ncomms8357 |
| [3] | Huang HH, Seeger C, Danielson UH. Analysis of the leakage of gene repression by an artificial TetR-regulated promoter in cyanobacteria. BMC Research Notes, 2015, 8 (1): 459. DOI:10.1186/s13104-015-1425-0 |
| [4] | Klotzsche M, Berens C, Hillen W. A peptide triggers allostery in Tet repressor by binding to a unique site. Journal of Biological Chemistry, 2005, 280 : 24591–24599. DOI:10.1074/jbc.M501872200 |
| [5] | Klotzsche M, Goeke D, Berens C. Efficient and exclusive induction of Tet repressor by the oligopeptide Tip results from co-variation of their interaction site. Nucleic Acids Research, 2007, 35 : 3945–3952. DOI:10.1093/nar/gkm357 |
| [6] | Daam J, Mehdaoui K, Klotzsche M. Functionally important residues of the Tet repressor inducing peptide TIP determined by a complete mutational analysis. Gene, 2008, 423 : 201–206. DOI:10.1016/j.gene.2008.07.004 |
| [7] | Goeke D, Kaspar D, Stoeckle C. Short peptides act as inducers, anti-inducers and co-repressors of Tet Repressor. Journal of Molecular Biology, 2012, 416 : 33–45. DOI:10.1016/j.jmb.2011.12.009 |
| [8] | Luckner SR, Klotzsche M, Berens C. How an agonist peptide mimics the antibiotic tetracycline to induce Tet-repressor. Journal of Molecular Biology, 2007, 368 : 780–790. DOI:10.1016/j.jmb.2007.02.030 |
| [9] | Sevvana M, Goetz C, Goeke D. An exclusive alpha/beta code directs allostery in TetR-peptide complexes. Journal of Molecular Biology, 2012, 416 : 46–56. DOI:10.1016/j.jmb.2011.12.008 |
| [10] | Boynton JE, Gillham NW, Harris EH. Chloroplast transformation in Chlamydomonas with high velocity microprojectiles. Science, 1988, 240 : 1534–1538. DOI:10.1126/science.2897716 |
| [11] | Svab Z, Hajdukiewicz P, Maliga P. Stable transformation of plastids in higher plants. Proceedings of the National Academy of Sciences, 1990, 87 : 8526–8530. DOI:10.1073/pnas.87.21.8526 |
| [12] | 钱雪艳, 杨向东, 郭东全. 植物叶绿体遗传转化及研究进展. 分子植物育种, 2008, 6(5): 959–966. |
| [13] | Iamtbam S, Day A. Removal of antibiotic resistance genes from trangenic tobacco plastids. Nat Biotehnol, 2000, 18 (11): 1172–1176. DOI:10.1038/81161 |
| [14] | Hajdukiewicz PTJ, Gilbertson L, Staub JM. Multiple pathways for Cre/lox-mediated recombination in plastids. The Plant Journal, 2001, 27 (2): 161–170. DOI:10.1046/j.1365-313x.2001.01067.x |
| [15] | Corneille S, Lutz K, Svab Z. Efficient elimination marker genes from the plastid genome by the CRE-lox site-specific recombination system. The Plant Journal, 2001, 27 (2): 171–178. DOI:10.1046/j.1365-313x.2001.01068.x |
| [16] | Quanten L, Chaerle L, Noben JP. Effects of tetracycline on wild-type and inducible P35So IPT-5/TETR transgenic tobacco plants. Physiologia Plantarum, 2007, 130 (2): 290–300. DOI:10.1111/ppl.2007.130.issue-2 |
| [17] | Frohberg C, Heins L, Gatz C. Characterization of the interaction of plant transcription factors using a bacterial repressor protein. Proceedings of the National Academy of Sciences, 1991, 88 (23): 10470–10474. DOI:10.1073/pnas.88.23.10470 |
| [18] | 胡华刚.热激与四环素双重诱导调控的植物基因表达系统研究[D].重庆:西南大学, 2007. |
| [19] | 孙士群.质体定位蛋白Pt-mVirD2的编码基因合成与T-DNA型烟草质体转化载体的构建[D].重庆:西南大学, 2009. |
| [20] | Elhai J. Strong and regulated promoters in cyanobacterium Anabaena PCC7120. FEMS Microbiology Letters, 1993, 114 (2): 179–184. DOI:10.1111/fml.1993.114.issue-2 |
| [21] | 张伟, 苏忠亮, 冯鑫. 莱茵衣藻叶绿体PsbA启动子的克隆及其活性验证. 科学技术与工程, 2011, 11(19): 4410–4413. |
| [22] | 晁岳恩, 吴政卿, 杨会民, 等. 11种植物psbA基因的密码子偏好性及聚类分析. 核农学报, 2011, 25(5): 927–932. |
| [23] | Gatz C, Frohberg C, Wendenburg R. Stringent repression and homogeneous de-repression by tetracycline of a modified CaMV 35S promoter in intact transgenic tobacco plants. The Plant Journal, 1992, 2 (3): 397–404. |
| [24] | Gatz C. Novel inducible/repressible gene expression systems. Methods in Cell Biology, 1995, 50 : 411–424. DOI:10.1016/S0091-679X(08)61047-X |
| [25] | Zeidler M, Gatz C, Hartmann E. Tetracycline-regulated reporter gene expression in the moss Physcomitrella patens. Plant Molecular Biology, 1996, 30 (1): 199–205. DOI:10.1007/BF00017815 |
| [26] | Petracek ME, Dickey LF, et al. Ferredoxin-1 mRNA is destabilized by changes in photosynthetic electron transport. Proceedings of the National Academy of Sciences, 1998, 95 (15): 9009–9013. DOI:10.1073/pnas.95.15.9009 |
| [27] | Bertram R, Hillen W. The application of Tet repressor in prokaryotic gene regulation and expression. Microbial Biotechnology, 2008, 1 (1): 2–16. |
| [28] | LoVullo ED, Miller CN, Pavelka MS. TetR-based gene regulation systems for Francisella tularensis. Applied and Environmental Microbiology, 2012, 78 (19): 6883–6889. DOI:10.1128/AEM.01679-12 |






