微生物已经成为新型抗感染药物的重要来源之一。并且随着分离技术的不断进步,分离水平的不断发展,更多的微生物可能会被人类发现利用。经研究发现,植物内生菌存在于各种药用植物中,菌株分布广种类多,且在与宿主长期进化过程中,形成了产生某些与宿主植物有着相同或者相似药用价值能力的化合物。因此,药用植物内生菌是一类具有重大开发潜力的微生物资源。
豨莶草为菊科植物的干燥地上部分,味苦、辛,性寒,小毒,归肝肾经,可以祛风湿、通经络、清热解毒,治风湿痹痛、筋骨不利、腰膝无力、半身不遂、高血压、疟疾、黄疸、痈肿疮毒、风疹湿疮、虫兽咬伤[1]。近年来,国内外学者对豨莶草的研究越来越重视[2-4],但有关其内生菌资源的研究至今未见报道。
本研究以豨莶草中筛选分离得到的具有抗感染活性的内生细菌菌株为研究对象,并阐述其相关生物学特性,旨在为进一步研究该菌株的抗感染代谢产物提供理论依据。
1 材料与方法 1.1 材料 1.1.1 药用植物所用材料为无病虫害、刚成熟的豨莶草果实,采自河南省洛阳市汝阳县岘山。
1.1.2 指示菌5种病原细菌均由河南科技大学第一附属医院检验科细菌室提供。
1.1.3 主要试剂实验中使用的PCR酶和DNA Marker购自大连宝生物公司;两性霉素B购自上海生工;7种药敏片(浓度均为30 μg/片)购自北京赛为思生物技术开发中心;微量生化鉴定管购自杭州微生物试剂有限公司;其他化学试剂购自国药集团。
1.1.4 培养基组分内生细菌分离采用改进的LB琼脂培养基(g/L):胰蛋白胨10,酵母粉5,氯化钠10,葡萄糖5,琼脂粉20。液体发酵采用改进的LB液体培养基。为抑制真菌生长,以上培养基使用前,均需加入终浓度为50 μg/mL的两性霉素B(用二甲基亚砜溶解)。
1.2 方法 1.2.1 内生细菌的分离与纯化内生细菌的分离是通过组织表面消毒来去除表生菌,具体操作如下[5]:取新鲜豨莶草果实,用自来水洗净,消毒纸吸干,灭菌刀片去皮,然后用无菌水再清洗一遍,接着用75%乙醇浸泡3 min后,用0.1%氯化汞漂洗1-2 min,最后用无菌水冲洗3次并吸干。将消毒后的果实切成6 mm大小的组织块,种植于LB琼脂平板上,于37℃静置培养24 h,挑取少许划线接种到新的LB琼脂培养基上,反复纯化至单一纯菌落,置于4℃冰箱保存待用。为检测试验材料表面是否彻底消毒,取以上最后1次无菌水冲洗液涂布于LB平板上,于同等条件下培养作为对照,如对照平板无菌落长出即表明消毒彻底,后续试验所分离到的细菌来自果实内部,即为内生菌。
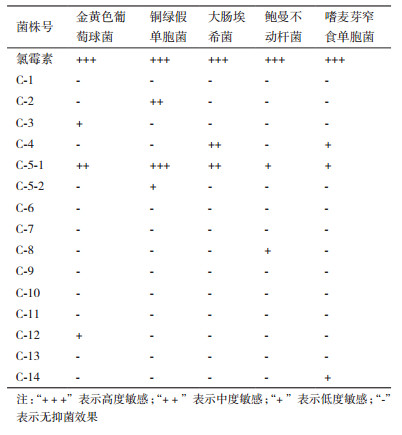
1.2.2 拮抗细菌的筛选以病源细菌--金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、鲍曼不动杆菌和嗜麦芽窄食单胞菌为指示菌,采用平板对峙法,每一种待测纯菌落需做3次重复。无菌条件下,取100 μL指示菌悬液(1×107 CFU/mL)均匀涂布于LB平板上,将每个平板均分成4等份,20 min后将直径约为6 mm的待测菌块(琼脂)贴附于指示菌平板中央(每一等份),37℃培养24 h,观察各培养板指示菌的生长状况及抑菌圈大小(包含菌块直径6 mm,下同),同时作阳性对照(以氯霉素药片代替菌块)。各菌株拮抗效果的判定标准为:抑菌圈直径 > 15 mm为高度敏感,抑菌圈直径11-15 mm为中度敏感,抑菌圈直径7-10 mm为低度敏感,无抑菌圈者为不敏感[6]。
1.2.3 菌种鉴定(1)形态学鉴定:参照《常见细菌系统鉴定手册》,革兰氏染色和芽孢染色光学显微镜镜检,记录其显微形态。(2)生理生化鉴定:参照《常见细菌系统鉴定手册》,对待测菌株进行相关生理生化指标测定(微量生化鉴定管)。(3)分子鉴定:将待测菌株接种于LB液体培养基中,37℃摇床过夜培养,CTAB法提取基因组,细菌16S rRNA基因通用引物27F(5'-AGAGTTTGATCCTGGTCAG-AACGAACGCT-3')和1492R(5'-TACGGCTACCTTG-TTACGACTTCACCCC-3')对提取的基因组DNA进行PCR扩增[7]。所得PCR产物送至上海生工测序。在NCBI数据库上进行序列相似性分析,再利用MEGA 5.1软件构建系统发育进化树。
1.2.4 药敏试验为了后续试验的开展,本研究需要对待测菌和5种指示菌做药敏试验。结合指示菌的临床药敏试验结果,选取了6种药敏片,即头孢他啶、头孢噻肟、复方新诺明、氨苄西林、青霉素以及四环素。
1.2.5 生长特性分析待测菌经LB液体活化3次,取活化好的种子液以1%的接种量分别接种到不同pH梯度(3.0、5.0、7.0、9.0、10.0和11.0)和NaCl浓度(1%、2%、5%、10%、15%和20%)的LB液体培养基中,37℃培养12 h后,在600 nm波长下测定OD值,以上每个梯度分别设置3个重复(为了满足所测得的吸光度值与细菌浓度成线性比例关系,本实验首先将不同梯度下的培养液进行稀释至OD600=0.3-0.7,然后将所测得的具体数值乘以稀释倍数即为该梯度下的OD600值)。
1.2.6 抗菌代谢产物的初步纯化将待测菌株接入LB液体培养基中(50 mL),30℃,220 r/min振荡培养48 h。发酵液经离心(8 000 r/min,10 min)去除菌体得上清,然后用等体积的乙酸乙酯萃取3次,有机相和水相分别经旋转蒸发浓缩至干,用2 mL无菌水将其溶解,取200 μL测量对指示菌的拮抗活性,重复操作3次。将有抗菌活性的水溶液依次经过截留相对分子质量(Mr)为10 kD、5 kD和2 kD的超滤离心管,4℃,12 000 r/min下离心30 min,分别收集相应的滤出液及截留液,放入-70℃冰箱冻存,并进行冷冻干燥,得到的冷冻干燥粉末-70℃保存备用。使用前再将干燥粉末加入中2 mL无菌水,分别获得滤出液及截留液。
2 结果 2.1 内生细菌的分离及抑菌效果如表 1所示,从豨莶草果实中共分离得到15株内生细菌,其中具有抑菌活性的8株,较明显的3株,编号为C-2、C-4、C-5-1,尤以菌株C-5-1的效果最好,对提供的几种病原细菌均显示出一定的抑制作用(金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌中度敏感以上),图 1为菌株C-5-1对铜绿假单胞菌的抑菌活性。说明该菌株是一种广谱的抗感染细菌且效果显著,具有较高的研究价值和应用前景。因此,本研究后续实验的开展就是以C-5-1为实验菌株。

|
| 图 1 菌株C-5-1(A、C)和C-6(B、D)对铜绿假单胞菌的抑菌效果 |
光学显微镜染色观察,菌株C-5-1的细胞呈杆状,芽孢侧生。革兰氏染色结果可变,对数期时染色结果为阳性,稳定期时变为阴性。
通过表 2所得的16项生理生化试验结果,结合形态学特征,依据《伯杰氏细菌系统鉴定手册》,判断该菌株可能是侧孢短芽孢杆菌(Brevibacillus laterosporus)。
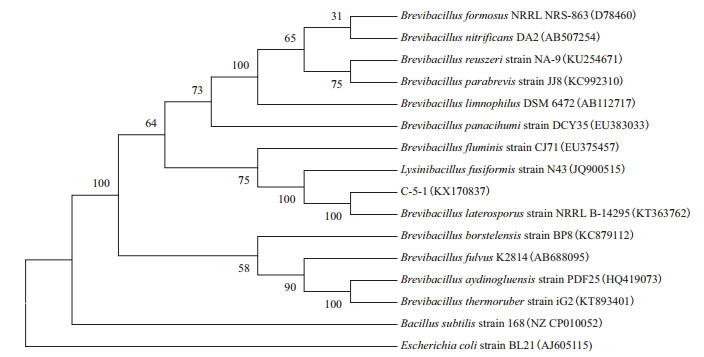
以菌株C-5-1的基因组DNA为模板,PCR扩增和测序获得了16S rRNA基因的部分片段(1 438 bp),NCBI GenBank登录号为KX170837。选择同源性较近的菌株与C-5-1构建系统发育进化树,结果显示(图 2)该菌株与侧孢短芽孢杆菌的同源关系最近。结合形态学和生理生化鉴定结果,确定为侧孢短芽孢杆菌,该菌株被命名为C-5-1。
|
| 图 2 基于16S rRNA基因序列相似性构建的系统发育树 |
药敏试验结果(表 3)表明,5种指示菌对氨苄西林均完全耐药,而本研究所分离得到的菌株C-5-1对氨苄西林是高度敏感的。因此,在后续摸索抗菌代谢物的纯化方案中,可以向LB固体培养基中加入适宜浓度的氨苄西林,以抑制发酵液和纯化液中菌株C-5-1的生长,而指示菌(铜绿假单胞菌)正常生长。
分别测定细菌在不同酸碱度和盐度的生长特性,从而为该菌株的进一步培养和发酵利用提供依据。结果(表 4)显示,侧孢短芽孢杆菌C-5-1在低pH环境中耐受性有限,在pH≤5.0时几乎没有生长,但在pH≥7.0时生长良好,并且随着pH值的升高,菌体量也一直在增加,这说明该菌株耐碱不耐酸。菌株C-5-1在NaCl盐度≤5%(相当于50 g/L)时正常生长,但随着盐度的增加该菌株的生长受到了一定的抑制,当盐度≥15%时,其生长受到了完全抑制甚至死亡。这是因为不同盐度能形成不同渗透压环境,造成细胞不同程度的脱水,从而降低生长速率,甚至失活。
由表 5可知,侧孢短芽孢杆菌C-5-1发酵液的乙酸乙酯相和水相都有明显的抑菌圈,直径分别为(28.3±0.8)mm和(29.9±0.5)mm,指示菌为铜绿假单胞菌,这说明该菌株不止产生一种抗菌物质。后又通过超滤离心管对二者进行了纯化,研究表明这两种抗菌代谢产物的分子量均小于2 000。
内生细菌在适宜生境中能通过发酵获得大量目的活性产物,从而可以缓解某些药用植物资源短缺、生长周期长、生态系统损害等现象,并能为新药开发与濒危药用植物保护等难题提供重要思路[8, 9]。由于病原菌耐药性增加等问题的日益凸显,使得寻求天然、高效、绿色的替代品更加重要。
侧孢短芽孢杆菌最初是由Laubach[10]于1916年从淡水中分离得到,并根据它的形态及生理生化特性将其归为芽孢杆菌属,到1996年,Shida等[11]按近代生物分类学将其重新划分为短芽孢杆菌属。据报道侧孢短芽孢杆菌具有广谱抗菌活性,尤其是对细菌和真菌[12]。近期的全基因组测序结果表明,侧孢短芽孢杆菌还具有产生聚酮化合物和非核糖体肽等多种抗感染药物的潜力,因此其医用功能潜力巨大[13-15]。Barsby等[16]从巴布亚新几内亚海岸热带海水中分离得到一株侧孢短芽孢杆菌,能产生聚酮类Basiliskamides等多种化合物,可以有效抑制大肠埃希菌和白色念珠菌。同样也是从海洋中分离得到的菌株PNG276能明显地抑制肠球菌的生长[17]。Yang等[18]从菌株OSY-I1分离到一种能抗革兰氏阳性菌生长的脂肽抗生素Brevibacillin。本研究从豨莶草果实中获得一株具有较强抗感染活性的耐碱侧孢短芽孢杆菌C-5-1,并且结合其代谢产物的物化性质,推测它们可能是新型抗菌物质。预示着该菌株具有非常高的开发价值,极可能取代部分抗生素进行应用。
由于后续对菌株C-5-1抗感染活性的研究是以其代谢产物为主,为了降低成本和缩短时间,本研究开展了实验菌株C-5-1与5种指示菌的药敏试验,以期筛选到对C-5-1高度敏感而对指示菌耐药的抗生素,结果表明氨苄西林能满足此要求。在测量抑菌活性时,首先向熔化的固体培养基中加入适宜浓度的氨苄西林,然后指示菌涂布于平板表面,并将待测样品直接置于平板中央0.8 cm的孔中。如果按传统做法,样品需要经过孔径为0.22 μm的滤膜过滤后再加入。
4 结论豨莶草可作为优良微生物资源的来源,从而为开发新型天然抗感染药物提供宝贵的资源。
| [1] | 国家药典委员会. 中华人民共和国药典[M]. 北京: 化学工业出版社, 2015: 348. |
| [2] | Lu Y, Qian RQ, Xiao J, et al. Kirenol attenuates experimental autoimmune encephalomyelitis by inhibiting differentiation of Th1 and Th17 cells and inducing apoptosis of effect or T cells. Scientific Reports, 2015, 5 : 9022. DOI:10.1038/srep09022 |
| [3] | Lu Y, Qian R, Xiao J, et al. Kirenol, a compound from Herba siegesbeckiae, induces apoptosis in human chronic myeloid leukemia K562 cells. Pharmazie, 2014, 69 (2): 148–153. |
| [4] | Hwang JH, Kim JD. Inhibitory effects of Siegesbeckiae herba extract on angiogenesis and adipogenesis. Biotechnology and Bioprocess Engineering, 2011, 1 (16): 144–152. |
| [5] | 柴明艳. 车前草内生真菌的分离及抑菌活性测定. 江苏农业科学, 2016, 44(1): 353–356. |
| [6] | 周邦靖. 常用中药的抗菌作用及其测定方法[M]. 重庆: 科学技术文献出版社重庆分社, 1987: 100-299. |
| [7] | Marchesi JR, Sato T, Weightman AJ, et al. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA. Applied and Environmental Microbiology, 1998, 64 (2): 795–799. |
| [8] | 史应武, 娄恺, 李春. 植物内生菌在生物防治中的应用. 微生物学杂志, 2009, 11(6): 61–64. |
| [9] | 黄午阳. 植物内生真菌的抗菌活性研究. 南京中医药大学学报, 2005, 21(1): 24–26. |
| [10] | Laubach CA. Studies on aerobic spore-bearing non-pathogenic bacteria partⅡ. Spore-bearing organisms in water. Journal of Bacterial, 1916, 1 (5): 506–512. |
| [11] | Shida O, Takagi H, Kadowaki K, et al. Proposal for two new genera, Brevibacillus gen. nov. and Aneurinibacillus gen. Nov. International Journal of Systematic and Evolutionary Microbiology, 1996, 46 (4): 939–946. |
| [12] | 陈潺, 陈升富, 王建宇, 等. 侧孢短芽孢杆菌的应用研究进展. 山东农业科学, 2015, 47(2): 149–156. |
| [13] | Djukic M, Poehlein A, Thürmer A, et al. Genome sequence of Bre-vibacillus laterosporus LMG 15441, a pathogen of invertebrates. Journal of Bacterial, 2011, 193 (19): 5535–5536. DOI:10.1128/JB.05696-11 |
| [14] | Sharma V, Singh PK, Midha S, et al. Genome sequence of Brevibacillus laterosporus strain GI-9. Journal of Bacterial, 2012, 194 (5): 1279. DOI:10.1128/JB.06659-11 |
| [15] | Hong HA, Duc LH, Cutting SM. The use of bacterial spore formers as probiotics. FEMS Microbiology Rev, 2005, 29 (4): 813–835. DOI:10.1016/j.femsre.2004.12.001 |
| [16] | Barsby T, Kelly MT, Andersen RJ. Tupuseleiamides and basiliskamides, new acyldipeptides and antifungal polyketides produced in culture by a Bacillus laterosporus isolate obtained from a tropical marine habitat. Journal of Natural Products, 2002, 65 (10): 1447–1451. DOI:10.1021/np0201321 |
| [17] | Desjardine K, Pereira A, Wright H, et al. Tauramamide, a lipopeptide antibiotic produced in culture by Brevibacillus laterosporus isolated from a marine habitat: Structure elucidation and synthesis. Journal of Natural Products, 2007, 70 (12): 1850–1853. DOI:10.1021/np070209r |
| [18] | Yang X, Huang E, Yuan CH. Isolation and structural elucidation of Brevibacillin, an antimicrobial lipopeptide from Brevibacillus laterosporus that combats drug-resistant Gram-positive bacteria. Applied and Environmental Microbiology, 2016, 82 (9): 2763–2772. DOI:10.1128/AEM.00315-16 |